米曲霉40214高产中性蛋白酶发酵条件的优化*
张彬彬,杨春华,窦博鑫,刘琳琳,邹丽宏,石彦国,刘 颖
(哈尔滨商业大学食品工程学院,哈尔滨 150076)
米曲霉40214高产中性蛋白酶发酵条件的优化*
张彬彬,杨春华,窦博鑫,刘琳琳,邹丽宏,石彦国,刘 颖**
(哈尔滨商业大学食品工程学院,哈尔滨 150076)
运用现代生物学技术,对米曲霉40214菌株发酵产中性蛋白酶的培养基组分及培养条件进行优化,旨在提高菌株产中性蛋白酶的产量。通过单因素实验和正交实验确定了发酵培养基的最佳组分,添加葡萄糖8.0%,酵母粉4.0%,Na2HPO40.10%;最适发酵条件为发酵温度28℃,初始pH值6.5,发酵时间96 h,加水量60.0%,经过优化后酶活性提高了1.75倍,达到2 845.68 U/mL,实验为进一步提高米曲霉40214菌株产中性蛋白酶的能力并将其应用到食品发酵中奠定了理论基础。
米曲霉;中性蛋白酶活力;发酵条件
中性蛋白酶是一种最早发现并应用于生产的工业酶制剂,现在已经广泛应用在毛皮、皮革、丝绸、食品、医药、酿造等方面[1-9],在食品和医药工业中尤为突出。但中性蛋白酶成本高、产量低等因素限制了其大规模生产[10-11]。因此,对该酶类生产技术的研究得到了广泛关注。
微生物蛋白酶,主要由细菌、霉菌[12-14],其次由放线菌、酵母菌生产。米曲霉的酶系复杂,胞内酶有氧化还原酶等[15];分泌的胞外酶有蛋白酶、糖化酶、淀粉酶、果胶酶、谷氨酰胺酶、纤维素酶、半纤维素酶等。米曲霉是酱油酿造中的常用生产菌株,具有很强的糖化淀粉和分解蛋白质的能力,酱油酿造的过程,就是利用种曲培养米曲霉,使其能够大量繁殖,分泌多种酶,其中最为主要的是蛋白酶和淀粉酶[16-17]。其中,蛋白酶活性的高低对于保证产品品质、提高原料利用率和控制生产成本具有重要作用[18]。
1 材料与方法
1.1 菌种与试剂
菌种:米曲霉40214(CICC);干酪素、营养琼脂、蛋白胨、牛肉粉、酵母浸粉:北京双旋微生物培养基制品厂;氯化钠、氯化钙、磷酸氢二钠、磷酸二氢钠、无水碳酸钠、三氯乙酸、福林酚试剂[19](分析纯):西陇化工股份有限公司。
1.2 仪器设备
单人洁净工作台:北京东联哈尔滨仪器制造有限公司;722型分光光度计:上海仪分科学仪器有限公司;雷磁PHS-3C pH计:南京互川电子有限公司;XFS-280手提式压力蒸汽灭菌锅:浙江新丰医疗器械有限公司;DKZ电热恒温震荡水槽、电热恒温培养箱:上海-恒科学仪器有限公司;80-2离心机:上海浦东光学仪器厂。
1.3 实验方法
1.3.1 米曲霉初始发酵条件 种子培养基:蔗糖30.0 g,NaNO33.0 g,MgSO4· 7H2O 0.5 g,KCl 5.0 g,FeSO4· 4H2O 0.01 g,KH2PO41.0 g,琼脂15.0 g,加入蒸馏水 1 000 mL,在pH 6.0~6.5,121℃、0.1MPa条件下,灭菌20min;基础发酵培养基:麸皮10.0 g,加蒸馏水8 mL,在121℃、0.1MPa下,灭菌20min。
吸取10mL无菌水加入菌种斜面三角瓶中,用接种环将三角瓶内斜面上的孢子轻轻刮下,倒入带有4层擦镜纸(灭菌)的无菌漏斗过滤,将过滤后的菌液注入到无菌并盛有小玻璃珠的50mL三角瓶中,同样方法重复3次,将剩余的孢子全部冲洗干净,28℃、200 r/min,振荡30min,使孢子充分分散,要求孢子分散率超过90.0%,得到单孢子悬液。将菌悬液以2.0%(V/V)的接种量接入发酵培养基(100/250mL),28℃、pH 7.0、培养72 h,以中性蛋白酶活力作为评价指标。
1.3.2 米曲霉产中性蛋白酶发酵培养基优化 单因素实验:分别考察碳源种类及其添加量、氮源种类及其添加量和无机盐对产中性蛋白酶的影响;正交实验:在单因素实验基础上,确定碳源、氮源、无机盐这3个因素对米曲霉菌株产蛋白酶活力具有显著性影响(P<0.05),选取L9(34)正交表分别进行进一步的优化实验,以中性蛋白酶活力为评价指标,进行米曲霉发酵培养基组分的优化。
1.3.3 米曲霉产中性蛋白酶发酵培养条件优化 利用优化的培养基,采用单因素对培养条件进行优化,分别考察时间、温度、初始pH、加水量对产中性蛋白酶的影响。
1.3.4 中性蛋白酶活力测定 按照国家标准(GB/T23527—2009),采用Folin-酚法测定中性蛋白酶活力[20]。
2 结果与分析
2.1 碳源种类对米曲霉产中性蛋白酶的影响
由图1可知,实验选取的几种碳源,均能够被米曲霉利用产生蛋白酶。对于菌株40214在葡萄糖(P<0.05)作为碳源时所产酶活最大,为1 920.59U/mL,淀粉次之,菌种对这2种碳源利用效果较好,这可能与菌体蛋白酶系的合成有关。而以蔗糖作为碳源时,菌株酶活最低为1 800.55U/mL。结果可能说明单糖比二糖更能促进菌体产酶,因而选择葡萄糖作为碳源。

图1 碳源对米曲霉产中性蛋白酶的影响
2.2 氮源种类对菌株产中性蛋白酶的影响
在微生物的代谢过程中,氮源主要被转化为核酸、氨基酸以及构成细胞壁的成分,并且是微生物生长的主要营养。由图2可知,选取的几种氮源,在相同培养时间,产酶能力有所不同,酵母粉(P<0.05)作为氮源时,菌株40214产酶活力最佳,为2 057.25 U/mL。当选用大豆粉作氮源时,菌株产酶能力只是略低于酵母粉,为2 023.95 U/mL,考虑到实际的生产情况,选择大豆粉作为氮源更能节约成本,并且达到良好的产酶效果。
2.3 葡萄糖添加量对米曲霉产中性蛋白酶的影响
碳源是霉菌发酵中所需最大的营养物质,碳源添加量直接影响菌种的产酶情况。由图3可以看出,当葡萄糖添加量为2.0%~8.0%时,菌株40214的蛋白酶活显著上升(P<0.05),达到8.0%时对碳源的利用效果最好,产生的酶活最高,达到2 097.30U/mL,随着碳源浓度的继续增加,可看出酶活力有较显著下降,可知高浓度的葡萄糖比低浓度葡萄糖对产酶有较高的影响。

图2 氮源种类对米曲霉产中性蛋白酶的影响

图3 葡萄糖添加量对米曲霉产中性蛋白酶的影响
2.4 酵母粉添加量对米曲霉产中性蛋白酶的影响
酶本身是蛋白质,而氮元素是构成蛋白质的主要元素,因此氮源添加量对于产酶有重要作用。实验测定了不同添加量的酵母粉对菌株产酶的影响,由图4可以看出,当酵母粉添加量为2.0%~4.0%时,菌株40214的蛋白酶活显著上升(P<0.05),当酵母粉添加量为4.0%时,菌株对氮源的利用效果达到最好,达到2 199.00 U/mL。而当酵母粉添加量高于4.0%时,由于浓度增加,会导致溶液变得粘稠,使底物流动性下降,不利于菌种生长及产酶。

图4 酵母粉添加量对米曲霉中性蛋白酶的影响
2.5 无机盐对米曲霉产中性蛋白酶活力的影响
由图5可以看出,Na2HPO4和KNO3(P<0.05)对菌株40214产酶均有促进作用,Na2HPO4的促进作用更明显,能够使酶活达到2 234.01 U/mL,由于Na+能使细胞膜内外渗透压改变,膜通透能力增加,而微生物原蛋白水解酶均为胞外酶,膜内外渗透压的改变有利于酶从膜内往外运输,并且Na+可能对目的菌株具有一定的激活作用,因而产酶效果较好。而添加的FeSO4和MgSO4对产酶均有不同程度的抑制作用,而FeSO4的抑制效果最明显,可能是由于FeSO4破坏了酶的次级键,改变了酶的三维结构,即变性作用,这种原因引起的酶活性降低或丧失叫做钝化作用[21]。
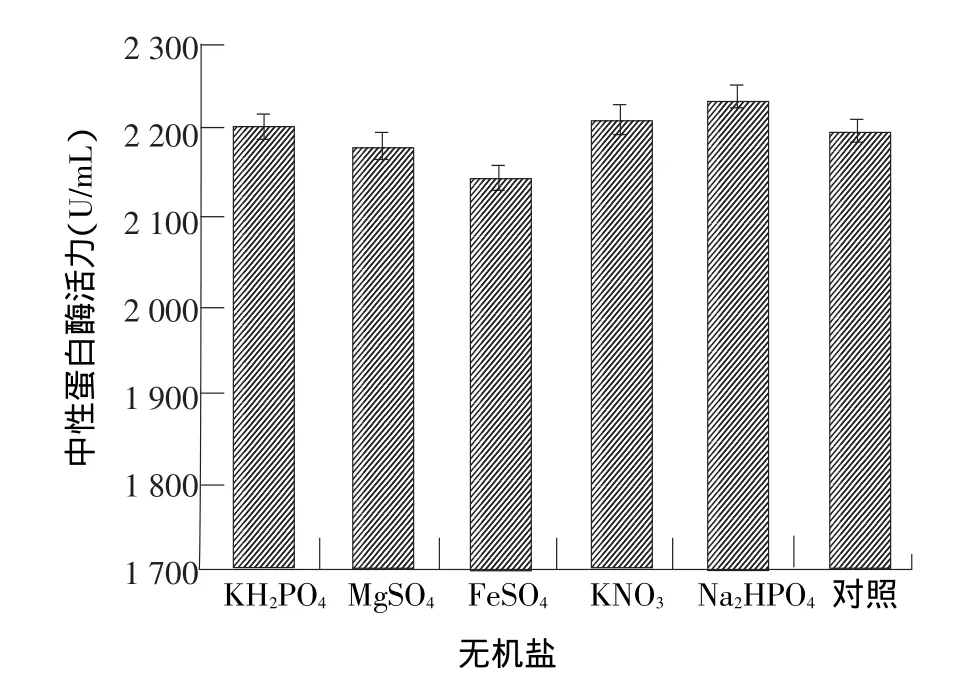
图5 无机盐对米曲霉产中性蛋白酶的影响
2.6 米曲霉产中性蛋白酶最佳发酵培养基优化
在单因素实验基础上,米曲霉40214选取对中性蛋白酶活力影响显著(P<0.05)的葡萄糖、酵母粉、Na2HPO4为考察对象,选用L9(34)分别进行正交实验,采用SPSS17.0进行分析,结果见表1、2。
米曲霉40214正交实验极差分析结果由表1可知,对蛋白酶活力影响大小为:Na2HPO4>葡萄糖>酵母粉,优化的最优产酶条件为A2B2C1,即葡萄糖8.0%、酵母粉4.0%、Na2HPO40.05%,与正交表中方案5符合,为2 227.35U/mL;由于Na2HPO4影响显著,当选择实验条件为A2B2C2,即葡萄糖8.0%、酵母粉4.0%、Na2HPO40.10%,在此条件下测得蛋白酶活力为2 233.57U/mL,因此选取A2B2C2为最优结果。
2.7 培养温度对米曲霉产中性蛋白酶的影响
由图6可知,发酵温度在24~28℃时,菌株产酶活力呈逐步升高的趋势(P<0.05),而当培养温度在28~40℃范围产酶活力下降,由于超过某一值时,会导致部分酶变性失活,化学反应速率和代谢减弱,代谢产物减少,最初大量繁殖的细菌会分解代谢产生热量,使底物浓度更高,促进细菌衰老[22]。菌株均在28℃时达到最适温度,此时40214菌株达到2 220.68U/mL。温度不仅影响各种酶的反应速率和蛋白质性质,还会影响发酵液的物理性质。温度升高使反应速率和生长代谢加快,提高微生物代谢物产量,但会导致菌体的衰老,并缩短了发酵周期,使产酶量减少。
2.8 培养时间对米曲霉产中性蛋白酶的影响
发酵时间影响菌体生长情况和蛋白酶产量。由图7可知,在发酵48 h内,发酵液中产酶量很低,培养时间在48~96 h时,菌株蛋白酶活力在逐渐上升(P<0.05),而当培养时间在96 h时,蛋白酶的活力达到最大值。在之后延长培养时间,蛋白酶活力有明显的(P<0.05)下降趋势,因在发酵后阶段,底物不断消耗的同时,微生物也在逐渐衰亡,导致产酶下降,也可能是因为菌体死亡导致细胞出现自溶现象导致的。所以培养时间均确 定为96 h,此时40214菌株达到2 695.82U/mL。

表1 米曲霉40214培养基优化正交实验结果

表2 米曲霉40214培养基优化正交实验结果方差分析
2.9 初始pH对米曲霉产中性蛋白酶的影响
由于发酵过程中的pH很难准确控制,所以选择控制发酵液的初始pH。由图8可知,菌株的初始pH在pH 5.5~6.5范围内产酶效果较好(P<0.05),pH为6.5时,菌种40214酶活最高,为2 735.83U/mL。说明中性培养基有利于菌株产酶;碱性培养基不利于菌株产酶。pH通过影响菌体营养物质离子化程度、细胞膜电荷及膜渗透性,从而影响菌体对养分的吸收。对于大多数菌种来说,一般具有保持其体内的细胞质酸度在近中性条件下的能力,利于新陈代谢和各种酶反应,但底物的pH对细胞的新陈代谢和产酶有间接的影响,在不同的初始pH下菌种的生长繁殖能力和产中性蛋白酶的能力存在一定的差异。
2.10 加水量对米曲霉产中性蛋白酶的影响
由图9可以看出,加水量在50.0%~60.0%时,随着培养基加水量的增加,菌株40214的蛋白酶活力显著增加(P<0.05),当加水量为60.0%时蛋白酶活力达到最大值,为2 845.68 U/mL,比50%时的2 312.34U/mL提高了1.23%,此后再提高加水量则不利于蛋白酶的产生。这是因为基质加水量过高,基质容易粘结成团,多孔性降低,不利于菌体获得营养,也影响氧气的传递;反之加水量过低,则使基质膨胀程度降低,水的活度低,抑制菌体生长。适宜的加水量有利于米曲霉生长繁殖及孢子的形成,从而影响中性蛋白酶的活性。

图6 培养温度对米曲霉产中性蛋白酶的影响

图7 培养时间对米曲霉产中性蛋白酶的影响

图8 pH对米曲霉产中性蛋白酶的影响

图9 加水量对米曲霉产中性蛋白酶的影响
3 结论
实验对米曲霉40214产中性蛋白酶的培养基及培养条件进行优化。对碳源种类、氮源种类、碳源添加量、氮源添加量和无机盐种类进行单因素实验,利用单因素实验结果,进一步进行正交实验,最终确定米曲霉40214产中性蛋白酶的最佳条件为:葡萄糖8.0%,酵母粉4.0%,Na2HPO40.10%,初始pH 6.5,发酵周期96 h,发酵温度28℃,加水量为60.0%,酶活达到2 845.68U/mL,提高了1.75倍。
米曲霉产蛋白酶的活力除了对培养条件进行优化,还能够通过其他方式进行提高。首先,实验中选择无机盐Na2HPO4,对米曲霉40214产中性蛋白酶具有促进作用,但对其添加量并没有进行单因素实验,所以最终选择的0.10%是相对最佳值,还可进一步提高;其次,一些表面活性剂也可能会促进产酶;第三,米曲霉菌株对紫外线敏感,可利用紫外诱变进行菌种选育,能够进一步提高其酶的产量[23-24]。米曲霉能够分泌多种酶,如淀粉酶、蛋白酶、脂肪酶、纤维素酶等[25],产生酶系与数量密切相关,因此实验菌株要应用于工业生产,应对其产生的多种酶进行系统的检测,明确相互之间的影响,并对生产成本与产品品质进行辨证考虑,才能最终确定最佳的工业发酵条件。
:
[1]Marcus,Schallmey,Ajay Singh,etal.Developments in the use of Bacillus species for industrial production[J].Can.J.Microbiol,2004(50):1-17.
[2]DEMAIN AL,ADRIO JL.Contributions ofmicroorganisms to industrial biology[J].Mol Bioteehnol,2008,38(1):41-55.
[3]牛春华,高岩,李玉秋,等.紫外诱变选育高产蛋白酶枯草芽孢杆菌[J].中国酿造,2011(12):67-69.
[4]王和玉,杨帆,林琳,等.地衣芽孢杆菌固态发酵代谢产物分析[J].酿酒科技,2011(9):32-34.
[5]杨帆,林琳,王和玉,等.茅台大曲中3株芽孢杆菌代谢产物的比对分析[J].酿酒科技,2011(8):42-43.
[6]豆康宁,董彬,王银满.大豆蛋白活性肽的生物功能与应用前景[J].粮食加工,2007,32(2):52-54.
[7]武波波,李文献,王少武,等.微胶囊化中性蛋白酶的技术研究[J].中国乳品工业,2009,37(8):27-30.
[8]肖怀秋,林亲录,李玉珍,等.中性蛋白酶芽孢杆菌BX-4产酶条件及部分酶学性质[J].食品与生物技术学报,2005,24(4):42-46,56.
[9]李明阳.复合菌种发酵海鲜鱼露工艺条件探讨究[D].陕西:西北大学,2012.
[10]孙晓鸣,王萍,邬向东.产中性蛋白酶芽孢杆菌配伍发酵响应面法研究[J].中国食品学报,2010,10(2):117-124.
[11]黄璠,蔡俊.枯草芽孢杆菌产中性蛋白酶的发酵条件优化[J].饲料工业,2012,33(2):49-51.
[12]Tremacoldi C.R.,Watanabe N.K.,Carmona E.C.Produc⁃tion of extracellular acid proteases by Aspergillus Clava⁃tus[J].World Journal of Microbiology and Biotechnology,2004,20(6):639-642.
[13]Kumar S.,Sharma N.S.,Saharan M.R.,etal.Extracellular acid protease from Rhizopus oryzae:purification and char⁃acterization[J].Process Biochemistry,2005,40(5):1701-1705.
[14]Fernandez-Lahore H.M.,Auday R.M.,Fraile E.R.,et al.Purification and characterization of an acid proteinase from mesophilic Mucor sp.solid-state cultures[J].The JournalofPeptide Research,1999,53(6):599-605.
[15]王福源.现代食品发酵技术第二版[M].北京:中国轻工业出版社,1998:443-500.
[16]林祖申.UE336-2米曲霉应用于酱油生产的研究[J].中国酿造,2003,4(127):24-26.
[17]邓静,吴华昌,吴明霞,等.米曲霉产蛋白酶条件的优化[J].中国酿造,2008,12:51-53.
[18]陈洁梅.Aspergillusoryzae的紫外诱变及蛋白酶活性的比较[D].广西:广西农业大学,1998.
[19]李慧.猪粪中产淀粉酶、蛋白酶菌株的筛选、鉴定及发酵条件的优化[D].武汉:华中农业大学,2011.
[20]朱旭芬.现代微生物实验技术[M].杭州:浙江大学出版社,2011:272.
[21]中华人民共和国国家技术监管局.GB/T23527-2009ICS67.22022X69-2009,蛋白酶制剂[S].北京:标准出版社,2009.
[22]PrescotM L,Harley P J,Klein A D.Micro-biology[M].New York:McGraw-HillCompanies,Inc.2002:96-121.
[23]张敏,赵丛,路福平,等.产中性蛋白酶菌株发酵条件的研究[J].食品研发与开发,2007,28(12):44-48
[24]张慧涛,侯新强.高温中性蛋白酶发酵过程中温度控制的改进[J].食品与发酵工业,2002,28:80-82.
[25]施巧琴,吴松刚.工业微生物育种学第三版[M].北京:科学出版社,2009:1-3.
Optimum Fermentation Conditions for Producing Neutral Protease fromAspergillus oryzae40214
Zhang Binbin,Yang Chunhua,Dou Boxin,Liu Linlin,Zou Lihong,ShiYanguo,Liu Ying
(Collegeof Food Engineering,Harbin University ofCommerce,Harbin 150076,China)
Using modern biological technology,medium compositions and fermentation conditions for producingmore neutral protease through the cultivation of Aspergillus oryzaewere optimized.With single factor trial and orthogonal experiment,the optimalmedium compositions determined were:8.0%glucose,4.0%yeast extract and 0.10%Na2HPO4.The optimal fermentation conditions obtained were:culture temperatureof28℃,the initialpH of6.5 and cultivation timeof96 h,60.0%addition ofwater.Theactivity of neutral protease was enhanced to 2 845.68 U/mL.The results provide a theoretical foundation for improvingneutralproteaseproduction and application in food fermentation ofAspergillusoryzae40214.
Aspergillusoryzae;Neutralprotease activity;Fermentation condition
TS201.3
B
1674-3547(2014)01-0031-07
2013-12-19
张彬彬,女,硕士,研究方向为大豆化学与技术,E-mail:bbhgds@163.com
十二五国家科技支撑计划项目(2012BAD34B03)
刘颖,女,教授,研究方向为食品生物技术,E-mail:154057693@qq.com

