阻塞性睡眠呼吸暂停低通气综合征与动脉硬化的相关性
陈 莹,王镇山,薛 欣
(大连医科大学附属第二医院呼吸内科,辽宁大连 116027)
阻塞性睡眠呼吸暂停低通气综合征与动脉硬化的相关性
陈 莹,王镇山,薛 欣
(大连医科大学附属第二医院呼吸内科,辽宁大连 116027)
目的 探讨阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea and hypopnea syndrome,OSAHS)和动脉硬化的关系及纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)在其中的可能机制。方法 根据多导睡眠图(polysomnography,PSG)监测结果分对照组(7例)及OSAHS组(29例),分别检测脉搏传导速度(pulse wave velocity,PWV)、踝臂指数(ankle-brachial index,ABI);酶联免疫吸附法测定血浆PAI-1水平。根据呼吸暂停指数(apnea and hypopnea index,AHI)分对照组(AHI<5次/h)(7例)、轻度OSAHS组(5次/h≤AHI<15次/h)(12例)、中-重度OSAHS组(AHI≥15次/h)(17例),对比3组间动脉硬化阳性率。结果 OSAHS组AHI、PWV、PAI-1均显著高于对照组(均P<0.05);对照组、轻度OSAHS组及中-重度OSAHS组动脉硬化阳性率分别为28.6%、58.3%、82.4%,差异有显著性意义(P=0.048,P<0.05)。(3)双侧 ABI与 AHI(左r=-0.534,P=0.003,右r=-0.456,P=0.013)均呈负相关。结论 OSAHS增加动脉硬化发生率和动脉硬化的程度,血浆PAI-1在OSAHS患者动脉硬化形成上可能有一定作用。
阻塞性睡眠呼吸暂停低通气综合征;动脉硬化;纤溶酶原激活物抑制剂-1
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea and hypophea syndrome,OSAHS)的特征是患者睡眠期间上呼吸道反复出现部分或全部阻塞,从而影响睡眠结构,导致睡眠片段化和白天困倦。纵向队列研究显示,OSAHS增加患者冠心病、心衰[1]的患病风险,也增加了心血管事件死亡率和全因死亡率[2]。目前认为OSAHS是引起冠心病、脑卒中等动脉硬化性疾病的独立危险因素[3],然而OSAHS增加心血管疾病患病率和全因死亡率的确切机制尚不清楚。有关OSAHS和动脉硬化关系的研究多集中在OSAHS和动脉粥样硬化方面,检测方法多采用超声检测颈动脉斑块和内膜厚度[4]。脉搏传导速度(pules wave velocity,PWV)是目前公认的检测动脉硬化的金指标,有研究表明,颈-股脉搏传导速度(carotid-femoral PWV,cfPWV)是致命性和非致命性心血管事件强有力的预测指标[5]。
组织型纤溶酶原激活物(tissue plasminogen activator,t-PA)/纤溶酶原激活物抑制剂-1是调节机体纤溶系统的主要指标,其表达水平直接影响机体纤溶活性。有研究证实血液PAI-1水平过高与内皮功能异常及心血管事件有关,血液中PAI-1的水平升高是冠状动脉微血管内皮功能异常的独立预测指标,且纤溶酶原的激活介导了动脉粥样硬化斑块中血管平滑肌细胞的凋亡[6-8]。也有研究证实OSAHS患者血浆中PAI-1水平较对照组升高[9],但是PAI-1在OSAHS所致的动脉硬化中的作用机制有待进一步研究。
本研究前瞻性临床观察对照组和OSAHS组PWV、踝臂指数(ankle-brachial indes,ABI)以及PAI-1水平是否存在差异,探讨OSAHS和动脉硬化的关系以及PAI-1在其中的可能机制。
1 资料与方法
1.1 试验对象及入选标准
对照组:选择2012年12月—2013年3月在大连医科大学附属第二医院体检,年龄、性别、体重指数(body mass index,BMI)、空腹血糖、血压、生活方式与OSAHS组匹配,经PSG监测呼吸暂停指数(apnea and hypophea irdwx,AHI)<5次/h的受试者7例纳入对照组。
OSAHS组:选择同期在本院体检,有睡眠时打鼾、呼吸暂停、白天嗜睡等临床症状,经PSG监测AHI≥5次/h的受试者29例纳入OSAHS组。
对照组与OSAHS组的性别、年龄、身高、体重、BMI等基线资料差异无显著性意义(均P>0.05),如表1所示。
表1 两组间受试者基线资料比较Tab 1 Comparison of general information between the two groups (±s)
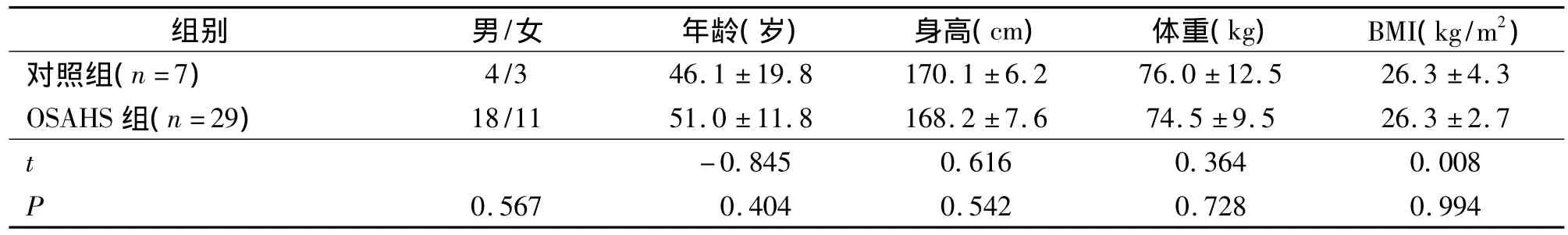
表1 两组间受试者基线资料比较Tab 1 Comparison of general information between the two groups (±s)
组别 男/女 年龄(岁) 身高(cm) 体重(kg) BMI(kg/m2)对照组(n=7)4/3 46.1 ±19.8 170.1 ±6.2 76.0 ±12.5 26.3 ±4.3 OSAHS 组(n=29) 18/11 51.0 ±11.8 168.2 ±7.6 74.5 ±9.5 26.3 ±2.7 t-0.845 0.616 0.364 0.008 P 0.567 0.404 0.542 0.728 0.994
详细询问所有受试者病史,均无心肌梗死、心力衰竭、脑卒中、肾功能衰竭等疾病,评估受试者,确定其符合纳入标准。向受试者及家属解释试验目的及流程,详细说明需要受试者配合之处和可能使用的受试者信息,取得其知情同意。
两组间高血压、糖尿病、吸烟、饮酒、运动情况等伴随情况分析显示比较差异均无显著性意义(P>0.05),如表2所示。
1.2 多导睡眠图监测
全部受试者均采用飞利浦公司生产的Alice5型多导睡眠图记录仪监测,记录时间在7 h以上,监测当天受试者禁酒精、咖啡及服用镇静剂、催眠药。监测项目包括脑电图(C3/A2,C4/A1,O1/A2,O2/A1)、眼电图、下颌肌电图、下肢肌电图、体位、鼻气流(热敏及压力感受器)、鼾声、胸腹运动幅度、血氧饱和度(saturation of pulse oxygen,SpO2)等,次日根据中华医学会呼吸病学分会睡眠呼吸障碍学组制定的阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)进行报告判读[10]。

表2 两组间伴随情况的比较Tab 2 Comparison of clinical history between the two groups
1.3 物理检查
受试者免冠脱鞋,测量身高、体重,计算BMI=体重/身高2(kg/m2),休息15 min以上行外周血管无创检查。
1.4 外周血管无创检查
应用欧姆龙公司生产的外周血管检测仪。所有受试者均在检测前禁食物、咖啡、酒精12 h,排空膀胱,休息15 min以上,检查房间温度适宜,所有检查集中在上午8:00~11:00进行。通过测量四肢血压、心电图、心音图及脉搏图计算出PWV及ABI。
1.5 标本采集和测定
受试者在体检中心进行体检当日清晨(隔夜禁食12 h),抽取静脉血,立即4℃,1 000 r/min离心,取上清置于-80℃冰箱保存待测。标本符合:(1)无溶血;(2)清澈透明;(3)解冻1次;(4)保存时间不超过6个月。
采用ELISA法测定受试者血浆中PAI-1水平。检测PAI-1试剂盒购于武汉华美生物工程有限公司,用全自动酶标分析仪测定样品的吸光度(A)值,计算受试者血浆中PAI-1的含量。
1.6 AHI等级与动脉硬化情况分析
根据AHI水平不同将受试者分为对照组(n=7,AHI<5 次/h),轻度 OSAHS组(n=12,5 次/h≤AHI<15 次/h),中 -重度 OSAHS组(n=17,AHI≥15次/h)。
1.7 数据收集
以病例报告表(case report form,CRF)的形式收集数据,并经统一表格汇总。包括人口统计学信息、标本搜集日期、持续时间、生命体征、睡眠呼吸暂停低通气症状、体征及与睡眠呼吸暂停低通气综合征相关的代谢指标,PSG监测结果,外周血管无创检查结果,PAI-1检测结果。
1.8 统计学方法
使用SPSS20.0统计软件分析数据,各组数据中,计量资料均表示为均数±标准差(±s);组间两两均数差异比较用t检验。率的比较采用Fisher确切概率计算。相关性用pearson及spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 对照组与OSAHS组PSG监测指标(AHI、nadir SpO2、mean SpO2)比较
对照组和OSAHS组平均AHI分别为(1.81±1.54)次/h 和(26.32 ±19.93)次/h,差异有显著性意义(P<0.05);而 nadir SpO2均值分别为(85±6)%和(75±14)%,mean SpO2均值分别为(95±1)%和(92±13)%,差异均无显著性意义(均P>0.05),见表3。
2.2 对照组与 OSAHS组动脉硬化检测指标(PWV、ABI)比较
OSAHS组左侧PWV及右侧PWV均高于对照组,差异有显著性意义(P<0.05);而左侧ABI及右侧ABI与对照组比较,差异无显著性意义(P>0.05)。见表 3。与对照组相比,OSAHS组左侧PWV[(1166.14 ± 112.50)cm/s与(1495.41 ±209.58)cm/s,t=-3.990,P=0.001,P < 0.05]和右侧 PWV[(1148.14 ±99.06)cm/s与(1469.14 ±210.32)cm/s,t=-3.902,P=0.001,P < 0.05]水平均分别高于对照组,差异均有显著性意义;而左侧ABI和右侧ABI两组间差异均无显著性意义(均P>0.05),见表3。
2.3 对照组与OSAHS组血浆PAI-1水平的比较
OSAHS组受试者血浆中 PAI-1(3.73±1.40)ng/mL明显高于对照组(1.18 ±0.94)ng/mL,差异有显著性意义 (t=-4.532,P=0.000,P <0.05),见表3。
表3 两组间AHI、SpO2、PWV、ABI及血中PAI-1的均值比较Tab 3 Comparison of AHI,SpO2,PWV,ABI and serum PAI-1 between the two groups (±s)
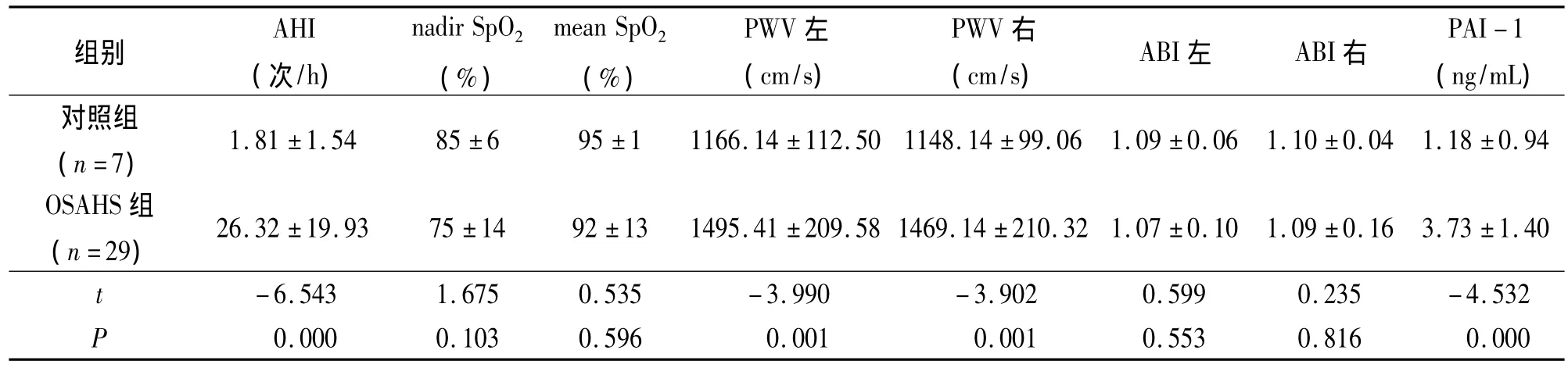
表3 两组间AHI、SpO2、PWV、ABI及血中PAI-1的均值比较Tab 3 Comparison of AHI,SpO2,PWV,ABI and serum PAI-1 between the two groups (±s)
组别AHI(次/h)nadir SpO2(%)mean SpO2(%)PWV左(cm/s)PWV右(cm/s) ABI左 ABI右PAI-1(ng/mL)对照组(n=7)1.81 ±1.54 85 ±6 95 ±1 1166.14 ±112.50 1148.14 ±99.06 1.09 ±0.06 1.10 ±0.04 1.18 ±0.94 OSAHS组(n=29) 26.32 ±19.93 75 ±14 92 ±13 1495.41 ±209.58 1469.14 ±210.32 1.07 ±0.10 1.09 ±0.16 3.73 ±1.40 t-6.543 1.675 0.535 -3.990 -3.902 0.599 0.235 -4.532 P 0.000 0.103 0.596 0.001 0.001 0.553 0.816 0.000
2.4 AHI等级与动脉硬化情况分析
经Fisher确切概率检验,对照组、轻度OSAHS组、中-重度OSAHS组动脉硬化的阳性率分别为28.6%、58.3%、82.4%,3 组间动脉硬化阳性率的差异有显著性意义(P<0.05),见表4。
2.5 PSG监测指标与动脉硬化检测指标(PWV、ABI)的相关性分析
双侧 PWV 与 AHI、nadir SpO2、mean SpO2均无相关性(均 P>0.05);双侧 ABI均与 AHI呈负相关,与nadir SpO2、mean SpO2均无相关性(均 P>0.05),见表5。
2.6 血浆 PAI-1水平与动脉硬化检测指标(PWV、ABI)相关性分析
血浆PAI-1与左侧PWV、ABI以及右侧PWV、ABI均无相关性(均P>0.05),结果如表6所示。
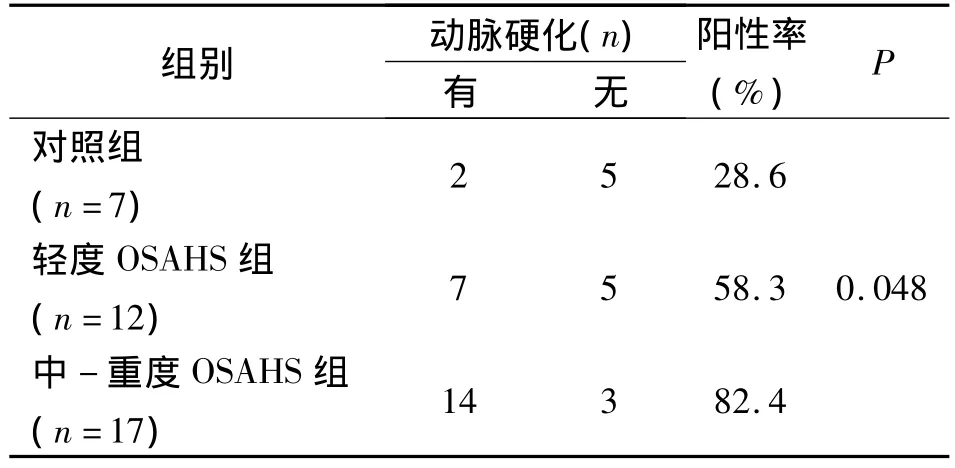
表4 AHI等级与动脉硬化情况分析Tab 4 Analysis of correlation between AHI grade and arterialstiffness
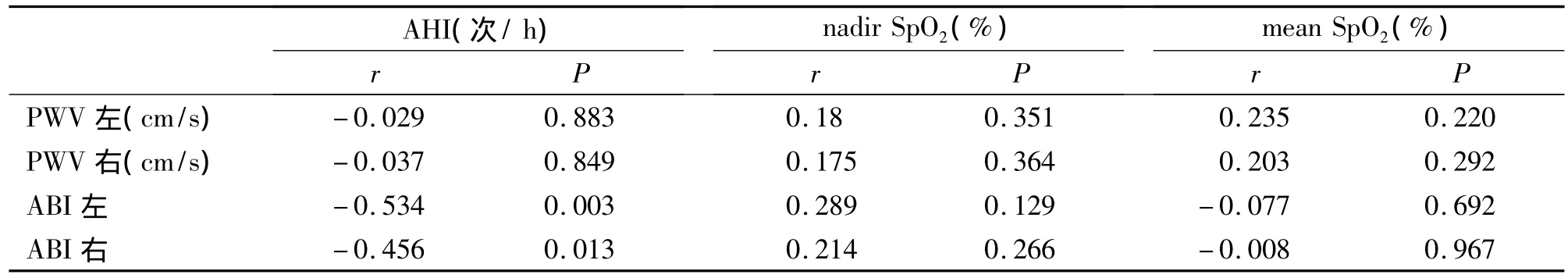
表 5 OSAHS 组 PWV、ABI与 AHI、SpO2相关性分析Tab 5 Analysis of correlation between PWV,ABI and AHI,SpO2in OSAHS group

表6 PWV、ABI与血浆PAI-1水平相关性分析Tab 6 Analysis of correlation between serum PAI-1 level and PWV,ABI
3 讨论
OSAHS是常见的睡眠呼吸障碍性疾病,与心血管疾病的患病率和死亡率密切相关。同时,动脉硬化作为心血管疾病患病率和死亡率早期预测指标也越来越受到关注。研究证实OSAHS的严重程度与动脉硬化的程度独立相关[11]。
PWV是目前公认的检测动脉硬化的金标准。本研究显示,中-重度OSAHS组的动脉硬化率较轻度OSAHS组及对照组增高,差异有显著性意义,提示OSAHS可增加动脉硬化患病率,且OSAHS患者的病情程度越严重,其动脉硬化的发生率就越高,此结果与Drager等[11-12]研究的结论一致。
同时,本研究显示OSAHS组的PWV较对照组增高,提示OSAHS患者动脉硬化程度高。Chung等[13]观察112例受试者的脉搏传导速度,根据PSG结果分为轻 -中度 OSAHS组(5次/h≤AHI<30次/h)39例,重度OSAHS组 (AHI≥30次/h)44例,对照组29例(AHI<5次/h),结果显示重度OSAHS组cfPWV明显高于轻-中度OSAHS组和对照组。Kasai等[14]研究也提示中-重度OSAHS组的血浆穿透素-3水平和颈踝血管指数(cardio-ankle vascular index,CAVI)均较轻度OSAHS组和健康对照组降低,说明中-重度的OSAHS患者动脉硬化程度较正常人高,且动脉硬化程度与AHI相关,本研究结果与上述研究结果一致。
Drager等[15]研究发现,与健康对照组相比,OSAHS组AHI、nadir SpO2和PWV差异有显著性意义(均P<0.001);多元回归分析提示夜间nadir SpO2水平与PWV独立相关,说明OSAHS患者夜间低氧血症是动脉硬化的独立危险因素。
本研究发现双侧ABI均与AHI呈负相关,提示OSAHS患者中,ABI随着OSAHS的严重程度加重而降低。ABI作为诊断和评估外周血管疾病的常用指标,与AHI呈负相关,提示OSAHS越严重,外周血管疾病发生的风险越高。
本文结果显示,OSAHS受试者血浆PAI-1水平较对照组高,提示血浆纤溶酶原激活物抑制剂-1在OSAHS患者动脉硬化形成上可能有一定作用。有学者对OSAHS患者血浆PAI-1水平进行研究,发现OSAHS患者血浆 PAI-1水平升高,并且与AHI呈正相关[16]。也有学者在间歇缺氧小鼠模型研究中证实低氧血症可以引起PAI-1水平的增高[17]。低氧血症可以破坏机体内抗凝/促凝的平衡,可引起PAI-1水平增高,并引起血中促凝物质及血小板的活化,进而引起凝血[18-19]。血凝块的溶解需要纤溶酶原的激活,而PAI-1是组织型纤溶酶原激活物的主要拮抗物质,如果血中PAI-1水平升高,被激活的纤溶酶原受到抑制,不能溶解血中的纤维蛋白,导致纤维蛋白大量堆积,最终就会形成动脉粥样斑块甚至血栓[20-21],发生动脉硬化。
除上述机制外,另有研究显示,血浆中PAI-1水平的升高和高血压有关[22]。同时,血浆中PAI-1升高可能有促进觉醒作用,导致睡眠结构紊乱,可引起交感神经功能紊乱[23]。Schaefer等[24]和 Hunsley等[25]证实心肌组织中PAI-1/t-PA水平会影响交感神经活性,而交感神经活性的改变又可以影响睡眠结构。因此OSAHS患者血浆中PAI-1水平升高可能与动脉硬化及其进展有关。
综上,OSAHS增加动脉硬化的发生率和动脉硬化的程度,血浆纤溶酶原激活物抑制剂-1在OSAHS患者动脉硬化形成上可能有一定作用。
:
[1]Gottlieb DJ,Yenokyan G,Newman AB,et al.Prospective study of obstructive sleep apnea and incident coronary heart disease and heart failure[J].Circulation,2010,122(4):352-360.
[2]Marshall NS,Wong KK,Liu PY,et al.Sleep apnea as an independent risk factor for all-cause mortality:the Busselton Health Study[J].Sleep,2008,31(8):1079.
[3]McNicholas W,Bonsignore M.Sleep apnoea as an independent risk factor for cardiovascular disease:current evidence,basic mechanisms and research priorities[J].Eur Respir J,2007,29(1):156-178.
[4]朱宏霞,王镇山,薛欣.阻塞型睡眠呼吸暂停低通气综合征与颈动脉硬化,胰岛素抵抗的相关性研究[J].大连医科大学学报,2012,34(3):248-251.
[5]Laurent S,Cockcroft J,Van Bortel L,et al.Expert consensus document on arterial stiffness:methodological issues and clinical applications[J].Eur Heart J,2006,27(21):2588-2605.
[6]Cines DB,Pollak ES,Buck CA,et al.Endothelial cells in physiology and in the pathophysiology of vascular disorders[J].Blood,1998,91(10):3527-3561.
[7]Rossignol P,Luttun A,Martin-Ventura JL,et al.Plasminogen activation:a mediator of vascular smooth muscle cell apoptosis in atherosclerotic plaques[J].J Thromb Haemost,2006,4(3):664-670.
[8]Naya M,Tsukamoto T,Inubushi M,et al.Elevated plasma plasminogen activator inhibitor type-1 is an independent predictor of coronary microvascular dysfunction in hypertension[J].Circulat J,2007,71(3):348-353.
[9]Mehra R,Xu F,Babineau DC,et al.Sleep-disordered Breathing and Prothrombotic Biomarkers Cross-Sectional Results of the Cleveland Family Study[J].Am J Respir Crit Care Med,2010,182(6):826-833.
[10]中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治2011版[J].中华结核和呼吸杂志,2012,35(1):9-12.
[11]Drager LF,Bortolotto LA,Maki-Nunes C,et al.The incremental role of obstructive sleep apnoea on markers of atherosclerosis in patients with metabolic syndrome[J].Atherosclerosis,2010,208(2):490-495.
[12]Drager LF,Bortolotto LA,Figueiredo AC,et al.Effects of continuous positive airway pressure on early signs of atherosclerosis in obstructive sleep apnea[J].Am J Respir Crit Care Med,2007,176(7):706-712.
[13]Chung S,Yoon I-Y,Lee CH,et al.The association of nocturnal hypoxemia with arterial stiffness and endothelial dysfunction in male patients with obstructive sleep apnea syndrome[J].Respiration,2010,79(5):363-369.
[14]Kasai T,Inoue K,Kumagai T,et al.Plasma pentraxin3 and arterial stiffness in men with obstructive sleep apnea[J].Am J Hypertens,2010,24(4):401-407.
[15]Drager LF,Diegues-Silva L,Diniz PM,et al.Obstructive sleep apnea,masked hypertension,and arterial stiffness in men[J].Am J Hypertens,2009,23(3):249-254.
[16]von Känel R,Loredo JS,Ancoli-Israel S,et al.Association between sleep apnea severity and blood coagulability:treatment effects of nasal continuous positive airway pressure[J].Sleep Breath,2006,10(3):139-146.
[17]Pinsky DJ,Liao H,Lawson CA,et al.Coordinated induction of plasminogen activator inhibitor-1(PAI-1)and inhibition of plasminogen activator gene expression by hypoxia promotes pulmonary vascular fibrin deposition[J].J Clin Invest,1998,102(5):919.
[18]Wessendorf TE,Thilmann AF,Wang Y-M,et al.Fibrinogen levels and obstructive sleep apnea in ischemic stroke[J].Am J Respir Crit Care Med,2000,162(6):2039-2042.
[19]Hui DS,Ko FW,Fok JP,et al.The effects of nasal continuous positive airway pressure on platelet activation in obstructive sleep apnea syndrome[J].Chest,2004,125(5):1768-1775.
[20]Vaughan D.PAI-1 and atherothrombosis[J].Journal of Thrombosis and Haemostasis,2005,3(8):1879-1883.
[21]Epstein FH,Kohler HPGrant PJ.Plasminogen-activator inhibitor type 1 and coronary artery disease[J].N Engl J Med,2000,342(24):1792-1801.
[22]Tabak O,Gelisgen R,Uzun H,et al.Hypertension and hemostatic/fibrinolytic balance disorders[J].Clin Invest Med,2009,32(6):E285-E292.
[23]Sakakibara H,Romanowski CP,Jakubcakova V,et al.Feeble awake effects of plasminogen activator inhibitor type-1 in mice[J].Behav Brain Res,2011,220(2):354-357.
[24]Schaefer U,Machida T,Vorlova S,et al.The plasminogen activator system modulates sympathetic nerve function[J].J Exper Med,2006,203(9):2191-2200.
[25]Hunsley M,Curtis WPalmiter R.Behavioral and sleep/wake characteristics of mice lacking norepinephrine and hypocretin[J].Genes Brain Behav,2006,5(6):451-457.
Correlation between obstructive sleep apnea and hypopnea syndrome and arterial stiffness
CHEN Ying,WANG Zhen-shan,XUE Xin
(Department of Respiratory,the Second Affiliated Hospital of Dalian Medical University,Dalian116027,China)
[Abstract]ObjectiveTo analyze the correlation between obstructive sleep apnea and hypopnea syndrome(OSAHS)and arterial stiffness,and explore the possible regulatory role of plasma activator inhibitor-1(PAI-1).MethodsPolysomnography(PSG)monitoring were applied to assign cases into control group and OSAHS group.Pulse wave velocity(PWV),ankle-brachial index(ABI)and enzyme-linked immunosorbent assay of PAI-1 were also examined.Based on apnea and hypopnea index(AHI),the subjects were divided into 3 groups,control group(AHI<5),mild group(5≤AHI<15),and moderate-severe group(AHI≥15).Fisher exact test was performed to compare the rate of arterial stiffness among the 3 groups.Results(1)Compared with the control group,AHI,PWV,PAI-1 were significantly higher(P<0.05).(2)Fisher exact test showed that the arterial stiffness positive rates of the control group(n=7),mild OSAHS group(n=12)and moderate-severe OSAHS group(n=17)were 28.6%,58.3%,and 82.4%,respectively.Significant differences were achieved among these 3 groups(P=0.048,P<0.05).(3)Left and right ABI were negatively correlated with AHI(leftr=-0.534,P=0.003;rightr=-0.456,P=0.013).ConclusionOSAHS increases the incidence and the degree of arterial stiffness.Plasma PAI-1 may have some effect on arterial stiffness in patients with OSAHS.
[Key words]obstructive sleep apnea and hypopnea syndrome;arterial stiffness;plasminogen activator inhibitor-1
R56
A
1671-7295(2014)01-0068-05
陈莹,王镇山,薛欣.阻塞性睡眠呼吸暂停低通气综合征与动脉硬化的相关性[J].大连医科大学学报,2014,36(1):68-72.
10.11724/jdmu.2014.01.17
陈 莹(1987-),女,辽宁丹东人,硕士。E-mail:yoursjane1934@126.com
王镇山,教授,博士。E-mail:WZSDL@yahoo.com
2013-07-30;
2013-12-02)

