新型复合共沉淀法制备高能量/高功率型锂离子二次电池用5 V 正极材料LiNi0.5Mn1.5O4及其电化学性能
朱 智 其 鲁,* 李 卫 廖细英
(1北京大学化学与分子工程学院,北京100190;2北京科技大学材料科学与工程学院,北京100083;3思伊纳化学科技(北京)有限公司,北京100094)
1 引言
近年来锂离子二次电池由于其相对于其它电池具有较高的能量密度和功率密度,被认为是目前最有前景的电能储存设备,其研究和发展也越来越受到重视.通常而言,锂离子电池由正极、负极、电解质和隔膜组成.其中,正极材料很大程度上决定了电池的工作电压、电池能量密度等主要参数.
图1是常见的几种锂离子电池用正极材料的充放电曲线(均以Li金属为负极).从图中可以看出,LiFePO4的放电电压平台为3.55 V,LiCoO2和LiMn2O4的放电电压都在4.00 V左右.而LiNi0.5Mn1.5O4的放电电压则高达4.73 V,为目前研究的具有最高放电电压的锂离子二次电池用正极材料之一.较高的单体电池电压可以减少电池组所需单体电池的数量,从而简化电池系统管理,也减轻电池的重量和体积.以一组工作电压为400 V的动力电池组为例,同样以碳质材料为负极,如采用LiFePO4电池则需要约135块单体电池,采用LiMn2O4则需约110块单体电池,而若采用LiNi0.5Mn1.5O4则仅需90块单体电池就可实现.1另外,提高电池的电压可以提高电池的储能密度和输出功率.LiNi0.5Mn1.5O4正极材料具有620 Wh·kg-1以上的储能密度,在其3C放电倍率下,即可实现高达2000 W·kg-1的放电功率.
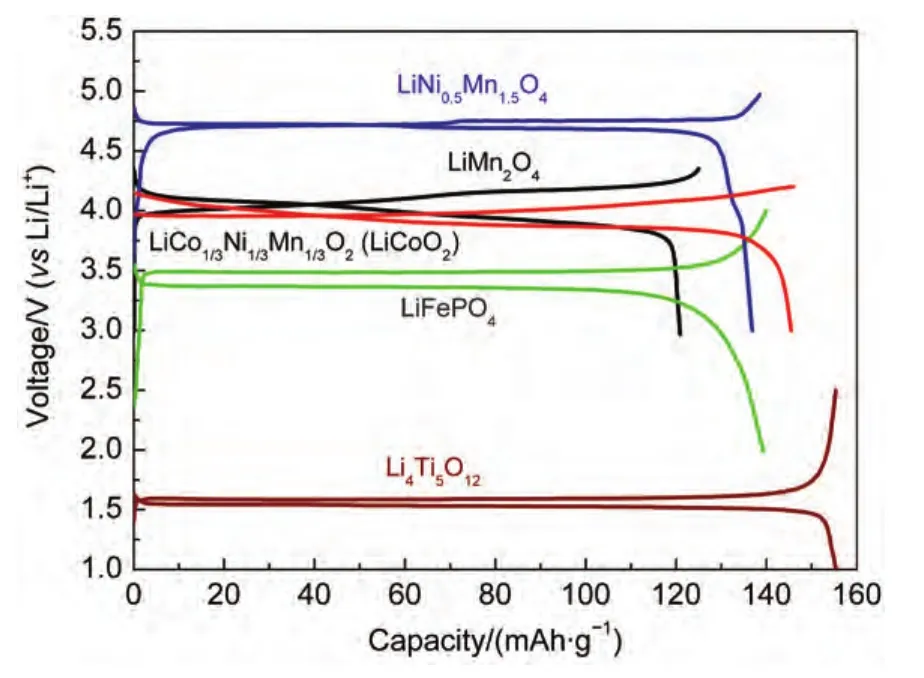
图1 常见锂离子电池用电极材料的充放电曲线Fig.1 Charging/discharging curves of common materials in Li-ion battery versa Li metal as anode
LiNi0.5Mn1.5O4是基于LiMn2O4发展起来的一种新型材料,具有和LiMn2O4相同的尖晶石结构.但由于其电化学活性是通过Ni2+/4+的氧化还原来实现的,因此其具有高达4.7 V的充放电电压平台.2-4另外由于Ni的掺入使LiNi0.5Mn1.5O4的结构更加稳定,因此LiNi0.5Mn1.5O4具有更加优越的循环性能.合成纯相LiNi0.5Mn1.5O4材料对于提高材料的电化学性能是至关重要的.常见的合成方法主要有固相法、5,6共沉淀法、7-14溶胶-凝胶法、熔融盐法等,其中前两者在工业制备中最为常见.固相法合成LiNi0.5Mn1.5O4材料工艺简单、环境污染小.然而固相法往往因为原材料难于充分混合而导致最终合成的材料中含有杂相,15,16形貌不易控制.同时材料的可用容量一般在120 mAh·g-1以下,6循环性能也相对较差,且在4 V低电压区存在较大的容量损失.17
本文将介绍一种制备高性能LiNi0.5Mn1.5O4材料的新方法.该方法通过利用新复合型沉淀剂获得了离子分布均匀、形貌可控的球形共沉淀物,然后结合特殊的水热反应及高温反应,最终得到了球形次级颗粒结构的LiNi0.5Mn1.5O4材料.通过控制关键参数,还分别合成了具有较高能量密度和较高功率密度的两种高性能LiNi0.5Mn1.5O4材料.另外,该方法对于提高材料的振实密度也具有十分重要的指导意义.
2 实验部分
2.1 LiNi0.5Mn1.5O4的制备
传统固相法:按照化学计量比1.06:0.50:1.50称取LiOH·H2O(分析纯,广东西陇化工股份有限公司)、Ni(OH)2(分析纯,广东西陇化工股份有限公司)和MnO2(自制,电池级),在高能球磨机下充分混合2 h,其间加入适量乙醇作为分散剂以助研磨.将充分混合后的反应物置于马弗炉中,在600°C温度下反应5h后再次研磨1-2 h.最后放入马弗炉中在700-1000°C下反应12 h,随炉冷却后得最终产物TLNMO.
新型复合共沉淀水热法(以下简称新共沉淀法):按照化学计量比1:3称取NiSO4(分析纯,北京益利精细化学品有限公司)和MnSO4(分析纯,北京益利精细化学品有限公司)溶解于去离子水中,配制成Ni、Mn总离子浓度为1-3 mol·L-1的溶液.分别配制浓度为0.2 mol·L-1的(NH4)2CO3(分析纯,北京益利精细化学品有限公司)和(NH4)2C2O4(分析纯,北京益利精细化学品有限公司)溶液.按照化学计量比计算所需(NH4)2CO3和(NH4)2C2O4溶液的总体积.共沉淀时,先均匀滴入4%体积的(NH4)2CO3溶液,搅拌10 min后再均匀滴入96%的(NH4)2C2O4溶液.共沉淀过程在60-70°C的水浴中完成,期间母液的pH和浓度、搅拌速率及水域温度均保持恒定,母液的pH通过H2SO4溶液和氨水调节在6-8范围内.待沉淀完成后,将溶液过滤得到共沉淀物,并将洗涤后的沉淀物浸在化学计量比的饱和氢氧化锂溶液中于120°C水热反应5 h.随后将混合溶液在真空条件下蒸干,并于120°C干燥得到预反应物粉末.最终将预反应物粉末分别在500和800°C下反应6-8 h.反应结束后按照三种方法冷却:(1)缓慢降温(0.5-0.8°C·min-1)至650°C,而后随炉冷却得到最终产物N0-LNMO;(2)快速冷却(25-30 °C·min-1)至室温得产物N1-LNMO;(3)将N1-LNMO再次升温至670°C,并保温40 h后随炉冷却得产物N2-LNMO.
2.2 材料分析
材料的表面形貌用扫描电镜(SEM)(JEOL,JSM-5600LV,Japan)表征,使用的加速电压为20 kV.材料的相组成用X射线衍射(XRD)仪(Rigaku Muti-Flex Diffractometer,D/max-2500,Japan)检测,使用Cu靶,加速电压20 kV,电流4mA,扫描范围为10°-90°.另外,用热重分析(TGA)仪(Setaram Labsys,France)研究材料在升温过程中的变化,升温速率为10(°)·min-1.
2.3 电化学性能分析
采用R2032型扣式电池进行电化学测试.其中,电池的正极由86%(w,下同)的活性物质、8%的导电剂(导电石墨+乙炔黑)和6%的PVDF粘结剂组成.电解液的组成为1 mol·L-1LiPF6溶解于体积比为1:1:1的碳酸乙烯酯(EC),碳酸二甲酯(DMC)和碳酸甲基乙基酯(EMC)剂中.负极为Li金属片.采用LAND CT2001A型自动充放电装置(武汉金诺电子)对电池进行充放电性能测试,充放电电压范围为3.0-5.0 V.
3 结果与讨论
3.1 热重分析
首先分别对两种合成过程进行了热重研究.通过反应物在升温过程中(25-1000°C)的重量和热量变化,分析反应物的组成以及推测在合成LiNi0.5Mn1.5O4过程中可能发生的反应.
图2a为传统固相法制备T-LNMO时对LiOH、Ni(OH)2和MnO2混合反应物升温时的TGA曲线.在整个升温过程中,可能发生的反应如表1所列.18从图2a可以看出,反应混合物在80°-120°时失水,包括混合物中吸附的水分和LiOH·H2O中的结晶水.而在270°C以后,Ni(OH)2、LiOH相继分解并与MnO2发生反应.在270-690°C温度区间内,热重变化呈现较均匀的连续变化,无明显平台出现.可推测在该温度区间内,反应物的分解和相互作用是连续发生的,各反应之间可能存在较大的温度重叠,而并不是按照表1中所列顺序那样逐一反应.因此,传统固相法合成LiNi0.5Mn1.5O4时,很难确保各反应按照理论上的化学计量比完全进行,即会生成大量中间产物或其它杂质.这些杂质会在很大程度上阻碍反应物的扩散,从而阻碍有效合成反应在短时间内完成.从图2a的实验结果计算所得反应过程的总失重为18.1%,明显高于理论值16.7%.因此副反应的发生可能会导致T-LNMO中含有大量杂质相(在下面的XRD表征中讨论).为了促进反应物的进一步扩散和相互反应,只能提高反应温度,因此通常固相法都在850°C以上合成LiNi0.5Mn1.5O4.当温度高于780°C时新的失重开始出现,即发生了新的副反应.所以,传统固相法很难在常规条件下在短时间内合成纯相LiNi0.5Mn1.5O4材料.
图2b为新共沉淀法制备N-LNMO的热重-差示扫描分析(TGA-DSC)曲线.为了便于定量分析,此处分析的预反应物是完全使用草酸铵沉淀剂时所得到的.总体而言,新共沉淀法的TGA曲线和新型草酸预处理固相法类似:18在240°C前预反应物失去结晶水,而主要的分解反应则发生在285-320°C之间很窄的温度范围内.从TG曲线来看,500°C以后几乎没有失重,但是DSC曲线上有明显的放热峰.这表明在500°C前Li-Ni-Mn的复合氧化物已经生成,而在500°C后则发生了二次相变.这时尖晶石结构LiNi0.5Mn1.5O4进一步生成,结晶度也进一步提高.
然而值得注意的是,图2b中的预反应物和新型草酸预处理固相法中的并不完全一样.18新型固相法中的预反应物是在酸性条件下得到的(且草酸的添加量往往过量),因此组成为Li、Ni、Mn的草酸复合盐Li2NiMn3·5C2O4.而在新共沉淀法中的前驱物是在与饱和LiOH溶液进行水热反应后得到的,因此前驱物中不仅为草酸盐,还含有大量氢氧根离子.19因此可以推断,合成N-LNMO的化学反应过程如下:
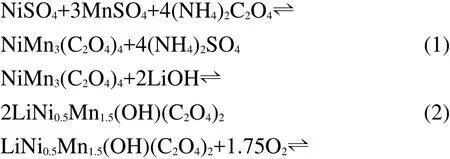
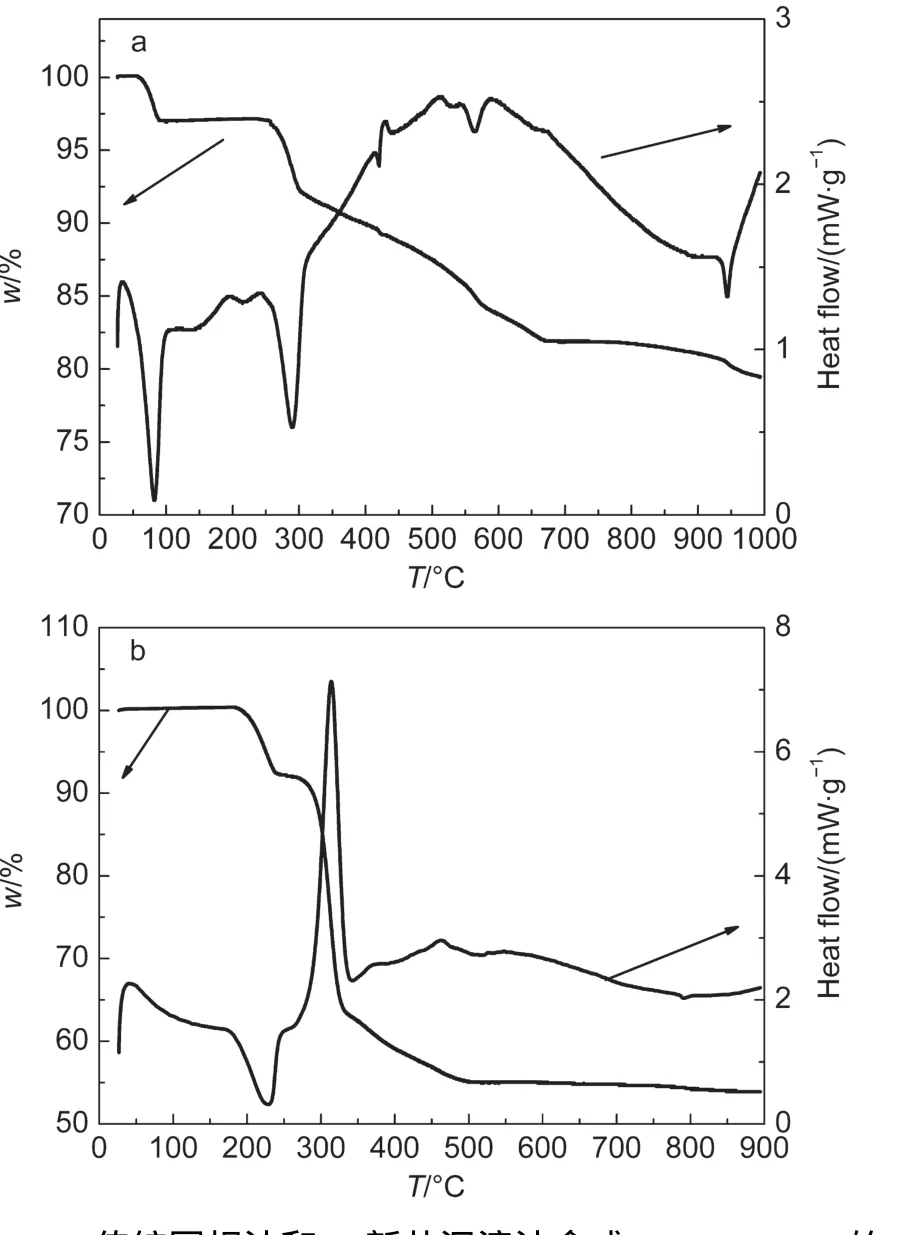
图2 (a)传统固相法和(b)新共沉淀法合成LiNi0.5Mn1.5O4的TG-DSC曲线Fig.2 Thermogravimetry-differential scanning calorimetry(TG-DSC)curves of preparing LiNi0.5Mn1.5O4 via(a)traditional solid state method and(b)novel co-precipitation method
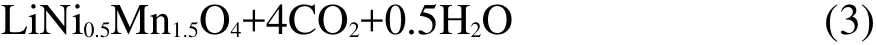
在图2b中,240°C以后的总失重为41.49%,而对应的方程式(3)的理论失重为41.40%.在考虑到实验误差的前提下,实验结果和理论预算值十分接近.新共沉法也是通过化学方法让Li、Ni、Mn元素在原子级别充分混合,从而促进单一相的尖晶石LiNi0.5Mn1.5O4材料在较低温度下和较短时间内合成.
3.2 材料的晶体结构和物相分析
本研究中用X射线粉末衍射来分析材料的化学结构.这不仅是对材料的重要表征,也是研究影响材料电化学性能的重要方法.图3a为传统固相法分别在750-1000°C温度下合成的LiNi0.5Mn1.5O4(TLNMO).从图中可以看出,虽然各温度下合成的TLNMO都具有尖晶石结构,但在(311)和(400)衍射峰附近都有明显的杂相峰.这些杂相峰随着合成温度的升高相对强度不断降低.然而当温度进一步升高到1000°C时,所有衍射峰均大幅度降低.这表明在900°C以上时,材料中发生了严重的副反应从而引入了大量杂质,且材料的结晶度降低.
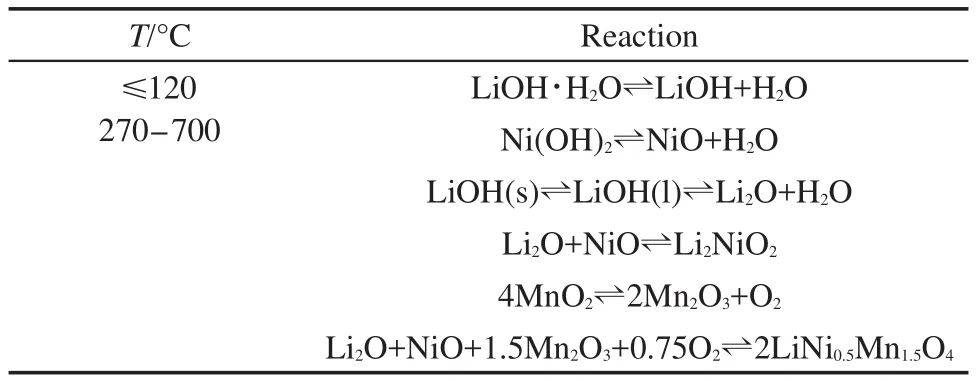
表1 传统固相法合成LiNi0.5Mn1.5O4时可能发生的化学反应18Table 1 Possible reactions during sintering the raw mixture in traditional solid-state method18
新共沉淀法制备的LiNi0.5Mn1.5O4(N0-LNMO)的XRD图谱如图3b所示.由图可知,新共沉淀法得到的预反应物具有明显的草酸盐晶体特征.在500°C即生成了明显的尖晶石结构,只是结晶度较低.而在800°C下进行再次高温反应后,得到的最终产物LiNi0.5Mn1.5O4具有单一尖晶石结构,且结晶度高,无杂相峰出现.
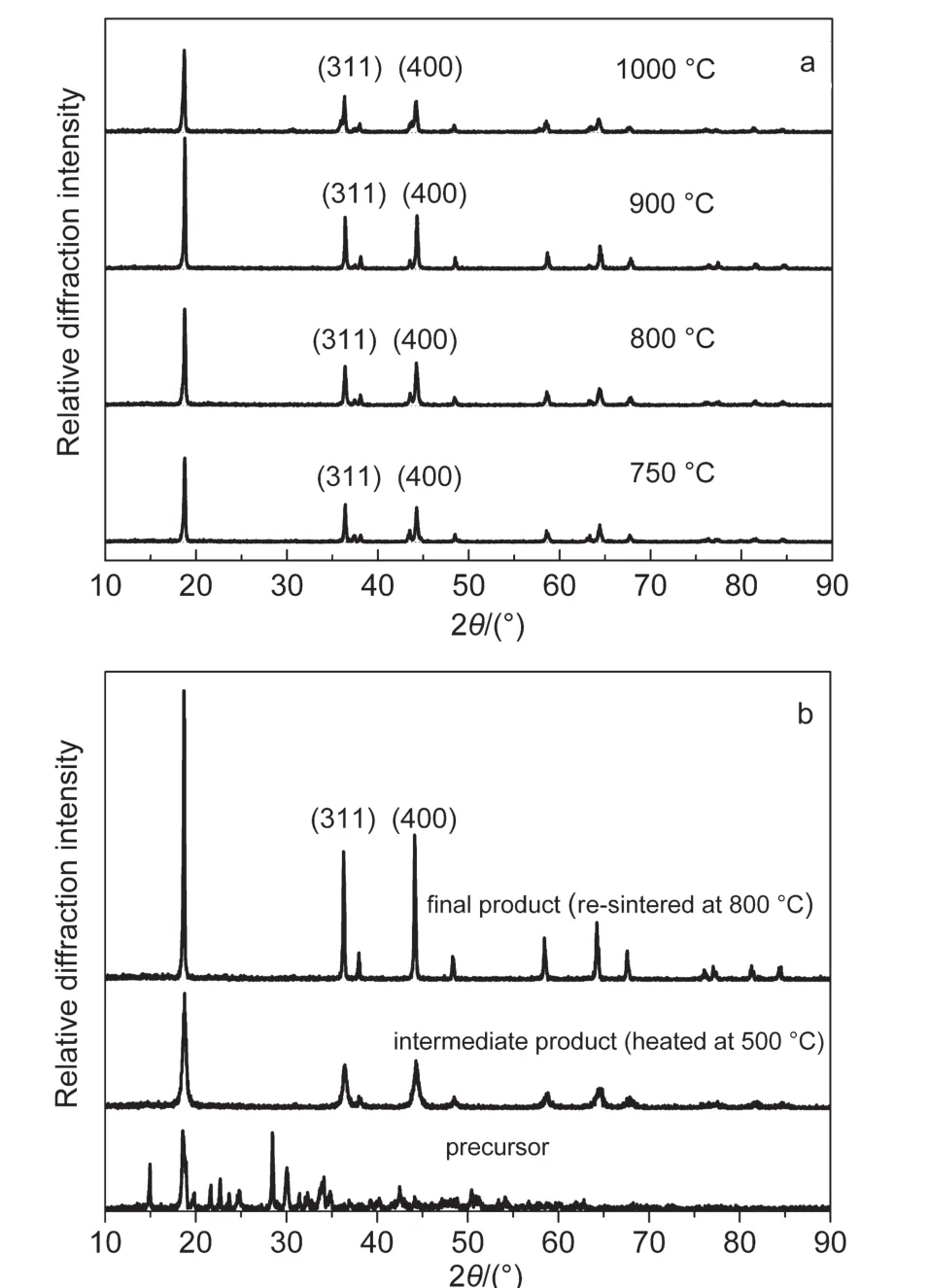
图3 (a)传统固相法(T-LNMO)和(b)新共沉淀法(N0-LNMO)合成LiNi0.5Mn1.5O4的XRD曲线Fig.3 X-ray diffraction(XRD)patterns of LiNi0.5Mn1.5O4 preparing via(a)traditional solid state method and(b)novel composite co-precipitation method
在尖晶石结构的XRD图谱(图3b)中,(311)和(400)峰强的比值常用来评定材料中阳离子的混排度(γ).在LiNi0.5Mn1.5O4中,γ表示材料中8a位置的Li离子和16d位置的Mn或Ni离子的混排程度.通常γ越大,两者峰强的比值I(311)/I(400)也越大,材料的电化学性能也会降低.从图3中可以看出,新共沉淀法制备的N0-LNMO(0.84)的I(311)/I(400)值明显低于传统固相法制备的T-LNMO(0.93).这是由于在材料制备过程中,新方法均对混合反应物进行了化学预处理,使元素得到了原子级别的充分混合,从而较容易生成元素排布规律的纯相尖晶石LiNi0.5Mn1.5O4.因此可以预测,N0-LNMO的电化学性能将优于传统固相法制备的T-LNMO.
3.3 材料颗粒表面形貌SEM分析
为了更好地阐述新共沉淀法制备LiNi0.5Mn1.5O4的过程,本研究中用SEM表征了新方法中预反应物、中间产物以及最终产物的颗粒表面形貌.
图4为新共沉淀法制备LiNi0.5Mn1.5O4过程中,从预反应物到最终产物的SEM照片.如图4a所示,通过控制共沉淀过程中的各项条件(如水浴温度、溶液的浓度和pH等),可以得到均匀的球形沉淀颗粒,粒径约为6 μm.实验发现,使用(NH4)2CO3沉淀剂更易于得到这种球形颗粒.20因此在滴加沉淀剂时,先使用少量的(NH4)2CO3沉淀剂.待母液出现明显浑浊时,溶液中已有大量球形晶核形成,这时再滴加(NH4)2C2O4沉淀剂.需要强调的是,(NH4)2CO3沉淀剂的使用量要控制在总沉淀剂的10%以内,否则过多的碳酸盐沉淀物会影响前驱物的组成.

图4 新型共沉淀法制备LiNi0.5Mn1.5O4的SEM图Fig.4 Scanning electron microscopy(SEM)images of the particles in the novel preparation process
与LiOH饱和溶液水热反应后的前驱物颗粒的电镜照片如图4b所示.可以发现颗粒的形貌基本未变,只是表面附有大量LiOH颗粒.在传统方法制备LiNi0.5Mn1.5O4时,LiOH往往是通过机械球磨的方式和Ni-Mn化合物混合.这样的传统混合方法不仅不能使各金属离子达到原子级别的混合,还会破坏原前驱物颗粒的形貌.而本方法中采用水热法,当Ni/Mn草酸盐颗粒与饱和LiOH溶液发生水热反应时,大部分LiOH会向球形颗粒内部扩散,Li离子与Mn/Ni离子充分混合.当溶液被蒸干时,溶液中残留的少许LiOH会吸附在球形颗粒的表面,如图4b所示.这种水热处理过程不仅让各离子在原子级别充分混合,而且不会破坏Ni-Mn颗粒的原始形貌.
图4(c,d)为将上述前驱物分别在500和800°C高温反应后得到的颗粒SEM照片.经过500°C高温反应后的颗粒表面变得光滑,如图4c所示.这表明粘附在球形颗粒表面的LiOH已经分解且Li离子均已扩散到球形颗粒内部,与Ni和Mn发生了反应.结合TG和XRD结果可以推断,此时得到的材料为Li-Ni-Mn的复合氧化物,且尖晶石结构已初步形成,但结晶度较低.图4d为在800°C高温反应后得到的材料.从图4d可以看出,生成的LiNi0.5Mn1.5O4仍为球形,但具有明显的次级结构特征.这些球形的粒径保持不变,仍为5-6 μm,但这些颗粒由纳米级或亚微米级一次颗粒组成,一次颗粒具有八面体形貌.可以推测,该次级结构一方面有利于电解液充分浸润正极从而提高电池的倍率性能;另一方面,可以提高材料的振实密度进而提高材料的能量密度.20
3.4 红外表征尖晶石材料内部原子排列的有序性
结构
根据过渡金属离子Ni和Mn的排布是否有序,LiMn1.5Ni0.5O4有P4332和Fd3m两种结构.在P4332简单立方结构中,Li离子位于4a位置,Ni和Mn离子分别位于12d和4c.而在Fd3m面心立方结构中,Li离子位于8a位置,Ni和Mn离子则无序地排列在16d八面体位置.由于在P4332结构中,Ni、Mn离子的有序排布而产生的超晶格结构对X射线的衍射强度很弱,因此很难通过粉末X射线衍射来区分LiMn1.5Ni0.5O4属于何种结构.于是本文采用傅里叶变换红外(FTIR)光谱来分析LiMn1.5Ni0.5O4的结构.
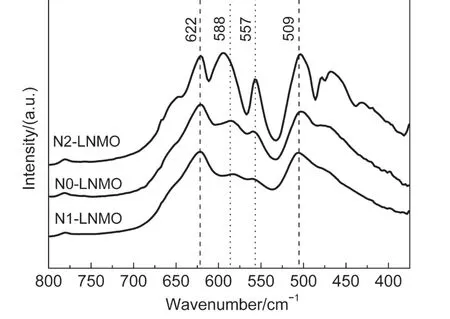
图5 三种不同冷却处理所得到的LiMn1.5Ni0.5O4材料的FTIR图谱Fig.5 Fourier transform infrared(FTIR)spectra of the LiNi0.5Mn1.5O4by three different cooling processes
图5 为新共沉淀法中通过三种不同冷却处理所得到的LiMn1.5Ni0.5O4材料(N0-LNMO、N1-LNMO、N2-LNMO)的FTIR图谱.图中位于620 cm-1处的较强吸收峰对应着尖晶石中MnO6(A1g)八面体Mn―O的对称伸缩振动;而位于510 cm-1处的吸收峰对应结构中Ni2+―O的伸缩振动;位于550-600 cm-1之间的峰则为T(3)2g,其与结构中Ni、Mn的有序排列有着直接联系:当Ni、Mn的排列有序度增强时,该峰的峰强也加强.因此,位于550-600 cm-1之间的T(3)2g振动峰可以用来区分材料为P4332或Fd3m结构.
如图5所示,三种材料在550-600 cm-1之间均能观测到明显的T(3)2g振动峰,只是峰强有着明显差别.这表明三种材料中,Ni和Mn的排布均存在一定的有序性,只是有序排布的程度或所占比例不同.N1-LNMO为快速冷却得到的材料,其T(3)2g峰强最弱,表明N1-LNMO中以Ni/Mn无序排列的Fd3m结构为主.相反,经过二次低温热处理的N2-LNMO中,T(3)2g峰最强,表明N2-LNMO材料中Ni/Mn排布以有序为主,表现出较强的P4332结构特征.而N0-LNMO的T(3)2g峰强处于两者之间,因此其同时具有P4332和Fd3m两种结构特征.因此可以推断,在尖晶石LiMn1.5Ni0.5O4材料中,P4332和Fd3m两种结构往往是共存的.通过特殊的热处理工艺,可以半定量地控制材料中两种结构所占的比例,从而设计出具有特殊电化学性能的LiMn1.5Ni0.5O4材料.
3.5 电化学性能
本研究中以所制备的LiNi0.5Mn1.5O4材料为正极,以Li金属片为负极组装成半电池以测试材料的电化学性能.图6为LiNi0.5Mn1.5O4的充放电曲线.如图6(a-c)所示,各方法制备的LiNi0.5Mn1.5O4的主要充放电平台均为4.7 V,在4.0 V有不同容量的平台.该充放电曲线上,4.7 V平台对应着Ni2+/4+的氧化还原反应,而4.0 V平台则对应着Mn3+/4+的氧化还原过程.
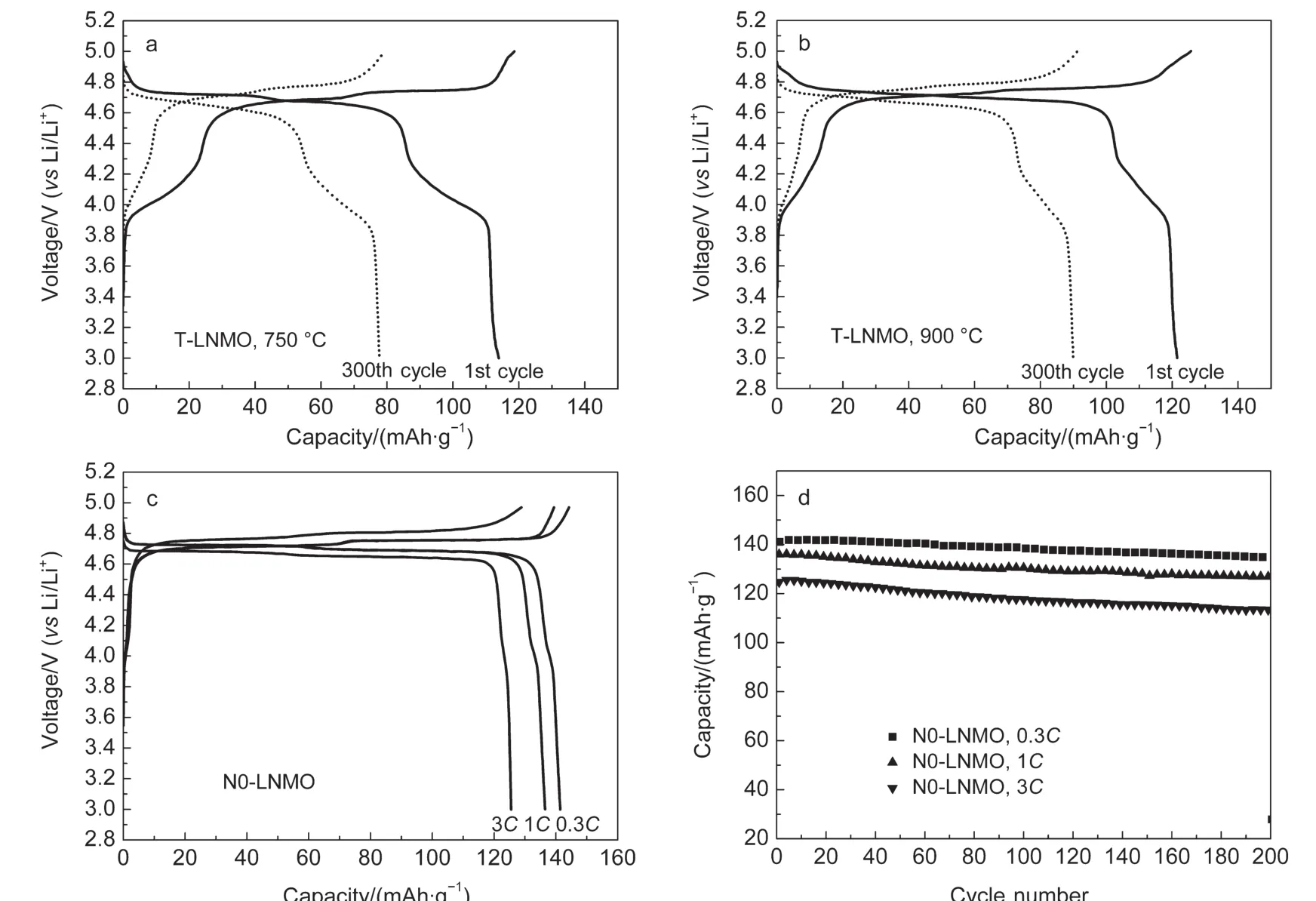
图6 传统固相法(a,b)和新共沉淀法(c,d)合成LiNi0.5Mn1.5O4的充放电(a-c)及循环性能(d)曲线Fig.6 Charging/discharging curves(a-c)and cycling performance(d)of LiNi0.5Mn1.5O4prepared by traditional solid(a,b)state and novel co-precipitation(c,d)methods
如图6(a,b)所示,用传传统固相法在750°C(T-LNMO-750)和在900 °C(T-LNMO-900)温度下制备的LiNi0.5Mn1.5O4分别具有112.9和121.3 mAh·g-1的初始容量.0.3C倍率下经过300次循环后,容量保持率分别为69.8%和74.4%.这表明在传统固相法中,900°C合成的LiNi0.5Mn1.5O4的电化学性能要优于750°C,但容量和循环性能均需要进一步提高才能满足动力电池的要求.
新型复合共沉淀法制备的N0-LNMO的充放电曲线如图6c所示.在0.3 C、1C和3C倍率下,N0-LNMO的首次放电容量达到了141.4、136.3和125.1 mAh·g-1.另外,N0-LNMO在4.7V的放电平台十分平坦,且高电压区的放电量为98.3%.N0-LNMO的循环性能如图6d所示,在0.3C、1C和3C倍率下经过200次循环后,N0-LNMO的容量为136.0 mAh·g-1(96.3%),128.6 mAh·g-1(94.4%),和113.9 mAh·g-1(91.1%).即在每次充放电循环中,三种倍率下的容量损失仅为0.04、0.06和0.11 mAh·g-1.据我们所知,具有如此高容量和循环稳定性的LiNi0.5Mn1.5O4材料至今很少有被报道过.
通常认为具有Fd3m结构的LiNi0.5Mn1.5O4具有较好的倍率性能,但是其含有的大量Mn3+离子,往往造成材料在4.0 V平台有较大的容量损失,从而降低了材料的储能密度.在3.4节中已经对N1-LNMO和N2-LNMO两种材料进行了红外表征,前者是Fd3m为主的结构,后者是P4332为主的结构.图7为N1-LNMO和N2-LNMO的充放电曲线、倍率性能以及功率释放曲线,反应了它们不同的电化学特征.
如图7a所示,0.5C倍率下,N2-LNMO的容量高达141.4 mAh·g-1,且放电平台几乎都在4.7V.这是由于在二次热处理时,材料中大部分的Mn3+都发生了氧化反应转化成了Mn4+.在5C倍率下,N2-LNMO的放电电压平台有较大降低(<4.6 V),容量为103.3 mAh·g-1.而当放电倍率进一步提高到10C时,N2-LNMO的放电平台迅速下降到4.4 V以下,容量也只有58.5 mAh·g-1.这表明经过二次热处理的N2-LNMO材料只在较低倍率时容量高,放电平台平稳.图7b为N1-LNMO分别在0.5C、5C及10C倍率下的放电曲线.从图中可以看出,在0.5C下,N1-LNMO的容量比N2-LNMO要低,只有135.6 mAh·g-1,且在4.0 V低压区容量损失严重,这将导致N1-LNMO的能量密度低于N2-LNMO.然而在5C和10C高倍率下,N1-LNMO的容量分别为122.1和90.3 mAh·g-1,且放电电压分别在4.6和4.4 V以上.电压平台和容量保持率均明显高于N2-LNMO.
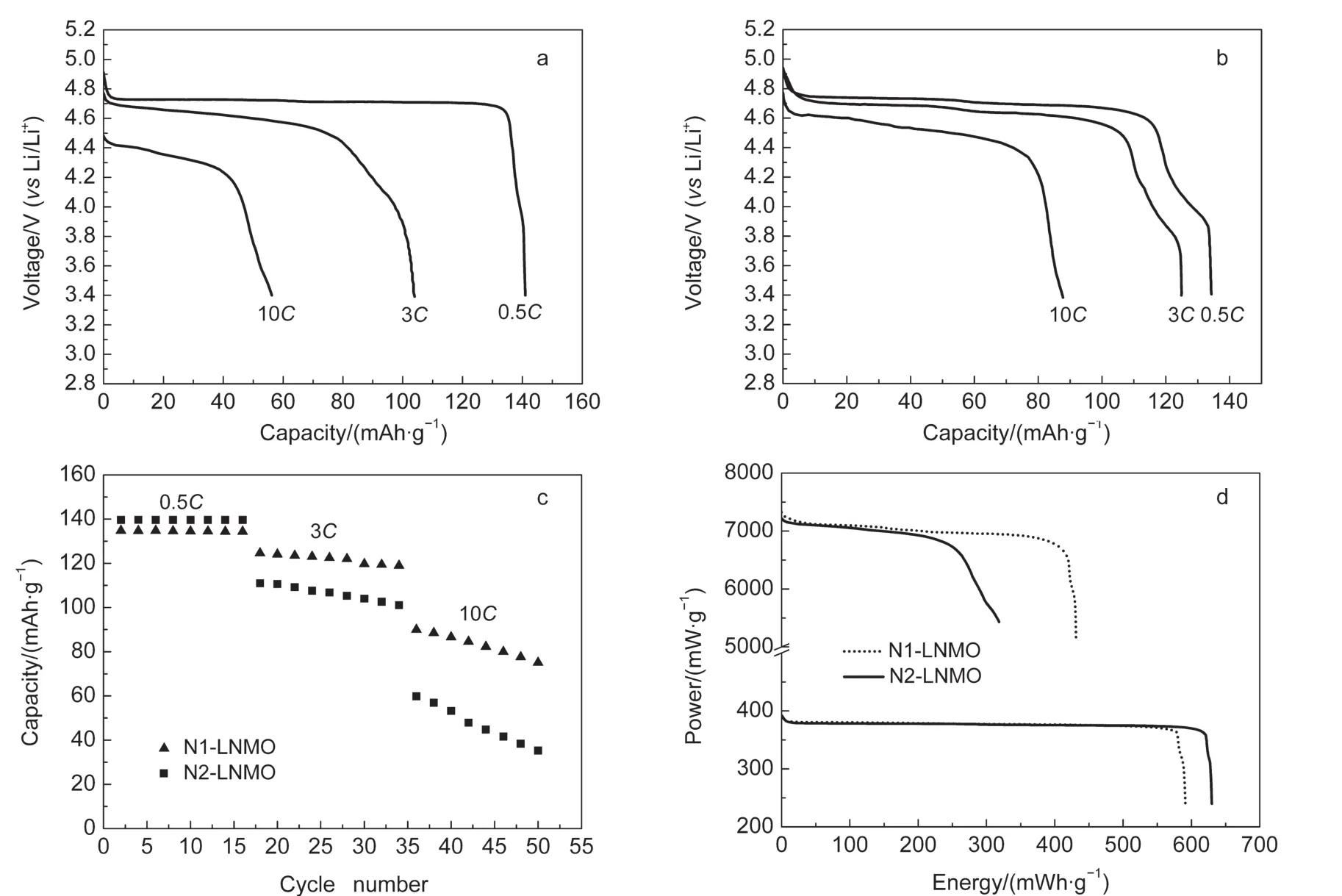
图7 不同冷却处理所得两种LiNi0.5Mn1.5O4材料((a)N2-LNMO、(b)N1-LNMO)的放电曲线及其(c)倍率循环性能和(d)功率释放曲线Fig.7 Discharging curves of LiNi0.5Mn1.5O4materials((a)N2-LNMO,(b)N1-LNMO),(c)rates performance,and(d)power-energy releasing curves
图7 c为N1-LNMO和N2-LNMO两种材料的倍率循环性能图.图中表明,在0.5C倍率下,N2-LNMO有极其稳定的循环性能,其容量也比N1-LNMO的高5 mAh·g-1以上.这是因为N2-LNMO中的Mn3+通过二次低温处理得到了消除,从而减弱了电池过程中副反应的发生.而在5C及10C大倍率下,N1-LNMO的容量和循环稳定性均明显优于N2-LNMO,这是由于N1-LNMO具有更好的电导性,从而在大倍率下具有较高的容量保持率和循环稳定性.
为了更直观地反映出N1-LNMO和N2-LNMO的功率特性,图7d展示了两种LiNi0.5Mn1.5O4材料的功率放电曲线.如图7d所示,在400 mW·g-1的输出功率下,N2-LNMO能稳定输出648.6 mWh·g-1的能量,而N2-LNMO输出596.4 mWh·g-1的能量;在7000 mW·g-1高功率下,N2-LNMO只能输出290.2 mWh·g-1的能量,而N1-LNMO则仍可以输出高达440.7 mWh·g-1的能量.因此,N1-LNMO具有十分优异的大功率特性,可以作为高功率型高电压动力锂离子电池的正极材料;而N2-LNMO则具有杰出的高能量特性,可以作为高能量型高电压动力锂离子电池的正极材料.
4 结论
首先用传统固相法合成了尖晶石结构LiNi0.5Mn1.5O4材料,材料中含有一定杂质且结晶度低.电化学分析表明该LiNi0.5Mn1.5O4的容量不超过121.3 mAh·g-1,且在4.0 V低压区的容量损失严重,材料的循环性能也有待于提高.
新共沉淀法最终合成了具有球形次级结构的LiNi0.5Mn1.5O4材料,且材料的相组成单一、结晶度高.合成的LiNi0.5Mn1.5O4的容量达到了141.4 mAh·g-1,4.7 V高压区容量占到98.3%.在0.3C,1C和3C倍率下经过200次循环后的容量分别为136.0 mAh·g-1(96.3%),128.6 mAh·g-1(94.4%)和113.9 mAh·g-1(91.1%).通过不同的热处理工艺还分别得到了具有十分优异的高功率及高能量LiNi0.5Mn1.5O4材料,其功率密度和能量密度分别达到了7000和648.6 mWh·g-1以上,可分别较好地满足高功率型高电压动力锂离子电池和高能量型高电压动力锂离子电池的需求.
(1) Qi,L.Lithium Ion Secondary Battery for Electronica Vehicle,2nd ed.;Science Press:Beijing,2013;pp 49.[其 鲁.电动汽车用锂离子二次电池(第二版).北京:科学出版社,2013:49.]
(2)Terada,Y.;Yasaka,K.;Nishikawa,F.;Konishi,T.;Yoshio,M.;Nakai,I.J.Solid-State Chem.2001,156,286.doi:10.1006/jssc.2000.8990
(3) Song,M.Y.;Ahn,D.S.Solid State Ionics 1998,112(1-2),21.doi:10.1016/S0167-2738(98)00218-5
(4) Kim,J.H.;Myung,S.T.;Sun,Y.K.Electrochim.Acta 2004,49,219.doi:10.1016/j.electacta.2003.07.003
(5) Santhanam,R.;Rambabu,B.J.Power Sources 2010,195,5442.doi:10.1016/j.jpowsour.2010.03.067
(6) Hagh,N.M.;Amatucci,G.G.J.Power Sources 2010,195,5005.
(7) Liu,G.Q.;Wang,Y.J.;Qi,L.;Li,W.;Chen,H.Electrochim.Acta 2005,50(9),1965.
(8)Hwang,B.J.;Wu,Y.W.;Venkateswarlu,M.;Cheng,M.Y.;Santhanam,R.J.Power Sources 2009,193,828.doi:10.1016/j.jpowsour.2009.04.012
(9) Lee,Y.S.;Sun,Y.K.;Ota,S.;Miyashita,T.;Yoshio,M.Electrochem.Commun.2002,4,989.doi:10.1016/S1388-2481(02)00491-5
(10) Fan.Y.;Wang,J.;Ye,X.;Zhang,J.Mater.Chem.Phys.2007,103,19.doi:10.1016/j.matchemphys.2006.10.006
(11) Sun,Y.K.;Oh,S.W.;Yoon,C.S.;Bang,H.J.;Prakash,J.J.Power Sources 2006,161,19.doi:10.1016/j.jpowsour.2006.03.085
(12) Fang,X.;Ding,N.;Feng,X.Y.;Lu,Y.;Chen,C.H.Electrochim.Acta 2009,54,7471.doi:10.1016/j.electacta.2009.07.084
(13) Chen,Z.;Zhu,H.;Ji,S.;Linkov,V.;Zhang,J.;Zhu,W.J.Power Sources 2009,189,507.doi:10.1016/j.jpowsour.2008.11.001
(14)Fang,H.S.;Wang,Z.X.;Li,X.H.;Guo,H.J.;Peng,W.J.J.Power Sources 2006,153,174.doi:10.1016/j.jpowsour.2005.03.179
(15) Takahashi,K.;Saitoh,M.;Sano,M.;Fujita,M.;Kifune,K.J.Electrochem.Soc.2004,151(1),A173.
(16) Wu,S.;Kim,S.J.Power Sources 2002,109,53.doi:10.1016/S0378-7753(02)00034-4
(17) Park,S.B.;Eom,W.S.;Cho,W.I.;Jang,H.J.Power Sources 2006,159,679.doi:10.1016/j.jpowsour.2005.10.099
(18) Zhu,Z.;Yan,H.;Zhang,D.;Li,W.;Qi,L.J.Power Sources 2013,224,13.doi:10.1016/j.jpowsour.2012.09.043
(19) Zhu,Z.;Qi,L;Zhang,D.;Yu,H.Y.Electrochim.Acta 2014,115,290.doi:10.1016/j.electacta.2013.10.167
(20)Zhu,Z.;Zhang,D.;Yan,H.;Li,W.;Qi,L.J.Mater.Chem.A 2013,1,5492.doi:10.1039/c3ta10980a

