水苏碱对肾纤维化大鼠肾组织CHOP、caspase-3作用
张 翠,佟倩倩,高佳雪,尚东雨,吕海杰,芦 莹,康天济
(1. 哈尔滨商业大学 药学院,哈尔滨 150076;2. 黑龙江中医药大学,哈尔滨 150040)
肾间质纤维化是多种慢性肾脏病发展到终末期肾衰的共同途径.以往的研究主要从组织形态学、细胞外基质、细胞因子等方面对输尿管梗阻引起肾间质纤维化进行阐述,而在分子水平上的研究甚少.近年来随着人们对细胞水平应激反应研究的不断深入,发现各种细胞器的应激与多种肾脏病相关.内质网应激(ERS)启动的凋亡途径是近年才发现的一种新的凋亡途径.它通过激活未折叠蛋白反应(UPR)[1]以保护由ERS所引起的细胞损伤, 恢复细胞功能, 但是如果损伤太过严重,内环境稳定不能及时恢复,ERS则引起细胞凋亡.CHOP是内质网应激诱导蛋白,在调节细胞程序性死亡中具有重要作用,其表达调控可能因刺激因素、细胞种类的不同而不同,并在不同分子水平发挥机制[2].在细胞分化、凋亡及疾病发生中起广泛作用,作为中间性作用分子,广泛影响其下游蛋白的表达和作用, 本研究旨在从亚细胞分子水平阐明肾间质纤维化的病理机制,探讨水苏碱对肾纤维化大鼠与内质网应激相关凋亡途径的关系,为水苏碱的开发利用提供理论依据.
1 实验材料
1.1 实验动物
清洁级健康雄性Wistar大鼠60只,6~8周龄,体重(200±20) g,购自吉林大学实验动物中心,合格号:SCXK-(吉)-2003-2004.
1.2 主要试剂及仪器
水苏碱(四川天然活性成分研究所,质量分数为98%),依那普利(上海现代制药股份有限公司).血肌酐、尿素氮试剂盒(中生北控生物科技股份有限公司), 一抗兔抗鼠CHOP、caspase-3多克隆抗体、第二抗体辣根过氧化物酶标记山羊抗兔IgG(北京博奥森生物工程有限公司),二氨基联苯胺(DAB)显色试剂盒(北京中山生物技术公司),医学病理图象分析系统Image Pro Plus 6.0分析软件(哈尔滨医科大学提供).
2 实验方法
2.1 动物分组及大鼠UUO模型的建立
大鼠适应性饲养7 d后, 将60只大鼠按随机表分为6组:假手术组、模型组、依那普利组、水苏碱高、中、低剂量组,每组各10只.采用单侧输尿管梗阻法制作肾间质纤维化动物模型[3-4].以10%水合氯醛(3 mL/kg)腹腔注射麻醉后,将大鼠右侧卧位固定于手术台上,分离左侧输尿管,在肾盂部位行左侧输尿管结扎术,假手术组大鼠仅分离左侧输尿管,不结扎不剪断.术前1 d灌胃给药,依那普利组给药剂量为0.45 mg/(kg·d),水苏碱高、中、低剂量组给药剂量依据文献[5]分别为92.88、46.44、23.22 mg/( kg·d),假手术组和模型组给同体积生理盐水.每日给药1次,连续14 d.术后14 d处死大鼠,取梗阻侧肾脏,部分置4%多聚甲醛固定液中,余下置于液氮中速冻后-80 ℃冰箱保存.
2.2 Scr、BUN检测
采用Glamour 2000型全自动生化分析仪.
2.3 肾脏病理评分
常规固定、包埋、切片,行HE及Masson染色.双盲法于光镜400倍下分别于左上、左下、右上、右下、中间各取2个视野,每张切片共10个视野,进行半定量分析,依据文献[6]结合本模型特点,选取间质纤维化、小管萎缩、间质浸润、红细胞管型、蛋白管型、间质水肿、小管扩张、小管细胞空泡变性8项指标来判断肾间质病理改变,每个参数按0~3分评定(0=正常, 1=轻度受损, 2=中度受损, 3=重度受损).Masson染色观察肾组织胶原沉积,每例切片在400倍的光镜下,选取10个不重复的视野[7],以蓝色胶原沉积为阳性信号.采用Image Pro plus-6.0多媒体彩色病理图像分析软件进行分析.计算肾间质胶原沉积面积与视野内肾小管间质总面积(去除肾小管管腔)的比值并取平均值.
2.4 肾组织CHOP、caspase-3表达
采用免疫组织化学SP法检测,实验结果采用单盲法评价.借助Image Pro plus-6.0高清晰度彩色病理图文报告分析系统,每张切片随机选取5个高倍视野(×400) , 每个视野内选3~5处阳性染色区域,测定阳性染色区域的光密度值,进行组间比较.
3 统计学处理
4 实验结果
4.1 Scr、BUN水平
模型组与假手术组比较,BUN和Scr显著增加(P<0.01);各治疗组与模型组比较,BUN和Scr均有差异(P<0.05),提示各治疗组均能降低大鼠血清BUN、Scr水平;水苏碱高剂量组与依那普利组比较有差异(P<0.05),说明水苏碱高剂量组降低Scr、BUN作用明显优于依那普利组. 结果见图1、2.
4.2 肾组织病理变化
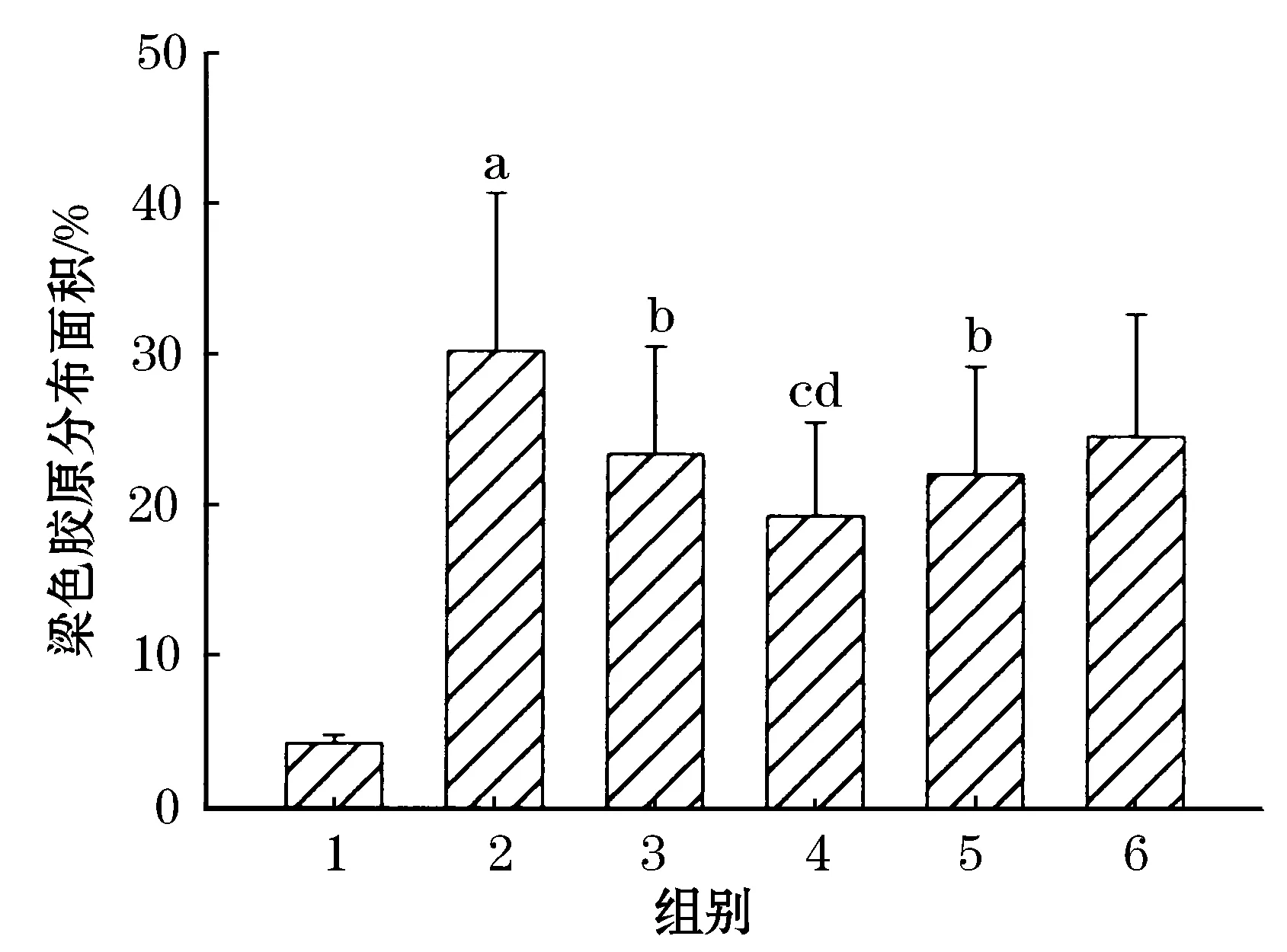
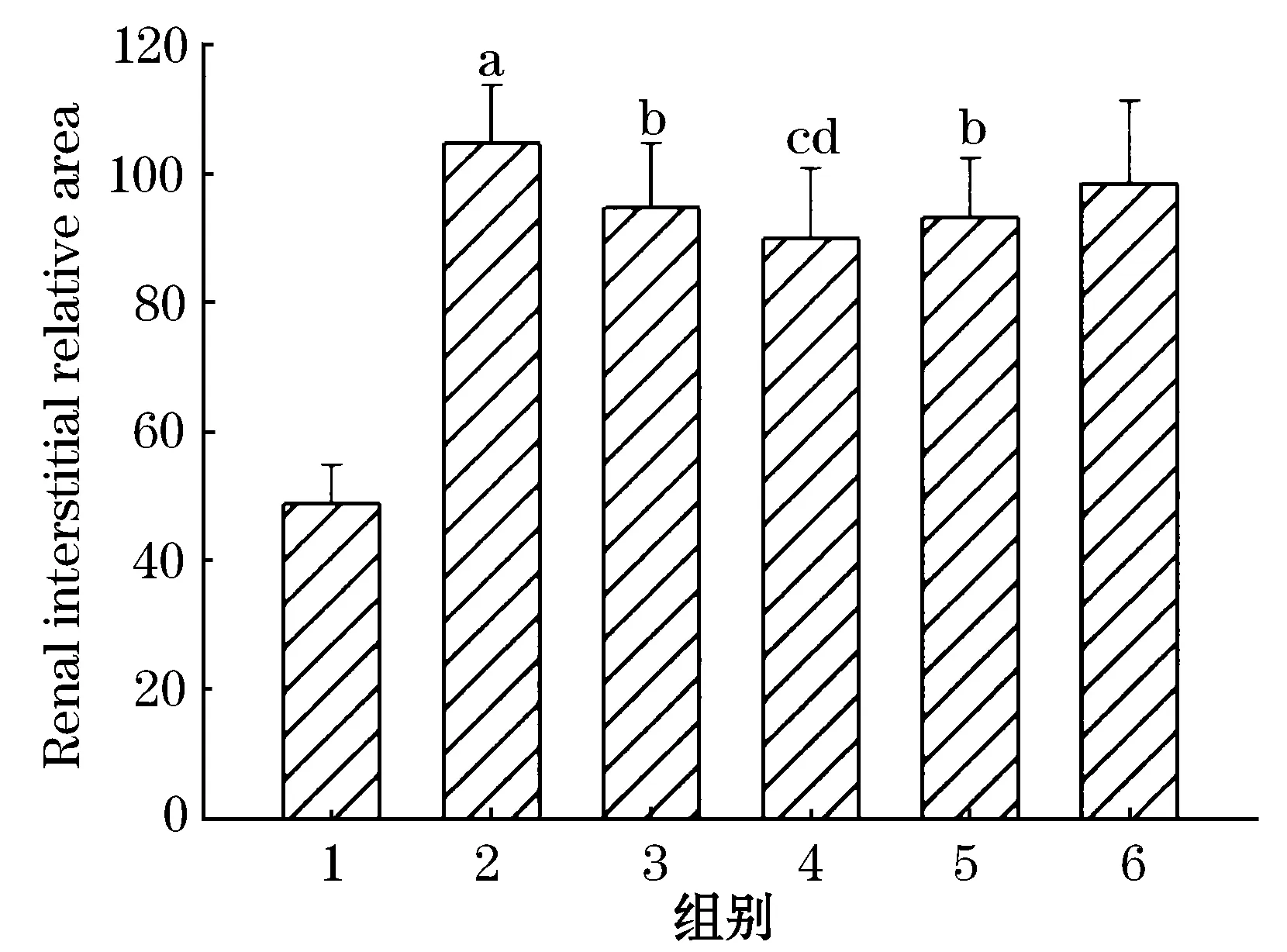
图3为HE染色图,结果显示,假手术组光镜下肾小球及肾小管间质正常;模型组肾间质淋巴细胞、单核细胞浸润,肾小管扩张,上皮细胞变性、萎缩、坏死,肾间质纤维化.模型组与假手术组比较,肾小管损伤指数有显著性差异(P<0.01);各治疗组与模型组比较均有差异(P<0.05,P<0.01);水苏碱高剂量组与依那普利组比较有差异(P<0.05),说明水苏碱高剂量组能明显改善肾小管损伤程度.图4为Masson染色,结果显示,假手术组肾脏的胶原染色主要位于肾小球基膜、系膜区和肾小管的毛细血管周围,肾小管周围间质区分部较少;模型组可见肾间质大量胶原纤维增生,间质胶原纤维呈蓝色染色,灶状分布,皮髓交接处更为明显;模型组与假手术组比较有显著性差异(P<0.01);各治疗组与模型组比较有差异(P<0.05);水苏碱高剂量组与依那普利组比较有差异(P<0.05), 比较图见图5、6.
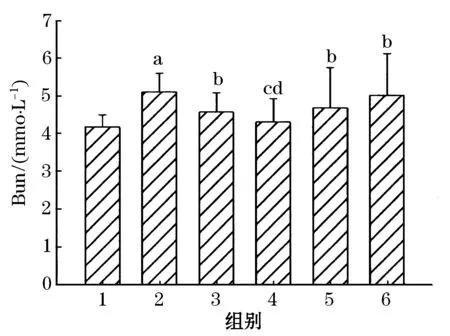
1—假手术组;2—模型组;3—依那普利组;4—水苏碱高剂量组;5—水苏碱中剂量组;6—水苏碱低剂量组与正常组比较aP<0.01;与模型组比较bP<0.05,cP<0.01;与依那普利组比较dP<0.05
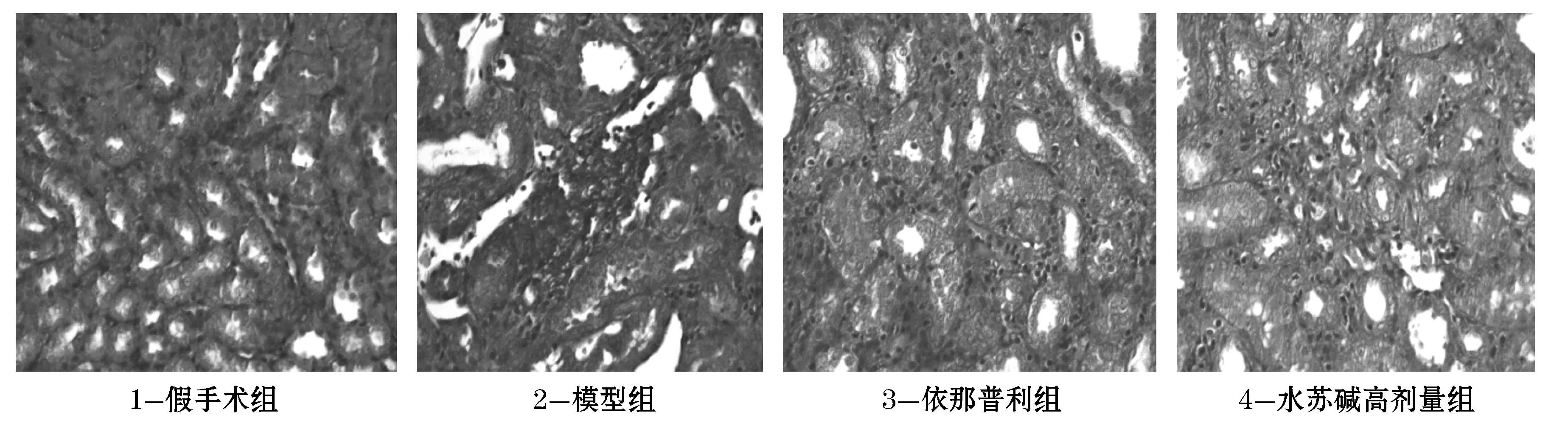
图4 Masson染色图

1—假手术组;2—模型组;3—依那普利组;4—水苏碱高剂量组;5—水苏碱中剂量组;6—水苏碱低剂量组与正常组比较aP<0.01;与模型组比较bP<0.05,cP<0.01;与依那普利组比较dP<0.05
1—假手术组;2—模型组;3—依那普利组;4—水苏碱高剂量组;5—水苏碱中剂量组;6—水苏碱低剂量组与正常组比较aP<0.01;与模型组比较bP<0.05,cP<0.01;与依那普利组比较dP<0.05
4.3 对UUO大鼠肾组织内质网应激特异转录因子CHOP表达的影响
假手术组肾小管上皮细胞胞浆、肾小球脏层上皮细胞偶见CHOP表达;模型组肾小管上皮细胞胞浆中CHOP表达明显增多,呈不均匀颗粒状,肾小球表达不明显,为棕褐色染色.模型组与假手术组比较,CHOP明显升高(P<0.01);各治疗组与模型组比较有显著差异(P<0.01);水苏碱高剂量组与依那普利组比较有差异(P<0.05);见图7、8.表明水苏碱高剂量组能显著降低CHOP表达,其作用优于依那普利组.见图9.
4.4 对UUO大鼠肾组织细胞凋亡因子caspase-3表达的影响
假手术组肾小管上皮细胞、间质细胞胞浆有极少量caspase-3蛋白的表达;模型组及各治疗组大鼠小管上皮细胞上出现不同程度的caspase-3阳性表达,部分间质细胞也有表达,表现为棕褐色染色.模型组与假手术组比较,caspase-3明显升高(P<0.01);各治疗组与模型组比较有显著差异(P<0.01);水苏碱高剂量组与依那普利组比较有差异(P<0.05);表明水苏碱高剂量组能降低caspase-3表达,作用优于依那普利组.见图10.
5 讨 论
阐明肾间质纤维化的发病机制对于防治肾间质纤维化和终末期肾病具有重要的临床意义.肾小管间质的病变及其严重程度决定着肾脏病的预后[8].业已证明,肾间质纤维化程度与肾功能减退的相关性比肾小球硬化与肾功能减退的相关性更为密切[9].
本研究结果证实:术后14 d模型组左侧肾脏体积较对侧明显增大,HE染色光镜下可见肾间质淋巴单核细胞浸润、肾小管扩张、上皮细胞变性、萎缩、坏死,肾间质纤维化也随UUO逐渐加重.Masson染色显示胶原逐渐增多,皮髓交接处纤维化程度增强.水苏碱高剂量组与依那普利组比较有差异(P<0.05);表明水苏碱能能减轻肾小管损伤指数,抑制肾间质纤维化的形成.
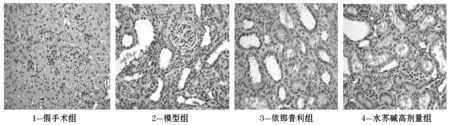
图7 大鼠肾组织CHOP表达
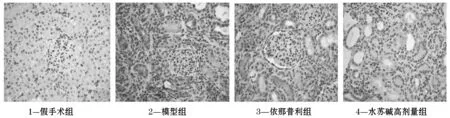
图8 大鼠肾组织caspase-3的表达
1—假手术组;2—模型组;3—依那普利组;4—水苏碱高剂量组;5—水苏碱中剂量组;6—水苏碱低剂量组与正常组比较aP<0.01;与模型组比较bP<0.05,cP<0.01;与依那普利组比较dP<0.05
本实验结果显示,随着梗阻时间的延长,BUN、Scr排泄减少,血清中BUN、Scr浓度急剧上升,模型组与假手术组比较有显著性差异(P<0.01).各治疗组中尿素、肌酐的浓度均明显下降,水苏碱高剂量组与依那普利组比较BUN、Scr有差异(P<0.05).提示水苏碱能降低大鼠血清BUN、Scr水平,改善肾功能.

1—假手术组;2—模型组;3—依那普利组;4—水苏碱高剂量组;5—水苏碱中剂量组;6—水苏碱低剂量组与正常组比较aP<0.01;与模型组比较bP<0.05,cP<0.01;与依那普利组比较dP<0.05
近年来随着人们对细胞水平应激反应研究的不断深入,发现各种细胞器的应激与多种肾脏病相关.亚细胞水平的应激包括内质网应激(ERS)、线粒体应激和核应激.目前备受关注的内质网应激(ERS)是亚细胞水平发生的早期应激事件, 是线粒体应激与核应激的共同通路[10].一定程度的ERS能通过激活保护机制而发挥细胞保护作用,如果该反应能力低下则可增加细胞对刺激损伤的敏感性:同时,过强或过长时间的ERS使保护机制不能与损伤抗衡时,通过激活下游的凋亡信号分子CHOP/GADDl53、caspase等[11]可导致细胞凋亡.GADDl53/CHOP是内质网应激特异的转录因子[12-13],属C/EBP转录因子家族成员.CHOP蛋白是联系ERS与细胞凋亡的重要中间信号分子,可通过多种途径诱导细胞凋亡.有研究显示, CHOP高表达可通过抑制Bcl-2(凋亡负调节蛋白)诱导凋亡;还可通过与促凋亡死亡受体5(DR5)基因5翼状区结合而增加DR5蛋白的表达,DR5通过激活caspase通路诱导细胞的程序性死亡[14].CHOP活化是多种损伤因素作用下平滑肌细胞、胰岛B细胞以及肝脏细胞凋亡最重要的信号途径[15-16].本研究发现:术后14dUUO大鼠肾组织CHOP的表达量迅速增加,假手术组大鼠肾组织中几乎无表达,水苏碱高剂量组与依那普利组比较CHOP有差异性(P<0.05);说明水苏碱能降低由于应激造成的CHOP高表达,且作用优于依那普利组.这与文献报道在正常情况下,CHOP主要存在于细胞质中,在非应激状态下,它的表达水平很低,而在内质网应激中,表达量大大增加, 最终通过激活caspase-3 从而诱导细胞凋亡[17]是一致的.
caspase亦称自细胞介素lB转化酶(ICE)或死亡蛋白酶,被认为是细胞凋亡过程中最重要的蛋白酶.caspase-3是多种凋亡途径的共同下游效应部分,也是细胞凋亡蛋白酶级联反应的必经之路.其以酶原的形式合成和存储,只有在细胞凋亡的级联反应中才转化成活化形式.caspase-3的活化为细胞凋亡的早期生化指标[18-19],在凋亡病理过程中起着重要作用.本研究结果显示术后14 dUUO大鼠肾组织caspase-3的表达量迅速增加,表明肾小管上皮细胞已出现凋亡.给药后水苏碱高剂量组与依那普利组比较caspase-3有差异性(P<0.05);说明水苏碱能降低caspase-3高表达,阻止细胞凋亡且作用优于依那普利组.研究发现,术后14dUUO大鼠肾组织CHOP、caspase-3的高表达,提示促凋亡分子CHOP介导内质网应激相关性细胞凋亡是UUO引起肾小管上皮细胞损伤的新途径;表明CHOP、caspase-3介导的ERS相关途径参与了肾间质纤维化过程.UUO大鼠肾组织CHOP表达量上调与内质网应激特异的转录因子诱导肾小管上皮细胞凋亡表达量增加的变化规律一致.由于凋亡是一程序性过程,因此从UUO大鼠至CHOP、caspase-3活化这段时间是肾损伤干预细胞凋亡、减轻继发性肾间质纤维化的最好治疗时窗.
本文研究结果表明, 水苏碱能够降低CHOP参与诱导的ERS细胞凋亡反应,提示水苏碱具有降低UUO大鼠肾组织ERS介导的细胞凋亡反应的作用,其作用机制可能与其抑制CHOP蛋白表达有关.
参考文献:
[1] SUNDAR R S, SR INIWASAN V, BALASUBRAMANYAM M,etal. Endop lasm ic reticu lum (ER) stress & diabetes [J]. Indian J Med Res, 2007, 125 (3): 411-424.
[2] 袁小青,马向华,沈 捷. 核转录因子CHOP研究进展[J]. 医学研究杂志,2008, 37(8):15-18.
[3] SHARMA A K, MAUER S M, KIM Y,etal. Interstitial fibrosis in obstructive nephropathy [J]. Kidney Int, 1993, 44: 774.
[4] SHIGETO I, JEREMIAH M, RUTH M C,etal. AngiotensinⅡreceptor antagonist ameliorates renal tubulointerstitial fibrosis caused by unilateral ureteral obstruction[J]. Kidney Int., 1995, 47:1285.
[5] 郑虎占,董泽宏,佘 靖.中药现代研究与应用[M].北京:学苑出版社,1997: 3803-3823.
[7] RADFORD M G Jr,DONADIO J V J, BERGSTRALH E J,etal.Predicting renal outcome in IgA nephropathy [J]. J Am Soc Nephrol,199,8 (2):199-207.
[8] MIZUGUCHI Y, MIYAJIMA A, KOSAKA T,etal. Atorvastat in ameliorates renal tissue damage in unilateral ureteral obstruction [J]. J Urol., 2004, 172 (6 Pt 1): 2456-2459.
[9] BUHL R, FARMER S G. Future directions in the pharmacologic therapy of chronic obstructive pulmonary disease [J]. Proc Am Thorac Soc., 2005, 2 (11): 83293.
[10] OKON K, SULOWICZ W, SMOLENSKI O,etal. InterstitiaI,tubular and vacular factor in progression of primary glomerulonephritis [J]. Pol J Pathol., 2007, 58 (2): 73-78.
[11] SZEQEZDI E, LOQUE S E, GORMAN A M,etal. Mediators of endoplasmic reticulum stress-induced apoptosis [J]. EMBO Rep, 2006, 7 (9): 880-885.
[12] YOKOUCHI M, HIRAMATSU N, HAYAKAWA K,etal. Atypical bidirectional regulation of cadmium induced apoptosis via distinct signaling of unfolded protein response [J]. Cell Death Differ, 2007, 14 (8): 1467-1474.
[13] OAD T, KOSUGE Y, ARAKAWA M,etal.Distinct mechanism ofcell death is responsible for tuni camyein-induced ER sttress in SK-N-SH and SH-SY5Y cells [J]. Neurosci Res., 2008, 60 (1): 29-39.
[14] 柳垂亮,李向宇,程志芳, 等.异氟醚预处理对大鼠肠缺血再灌注后肠损伤的影响[J].中国药学杂志,2012,47(21):1711-1715.
[15] CHENG W P, HUNG H F, WANG B W,etal. The molecular aegulation of GADDl53 in apoptosis of cultured vascuIar smooth muscle cells by cyclic mecharical stretch [J]. Cardiovasc Res, 2008, 77 (3): 551-559.
[16] LAWAENCE M C, MCGIYNN K, NAZIRUDDIN B,etal. Differential reguIation of CHOP-lO/GADDl53 gene expression by MAPK Signaling in pancreatic beta-cell [J]. Proc Nat1 Acad Sci USA, 2007, 104(28): 11518-11525.
[17] 翟 丽,杨 月, 郭秀丽, 等. 内质网应激介导的细胞凋亡途径及新靶点药物[J].中国药学杂志, 2008,43(18):1361-1364.
[18] 刘 岩,张 虹,金 雪, 等.荷包牡丹碱诱导人肺腺癌细胞A549凋亡及其机制初探[J].中国药学杂志,2011,46(24):1890-1893.
[19] 张 翠,张 兰,刘 颖,等.芪丑汤对肾间质纤维化大鼠EMT抵抗作用研究[J].哈尔滨商业大学学报:自然科学版,2011,27(3):267-271,319.

