Smad4在乳腺癌及癌周组织中的表达及意义
姜 晶 王彩芹 刘楠楠
(北华大学附属医院病理科,吉林 吉林 132011)
乳腺癌的发生是因为原癌基因的激活和抑癌基因的功能失活,其发展是一个多因素多阶段的过程,往往涉及多个基因的改变〔1,2〕,近年来随着对转化生长因子(TGF)-β下游重要的信号分子Smad4蛋白研究的不断深入,其表达的减少或缺失与肿瘤进展的关系逐渐引起人们的重视;Smad4被看作多种肿瘤的抑癌基因。本研究探讨Smad4在乳腺癌发病机制中的可能作用。
1 材料与方法
1.1资料 我院病理科乳腺肿瘤患者乳腺组织切除标本。乳腺癌70例(高分化型28例、低分化型42例),伴有相应的癌周组织61例,乳腺纤维腺瘤52例。均为女性,原发单侧,年龄28~78〔平均(47.71±10.13)〕岁。病例临床资料记录详细,且术前均未做过化疗及放射治疗。
1.2试剂 兔抗人Smad4单克隆抗体,购自英国Abcam公司。通用SP-9000免疫组织化学试剂盒和DAB试剂盒均购自北京中杉金桥生物技术有限公司。实验程序严格按照SP法试剂盒说明书操作。
1.3病理诊断标准 乳腺癌及癌周组织中乳腺增生性病变的病理诊断标准参照乳腺增生症及乳腺癌组织分类标准〔3〕,同时参考WHO乳腺病理学分类(WHO分类)形态学标准〔4〕。
1.4免疫组织化学染色方法 所有乳腺组织经10%甲醛溶液固定,梯度酒精脱水、透明、浸蜡及包埋,连续切片,厚4 μm,HE染色,常规确诊,并留取白片待免疫组织化学染色。将切片脱蜡水洗后,pH6.0枸橼酸盐修复液高压修复10 min(喷气后2 min),羊血清封闭15 min,加一抗(1∶100稀释)4℃冰箱内过夜,次日依次滴加二抗,三抗,均在37℃温箱内孵育20 min,最后DAB显色,苏木素染核,梯度酒精脱水,中性树胶封片,上述各步骤间均用PBS洗涤切片3次,每次5 min,用已知阳性片做对照,以PBS为一抗做阴性对照。
1.5结果判定 Smad4蛋白阳性染色呈棕黄色或黄色颗粒,阳性细胞结构清晰,阳性染色定位准确(其着色明显高于背景),每例切片在高倍视野下,选取5个视野区,每个视野区计数200个细胞。表达强度根据阳性细胞所占百分比进行评估,并取其平均值。染色结果判定评分;阴性细胞数<10%为阴性(-);10%~50%为弱阳性(+);51%~75%为中度阳性();>75%为强阳性()。
1.6统计学方法 采用SPSS11.5统计软件进行χ2检验。
2 结 果
2.1乳腺癌组织Smad4阳性率与癌周乳腺增生及纤维腺瘤比较 乳腺癌组织Smad4阳性率分别与癌旁乳腺增生、乳腺纤维腺瘤比较均存在显著差异(P=0.002,P=0.034)。见表1。
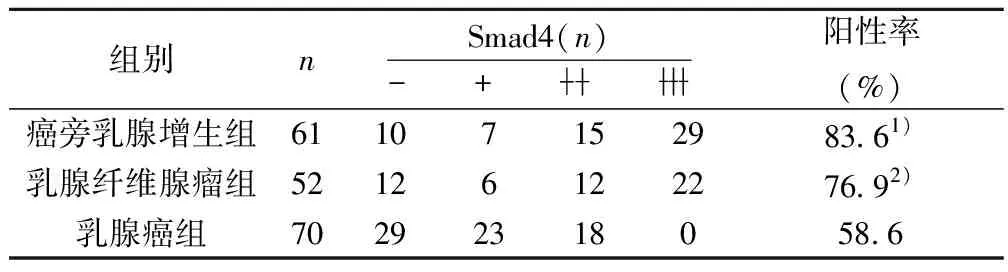
表1 各组Smad4蛋白表达状况
2.2Smad4在相关乳腺组织中的表达差异 乳腺癌高分化型Smad4阳性表达17例(60.7%);低分化型阳性表达24例(57.1%),两者比较无差异性(P=0.766)。
2.3Smad4在相关乳腺组织中的表达定位 Smad4蛋白呈棕黄色或黄色颗粒,主要呈灶状或弥漫性表达于细胞质及细胞核,部分间质细胞亦有阳性表达。癌组织,癌周组织及纤维腺瘤均有Smad4表达,但良性病变组织明显高于癌组织的表达。见图1。

图1 各组Smad4表达(×400)
3 讨 论
Smad4蛋白是TGF-β超家族下游一类非常重要的细胞内信号转导分子,是把TGF-β与其受体相结合后产生的信号从胞质传导到细胞核内的中介分子〔5〕。Smad4由2个保守的球状功能域及中间的可变的连接区构成〔6〕。其氨基端区常被称为MH1区,羧基端区被称为MH2区,仅R-Smad和Smad4含有MH1区。在Smads家族中,只有Smad4为公共介体,Smads所有生物效应都是Smad4与任一种Smad蛋白相互作用的结果〔7,8〕。TGF-β信号转导的受体和胞内信号转导分子Smad4等组成一个肿瘤抑制通路,在此过程中Smad4起着瓶颈作用。在通常状态下,Smad4分布在整个细胞中,并呈动态状态穿梭于细胞核和细胞质之间,当受体激活引起R-Smad磷酸化后,可使R-Smad与Smad4结合,促进R-Smad得以进入细胞核,最终结合DNA从而作为转录因子并发挥作用。
最近越来越多的研究证实,Smad4与乳腺癌有密切关系〔9~11〕。Smad4蛋白表达的降低可影响TGF-β/Smad4通路中信号的正常传递,最终导致上皮细胞的过度增生和分化异常,进而参与恶性肿瘤的发生发展。
作为TGF-β信号通路最常见的转导子,Smad4对乳腺癌的发生发展同样起抑制作用〔12,13〕。TGF-β1是多功能肽类生长因子,通过调节细胞的增殖、分化、移行和凋亡,在抑制肿瘤细胞的增殖中发挥重要作用。TGF-β可抑制细胞的增殖,Smad4表达量的降低使TGF-β对乳腺癌细胞的增殖抑制功能减弱,而TGF-β得以由抑癌基因向促癌基因转化〔14〕。Smad4在TGF-β信号转导通路中发生基因突变时,阻断TGF-β1信号向细胞内传递,导致细胞对TGF-β作用无反应性,限制TGF-β1的肿瘤抑制作用,使乳腺导管上皮细胞发生癌变,因此Smad4蛋白是TGF-β信号转导通路中重要的下游中介分子〔15〕。本研究结果亦提示不典型增生与乳腺癌发生密切相关〔16〕。
普通性导管增生(UDH)包括一般性轻度增生,囊性增生,腺病性增生,上皮呈扁平状,亦可呈柱状或立方状;不典型导管增生(ADH)尤其易见于增生性纤维囊性变,既有囊肿形成又有间质增生,通常伴有末梢导管和腺泡上皮的增生,上皮增生呈多房,乳头状。若导管上皮增生呈现一定的导管原位癌,而新分类称其为导管上皮内瘤变(DIN),但基于学术上理解及交流方便,诊断时乳腺病变仍保留传统命名。
乳腺纤维腺瘤由增生的纤维间质和腺体组成,腺体呈卵圆形,圆形或裂隙状,腺体导管由柱状或圆柱形上皮细胞构成,伴有圆形一致的核,间质疏松,富含黏多糖。乳腺癌均为浸润性导管癌(IDN),癌细胞突破导管基膜向间质浸润,癌细胞排成巢状,条索状或伴有大量腺样结构,癌细胞大小形态各异,多形性较明显,核分裂像多见。肿瘤间质有致密的纤维组织增生,癌细胞在间质内呈浸润性生长。根据腺样结构多少确定为高分化型及低分化型。
乳腺增生性病变是病理形态多样的复杂病变,重要的是应注意有无不典型增生等癌前病变〔14〕。本结果提示Smad4参与乳腺癌的发生发展和生物学行为,表明Smad4可能具有类似乳腺癌抑癌基因的作用。Smad4基因在乳腺导管上皮增生、病变的启动、促进、发展与浸润等阶段起着重要作用。乳腺增生是乳腺肿瘤的病理基础。
乳腺癌的发生是一个多因素、多步骤的过程,由多种遗传和变异产生,是多种异常的癌基因、抑癌基因共同作用的积累〔17〕。虽然新版(2003年)WHO乳腺良性肿瘤组织分类没有提到乳腺增生性病变这一概念性名称,但其内容涵盖了乳腺增生性病变:上皮性肿瘤中的导管内增生性病变,导管内乳头状肿瘤,良性上皮增生以及纤维上皮性肿瘤中的纤维腺瘤。
综上,Smad4基因的失活在乳腺增生、恶变过程中具有重要意义,即在乳腺增生性病变中Smad4失活则意味着恶变的始动。因此,应用免疫组织化学染色方法检测乳腺病变组织中的Smad4的表达,对深入了解乳腺癌等恶性肿瘤的生物学行为以及为临床评估乳腺癌的发生、发展,预后判断都具有重要价值。
4 参考文献
1Kallioniemi A.Molecular signatures of breast cancer--predicting the future〔J〕.N Engl J Med,2002;347(25):2067-8.
2Al-Mansouri LJ,Alokail MS.Molecular basis of breast cancer〔J〕.Saudi Med J,2006;27(1):9-16.
3中华病理学杂志编委会.乳腺增生症及乳腺癌组织性分类〔J〕.中华病理学杂志,1997;26(6):325-6.
4Tavassoli FA,Devilee P.WHO classification of tumours pathology genetics tumors of the breast and female genital organs〔M〕.Lyon:IARC press,2003:10.
5Blobe GC,Schiemann WP,Lodish HF.Role of transforming growth factor beta in human disease〔J〕.N Engl J Med,2000;342(18):1350-8.
6Shi Y,Massagué J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus〔J〕.Cell,2003;113(6):685-700.
7Lee PS,Chang C,Liu D,etal.Sumoylation of Smad4,the common Smad mediator of transforming growth factor-beta family signaling〔J〕.J Biol Chem,2003;278 (30):27853-63.
8Chacko BM,Qin BY,Tiwari A,etal.Structural basis of heteromeric smad protein assembly in TGF-beta signaling〔J〕.Mol Cell,2004;15(5):813-23.
9Stuelten CH,Buck MB,Dippon J,etal.Smad4-expression is decreased in breast cancer tissues:a retrospective study〔J〕.BMC Cancer,2006;6:25.
10Pouliot F,Labrie C.Role of Smad1 and Smad4 proteins in the induction of p21WAF1,Cip1 during bone morphogenetic protein-induced growth arrest in human breast cancer cells〔J〕.J Endocrinol,2002;172(1):187-98.
11Hinshelwood RA,Huschtscha LI,Melki J,etal.Concordant epigenetic silencing of transforming growth factor-beta signaling pathway genes occurs early in breast carcinogenesis〔J〕.Cancer Res,2007;67(24):11517-27.
12Kaklamani VG,Baddi L,Liu J,etal.Combined genetic assessment of transforming growth factor-B signaling pathway variants may predict breast cancer risk〔J〕.Cancer Res,2005;65(8):3454-61.
13Kang Y,He W,Tulley S,etal.Breast cancer bone metastasis mediated by the Smad tumor suppressor pathway〔J〕.Proc Natl Acad Sci U S A,2005;102(39):13909-14.
14陈志明,曹红十,李荣贵,等.Smad蛋白在乳腺癌和正常乳腺上皮细胞中的表达及意义〔J〕.吉林大学学报(医学版),2009;35(1):142-5.
15夏立平,刘晓力,陈国平,等.TGF-β1、TGF-βR1、Smad4在乳腺癌发生、发展中的作用及其相互关系〔J〕.海南医学学报,2010;16(6):693-8.
16黄 焰,赵惠斌,李国民,等.乳腺良性病变和乳腺癌临床病理特征及相关分析〔J〕.中华肿瘤防治杂志,2007;14(9):673-5.
17于占江,张 伟,师 岩,等.Smad4与P53在乳腺癌中的表达与其病理特征的相关性研究〔J〕.齐齐哈尔医学院学报,2011;32(5):682-3.

