前列腺增生和前列腺癌患者组织前列腺特异性抗原mRNA水平
马 雷 高英英 辛 华 王光彦
(佳木斯大学附属第一医院,黑龙江 佳木斯 154002)
近年来,前列腺癌(PCa)已成为危害中国男性健康的主要疾病之一〔1〕。前列腺特异性抗原(PSA)作为PCa的筛查、诊断、治疗、监测和良性前列腺疾病的鉴别诊断的主要指标〔2〕已被广泛推广使用。正常情况下,PSA被排泌到前列腺导管内,成为精液的一部分,只有很少量进入血液中。但是在前列腺的恶性肿瘤、前列腺增生(BPH)和前列腺炎症时PSA都可以明显升高。PCa和BPH患者外周血PSA值的重叠交叉造成了不必要的前列腺活检〔3〕。实时荧光定量PCR(RT-PCR)技术一直以来PSA mRNA的测定都处于定性和半定量的水平,而RT-PCR技术则达到了完全定量水平。本文应用RT-PCR技术测定PCa、BPH伴炎症和不伴炎症患者前列腺组织中的PSA mRNA含量,以期研究分析外周血PSA水平和良恶性疾病前列腺组织生成PSA能力的关系,旨在探讨良性BPH伴炎症和不伴炎症患者前列腺组织PSA mRNA水平和外周血PSA含量的关系。
1 材料与方法
1.1病例资料 选自2007~2011年佳木斯大学第一附属医院泌尿外科住院病人。PCa组22例,由于外周血PSA值升高、前列腺彩超、CT、MRI结果异常,初诊为可疑PCa,后经前列腺穿刺活检,病理确诊为PCa,年龄60~87〔平均(70±9.7)〕岁。BPH组38例,由于排尿困难就诊,经前列腺彩超、CT、MRI检查诊断为BPH。需要做经尿道前列腺电切术(TURP)治疗入院,病理确诊为BPH,年龄48~87〔平均(67±8.7)〕岁。
所有病例均进行全部入院检查,包括肛门指诊、外周血PSA、f-PSA、彩超、CT和MRI检查。留取前列腺穿刺活检标本和TURP切除组织,置入冻存管中,保存在液氮罐中,并尽快保存在-80℃超低温冰箱中。
1.2仪器及材料 总RNA提取RNAiso试剂盒、白血病病毒(MMLV)逆转录酶、溴乙啶、焦碳酸二乙酯(DEPC)购自宝生物工程(大连)有限公司,引物由上海生物工程服务技术有限公司合成RT-PCR试剂盒:中山大学达安基因股份有限公司。PSA、f-PSA试剂盒:罗氏诊断产品(上海)有限公司。RT-PCR 分析仪:Applied Biosystems 7300 RT-PCR system。外周血PSA、f-PSA分析仪器(电化学发光法):HITACHI Elecsys 2010。
1.3外周血的提取 采血前避免影响PSA和f-PSA的因素,保证结果的准确性,抽取空腹静脉血(各项检查前)5 ml,立即2 000 r/min离心10 min,分离外周血置-20℃保存,1 w内完成实验。
1.4引物序列 PCR引物:上游:5′-CACTGCATCAGGAACAAAA-3′,下游:5′-CTCATATCGTAGAGCGGGT-3′。β-actin 上游:5′-CGGGAAATCGTGCGTGACAT-3′,下游:5′-GAACTTTGGGGGATGCTCGC-3′,扩增目的片段长度为712 bp。
1.5前列腺组织总RNA提取
1.5.1防止RNA分解酶的破坏和污染 实验中使用的一次性塑料制品均购买经0.1%DEPC水处理过的RNA实验专用器材。所有试剂、器械和三蒸水都经0.1%DEPC水隔夜处理,又经过120℃ 60 min高温高压处理。实验过程中避免交谈,防止唾液中的RNA分解酶破坏RNA。
1.5.2总RNA的提取 严格按照RNAiso试剂盒中的操作程序进行。组织研磨时要彻底,以无可见的明显颗粒为准,充分的研磨可以保证RNA的提取率和质量。RNAiso reagent与组织块的比例为1∶1。氯仿乳化时一定要充分,直到无分相现象。RNA 沉淀清洗时尽量除净乙醇,减少RNA 中的盐离子含量,并要求室温干燥,不能加热干燥。RNA 沉淀完全溶解于DEPC处理水中后,于-80℃保存。
1.6总RNA质量鉴定 用1.2%甲醛变性琼脂糖凝胶电泳鉴定总RNA质量。RNA纯度和浓度用紫外分光光度计下测OD260、OD280值。取OD260/OD280值在1.8~2.0范围内的标本进行逆转录。
1.7cDNA合成 反应体系为总RNA 2 μl,MgCl23 μl,10×RT缓冲液2 μl,RNase Free dH2O 9.5 μl,dNTP混合液1 μl,RNase抑制剂0.5 μl,AMV逆转录酶1 μl,Oligo dT-Adaptor Primer 1 μl;反应条件为:30℃ 10 min,42℃ 60 min,99℃ 5 min,5℃ 5 min。cDNA保存于-20℃冰箱待用。
1.8实时PCR 反应体系为:TaqDNA聚合酶 0.5 μl,MgCl24 μ1,5×PCR缓冲液 5 μ1,dNTP 4 μl,PSA上、下游引物各2 μl,cDNA 5 μ1,灭菌蒸馏水 27.5 μl;溶解曲线出现单一波峰说明扩增产物单一,无非特异性扩增产物。反应条件:孵育:94℃ 120 s,循环1次;扩增:94℃ 25 s,65℃ 30 s,72℃ 30s,45个循环,延伸阶段结束时收集荧光信号;溶解曲线:65℃ 1 s,94℃ 20 s,循环1次,在温度缓慢升高过程中收集荧光信号。
1.9外周血PSA的检测 PSA定量检测采用电化学发光法,使用仪器为HITACHI Elecsys 2010,由专业工作人员测定。
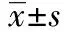
2 结 果
2.1BPH组、PCa组检测结果比较 血PSA浓度在BPH组〔(5.831±6.753)ng/ml〕和PCa组〔(98.232±129.124)ng/ml〕比较差异显著(P<0.01),组织PSA mRNA表达量在BPH组〔(59.845±132.017)拷贝数〕和PCa组〔(20.23±28.223)拷贝数〕比较无显著性差异(P>0.05)。
2.2无炎症BPH组与合并炎症BPH组检测结果比较 血PSA浓度在无炎症BPH组〔(6.234±7.814)ng/ml〕和合并炎症BPH组〔(6.929±5.477)ng/ml〕比较无显著性差异(P>0.05)。组织PSA mRNA表达量在无炎症BPH组〔(59.231±123.458)拷贝数〕和合并炎症BPH组〔(74.866±148.258)拷贝数〕比较无显著性差异(P>0.05)。
2.3PCa组外周血PSA和组织PSA mRNA定量结果和临床参数的关系 PCa组外周血PSA在3种年龄分组中总体比较无显著性差异(P>0.05);在3种临床分期中总体比较差异显著(P<0.05);在3种Gleason评分中总体比较无显著性差异(P>0.05)。PCa组组织PSA mRNA定量检测在3种年龄分组中总体比较无显著性差异(P>0.05);在3种临床分期中总体比较无显著性差异(P<0.05),临床分期B期和C、D两期组间比较差异显著(P<0.05);在3种Gleason评分中总体比较无显著性差异(P>0.05),Gleason评分8~10分组和5~6分组、5~7分组两组组间比较差异显著(P<0.01),见表1。
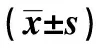
表1 PCa组外周血PSA和组织PSAmRNA定量结果和临床参数的关系
2.4三种疾病分组组织PSA mRNA表达量和外周血PSA水平的相关性分析 无炎症BPH组前列腺组织PSA mRNA表达量和外周血PSA水平具有相关性(r=0.614,P=0.001) 。合并炎症BPH组前列腺组织PSA mRNA表达量与外周血PSA值无相关性(r=0.295,P=0.324)。PCa组组织PSA mRNA表达量与外周血PSA值无相关性(r=0.325,P=0.457)。
3 讨 论
对于前列腺,外周血PSA指标十分特异,现已成为前列腺疾病尤其是PCa的主要标志物〔4,5〕。大部分PCa病人的外周血PSA会出现明显的增高,可是在不同发病原理的诱导下,前列腺炎和BPH病人同样会出现外周血PSA不同程度的升高。这样良、恶性前列腺疾病的外周血PSA水平出现了一定的重叠,使得PSA作为恶性前列腺疾病的标志物的用途受到了影响。虽然PSA的特异性在前列腺上皮细胞内产生,对前列腺组织定量检测PSA可以反映前列腺细胞生成它的能力,但由于在各种前列腺良、恶性疾病时,少量PSA可以泄露到外周血中,使得这种测定准确性不高。而PSA mRNA是PSA的信使基因,是PSA合成的关键蛋白,对PSA的特异性、相关性非常高,测定前列腺组织PSA mRNA可以间接反映上皮细胞生成PSA的能力。虽然外周血中PSA mRNA也会有一定的泄露,但是其离开前列腺上皮细胞就失去了转录成PSA的环境,对测定前列腺组织生成PSA能力的影响十分微弱。本研究大大提高了定量结果的准确性。
本研究发现合并炎症组的PSA生成能力比无炎症BPH组要高,但无显著性差异。这可能是因为前列腺组织受到炎症的刺激,诱导其增殖能力增强,抑制其正常的细胞凋亡程序,从而导致前列腺上皮细胞内的PSA含量增多。本研究在基因水平证明低分化PCa细胞PSA生成能力下降。
本实验对三种疾病分组的组织PSA mRNA表达量与外周血PSA水平的相关性进行了分析,结果显示在无炎症BPH组中二者有明显的相关性,而在合并炎症BPH组和PCa组中,二者无明显的相关性。这可能由于这两组外周血PSA含量增高的途径相似,都是前列腺上皮细胞内的PSA 泄露到细胞外引起。可这两种疾病导致泄露的机制可能完全不同,PCa的前列腺组织基底膜受到癌细胞的侵袭而残缺不全,失去屏障作用,即使前列腺组织的PSA生成能力变化不大,而外周血PSA水平却明显升高。合并炎症BPH组的外周血PSA的升高可能是因为炎症引起了一系列的炎症反应,如细胞损伤、变态反应等,使前列腺细胞遭到破坏,而造成PSA的泄露。
4 参考文献
1Dijkman GA,Debruyne FM.Epidemiology of prostate cancer〔J〕.Eur Urol,1996;30(3):281-95.
2Umekita Y,Hiipakka RA,Koklontis JM,etal.Human prostate tumor growth in athymic mice-inhibition by androgen and stimulation by finasteride〔J〕.Proc Natl Acad Sci USA,1996;93(2):11802-7.
3Rippey JH,Wener MH,Horoszewicz J,etal.Workgroup standardization of PSA 〔J〕.Cancer,1993;71(8):2678.
4汪志伟,林成楚,李 毅,等.老年前列腺手术前后血清游离/总PSA水平变化及意义〔J〕.中国老年学杂志,2010;30(9):1282-3.
5张幕淳,计国义,孔祥波,等.血清fPSA对老年前列腺癌诊断的应用价值〔J〕.中国老年学杂志,2004;24(6):502-4.

