巢蛋白在低氧大鼠肺组织及肺动脉平滑肌细胞的表达及意义
何苏苏 冯加喜 林云 林玲 王良兴
肺血管重构在慢性低氧性肺动脉高压(HPH)的发生、发展中至关重要,但其发病机制至今仍未完全阐明。巢蛋白(nestin)属于第六类中间丝蛋白,主要出现在未分化具有分裂能力的细胞中,在分化成熟后,巢蛋白表达下调,在组织损伤再生过程中又呈现返祖性表达[1]。本研究观察在不同低氧间期大鼠肺组织及肺血管平滑肌细胞(PASMC)巢蛋白的含量及其表达变化,旨在探讨巢蛋白在HPH形成中的意义,现报告如下。
材料与方法
一、实验动物及分组
二级健康雄性SD大鼠30只,体质量180~220 g,由温州医学院动物中心提供。按随机排列法随机分成正常对照组 (N 组)、低氧2周(H2w)组、低氧4周组(H4w),每组各10只。
二、主要仪器和试剂
主要仪器包括常压低氧舱(长沙华曦电子科技有限公司),SJ-42型生理记录仪,YL-3,4型压力传感器,细胞超净工作台 (苏净集团安泰公司),低氧(CO2/N2)培养箱(Heraeus,德国),三目倒置生物显微镜 (Nikon,日本),PCR仪(杭州博日科技有限公司),PCR电泳仪(北京市六一厂),凝胶成像系统(温州市奥利生物医学仪器厂),蛋白电泳系统(Bio-Rad,美国)。
主要试剂包括巢蛋白单克隆抗体(BD Pharmingen,美国),山羊抗小鼠IgG(北京中杉金桥),β-actin(Santa Cruz,美国),DMEM高糖培养基、胎牛血清、胰蛋白酶(Gibco,美国),胶原酶I(Sigma,美国),Trizol总RNA抽提试剂(Invitrogen,美国),PCR 试剂盒 (Fermentas,美国),RIPA裂解液、显影剂、定影剂(上海碧云天生物技术研究所)。
三、方 法
1.低氧动物模型制备
正常对照组大鼠于常压、常氧条件下舱外饲养;H2w组、H4w组置于常压、低氧饲养舱内,O2浓度维持在9.0% ~11.0%,CO2浓度维持在5.5% ~6.5%,每日8 h,每周6 d,分别饲养2周、4周,舱内用无水CaC12吸收水蒸气,碱石灰吸收多余的CO2。
2.肺动脉平滑肌原代细胞培养、传代及分组
在细胞超净工作台操作:取SD大鼠,腹腔麻醉后取出心肺组织,用显微镊分离肺动脉,去除外膜和内膜,将中膜平滑肌用0.2%胶原酶Ⅰ消化,接种于含20%胎牛血清的DMEM的25 ml培养瓶,3 d后换液,约1周后细胞已基本呈融合生长,再进行传代,行α-SM肌动蛋白免疫细胞化学染色法鉴定。本实验采用4~6代细胞。取对数生长期细胞,相同密度接种至6孔培养板,待长至70%~80%时,换无血清培养基同步生长48 h后进行试验。
根据培养方式分为以下几组:0 h组、N 12 h组、N 24 h组、N 36 h组(常氧21%O2下分别培养0、12、24、36 h),H 12 h组、H 24 h组、H 36 h组(低氧5%O2下分别培养12、24、36 h)。
3.肺动脉平均压和右心室质量比、中膜厚度测定
动物分别饲养至规定时间后,于次日称质量,用5%水合氯醛(500 mg/kg)腹腔注射麻醉,仰卧固定,行颈正中切口,分离左颈总动脉和右颈外静脉,采用右心导管法测定大鼠肺动脉压力。自颈外静脉插管至肺动脉,连接YL-4型压力传感器,输入SJ-42型生理记录仪测定mPAP。颈总动脉插管,连接YL-3型压力传感器,输入SJ-42型生理记录仪测定颈动脉平均压(mCAP)。放血处死动物,沿房室环去除心房,沿室间隔剪下右心室,吸干分别称取右心室(RV)、左心室+室间隔(LV+S)质量,以RV/(LV+S)比值反映右心室质量变化。取肺组织常温固定于4%多聚甲醛,常规梯度乙醇脱水,石蜡包埋、切片,苏木素-伊红染色,每张切片选取直径50~200μm肺细小动脉各5支,使用Image-ProPlus 6.0软件分别测定肺动脉相对中膜厚度(PAMT)。
4.肺细小动脉巢蛋白表达免疫组织化学染色检测
采用免疫组织化学染色法检测。一抗为小鼠抗大鼠巢蛋白单克隆抗体,每只大鼠任取一张肺组织切片,梯度水化,3%过氧化氢去除内源性过氧化物酶,兔血清封闭,一抗、二抗、SABC、DAB显色,阳性结果呈棕黄色。每张切片随机选取直径50~200μm肺细小动脉各5支,Image-ProPlus 6.0软件检测动脉管壁平均吸光度作为巢蛋白的相对含量。
5.肺组织中巢蛋白mRNA表达水平检测
采用逆转录PCR法检测。根据已知大鼠巢蛋白基因序列为模板,经primer premier5.0软件设计逆转录PCR引物,巢蛋白上游引物5'-CACCTCAAGATGTCCCTTAGTC-3',巢蛋白下游引物5'-AAGTAGGGTGGTGAGGGTTG-3',目的产物532 bp;内参引物:内参照GAPDH上游引物5'-TGCTGAGTATGTCGTGGAG-3',GAPDH 下 游 引 物 5'-GTCTTCTGAGTGG CAGTGAT-3',目的产物为288 bp。取各组肺组织各1 g,提取总RNA,具体操作参照试剂盒的说明书,紫外分光光度法测定RNA纯度和浓度,逆转录生成模板DNA后进行PCR反应。反应条件为:预变性95℃5 min;95℃30 s,65℃30 s,72℃1 min,共30个循环;72℃延伸10 min。所得PCR产物行1.5%琼脂糖凝胶电泳鉴定目的条带。
6.肺组织及肺平滑肌中巢蛋白蛋白表达水平检测
采用蛋白免疫印迹检测。取各组肺组织1 g及收集各组细胞各约1×107个。RIPA裂解提取组织和细胞总蛋白,常规制备8%和12%双层分离胶及4%浓缩胶,样本经SDS-PAGE电泳后,湿转法转印至PVDF膜上。依次5%脱脂奶粉封闭、小鼠抗大鼠巢蛋白单克隆抗体孵育、HRP标记二抗孵育、ECL发光、显影。以小鼠抗大鼠β-肌动蛋白单克隆抗体为内参照。
四、统计学处理
全部数据经SPSS 16.0统计软件进行统计分析,实验数据以¯x±s表示。所有数据均经正态性检验,多组间比较采用方差分析,用Homogeneity of Variances Test进行方差齐性检验。多组样本均数两两比较采用LSD-t检验。巢蛋白蛋白表达水平与时间的关系采用直线相关分析。以P<0.05为差异有统计学意义。
结 果
一、各组大鼠mPAP、mCAP、RV/(LV+S)和PAMT的变化
H2w、H4w组大鼠的mPAP、RV/(LV+S)、PAMT均高于N组 (P<0.05),H4w组mPAP、RV/(LV+S)、PAMT高于H2w组(P<0.05);3组间mCAP比较差异无统计学意义(P>0.05),见表1。
表1 各组大鼠mPAP、mCAP、RV/(LV+S)和PAMT的变化n=10)

表1 各组大鼠mPAP、mCAP、RV/(LV+S)和PAMT的变化n=10)
注:与N组比较,a P<0.05,b P<0.01;与H4w组比较,c P<0.05
组 别 mPAP(mmHg)mCAP(mmHg)RV/(LV+S)(100%)PAMT(μm)9.9±0.8 122±4 27.5±1.7 17.4±3.1 H2w组 14.4±0.8bc 124±3 31.5±1.2bc 27.6±2.9bc H4w组 16.5±0.8b 127±5 34.9±1.4b 36.2±3.3b F值 182.1 3.591 64.18 413.7 P值N组<0.001 0.414 <0.001 <0.001
二、各组大鼠光镜下肺血管形态学变化
光镜下可见,N组肺细小动脉管壁均匀一致,平滑肌层未见明显增厚;低氧使管腔明显狭窄,中膜平滑肌层细胞增生肥大,H4w组较H2w组更为明显,见图1。
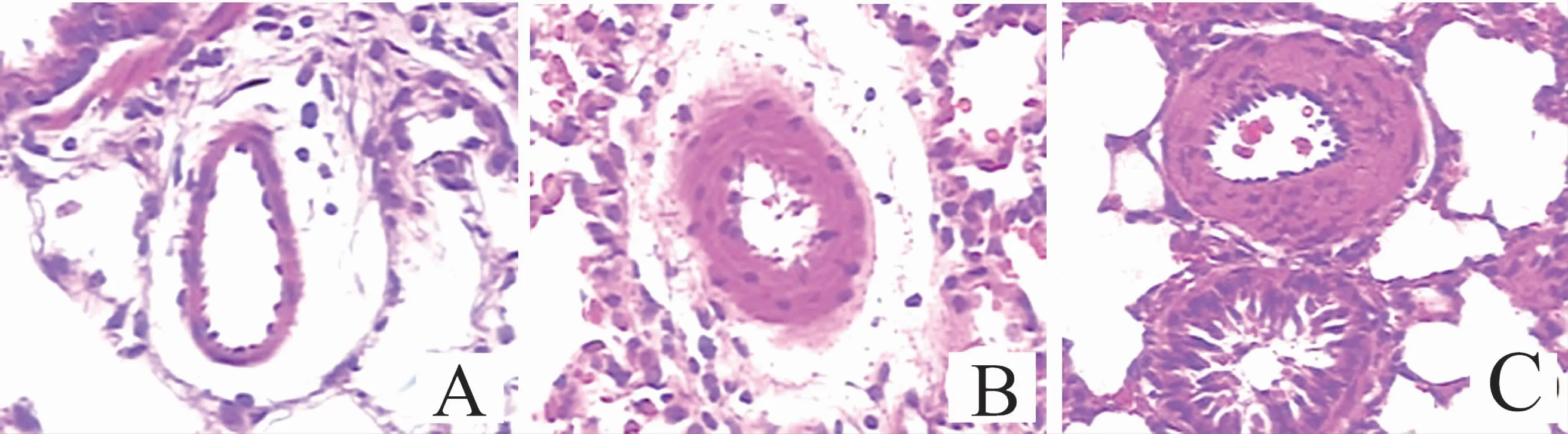
图1 各组大鼠肺小动脉苏木素-伊红染色结果(×200)
三、各组肺细小动脉巢蛋白表达变化
免疫组织化学染色显示,H2w、H4w组肺动脉管壁巢蛋白表达量较N组增加,且H4w组增加较H2w组明显,见图2。
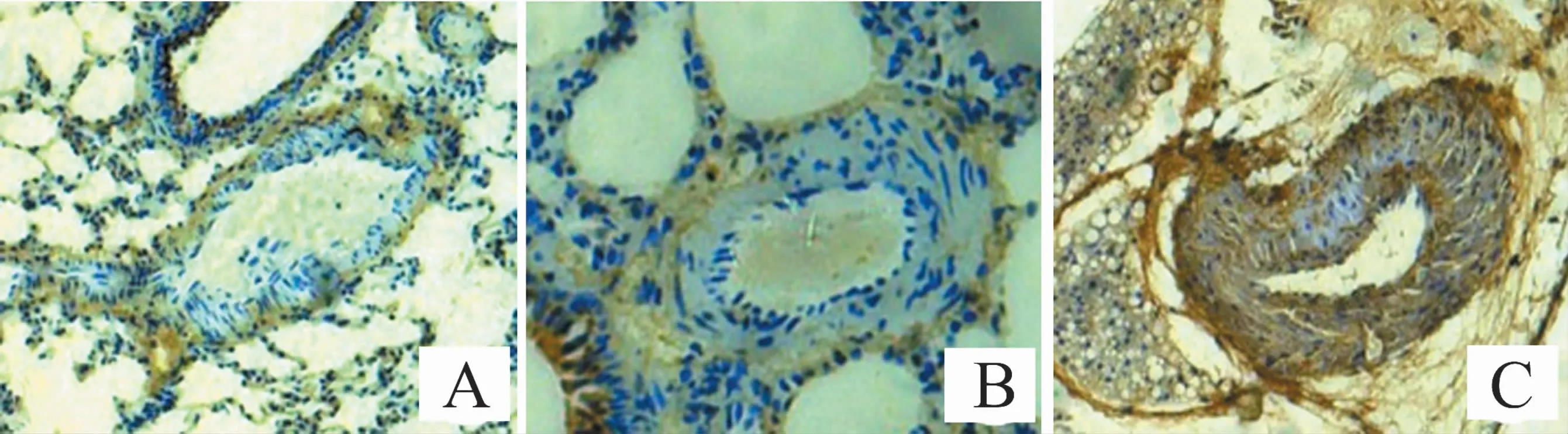
图2 各组大鼠肺小动脉免疫组织化学染色(×200)
四、各组肺组织中巢蛋白mRNA表达
肺组织中,N组巢蛋白mRNA表达水平低,而H2w、H4w组表达均明显增高,与N组比较差异均有统计学意义(P均<0.01),且H4w组的表达较H2w组高(P<0.05),见图3,表2。

图3 各组大鼠肺组织匀浆巢蛋白mRNA的表达
表2 各组大鼠肺细小动脉巢蛋白表达变化s,n=10)

表2 各组大鼠肺细小动脉巢蛋白表达变化s,n=10)
注:与N 组 比 较,t H2w组 =2.357,a P<0.05,t H2w组 =2.921,b P<0.01;与H4w组比较,t H2w组=2.240,c P<0.05
images/BZ_40_1283_2779_2242_2854.png0.108±0.047 H2w组 0.124±0.025ac 3.929 0.032 H4w组 0.137±0.031 N组b
五、肺组织及肺动脉平滑肌细胞巢蛋白蛋白表达
肺组织中,N组巢蛋白的蛋白表达水平较低,低氧组蛋白表达较N组增加(P<0.01),且H4w组较H2w组上调巢蛋白蛋白表达(P<0.01),见图4。
肺动脉平滑肌细胞中,N组各时间段巢蛋白的蛋白表达水平虽较0 h组有所增加,但不明显(P均>0.05),平滑肌细胞在低氧培养12、24、36 h后巢蛋白蛋白表达较0 h组增加(t分别为3.068、12.271、26.077,P均<0.01),且较同一时间段的N组增加(t分别为3.158、7.896、20.529,P<0.01),见图5。肺动脉平滑肌细胞中的巢蛋白的蛋白含量,随着低氧培养的时间的增加而逐渐增高(r=0.991,P<0.01)。
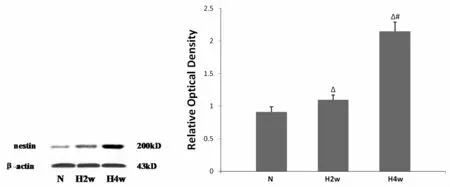
图4 各组肺组织巢蛋白的蛋白表达变化

图5 各组肺动脉平滑肌细胞巢蛋白的蛋白表达变化
讨 论
肺动脉高压是由肺血管收缩、肺血管重建以及原位血栓形成共同引起。低氧导致肺血管平滑肌细胞表型改变,并从中膜迁移至内膜大量增殖,使肺动脉中膜增厚,血管内腔变窄,在肺血管重建中发挥重要作用[2]。本研究显示,随着低氧时间的增加,大鼠mPAP、RV/(LV+S)及PAMT逐渐增加,苏木素-伊红染色后可见低氧导致肺动脉中膜平滑肌层细胞增生肥大,管腔明显狭窄。
巢蛋白为第Ⅵ类中间丝蛋白,首先于1985年,Hockfield和Mckay在胚胎大鼠脊髓组织提取物中作为制备单克隆抗体Rat-401的抗原时被发现,其可通过连接微丝和微管参与细胞骨架的形成。
Suguta等[3]在不稳定心绞痛患者的冠脉斑块星状平滑肌细胞中检测到大量的巢蛋白,提示巢蛋白在冠状动脉粥样斑块的形成过程中起着关键作用。Oikawa等[4]发现巢蛋白在处于生长发育中的动脉中表达,但当动脉发育成熟后巢蛋白即消失,且呈时间部位依赖性,但在球囊损伤后的颈动脉新内膜重新出现,提示在血管重构时巢蛋白可能起到重要作用。亦有研究发现缺氧可刺激鼠胚软骨组织巢蛋白的表达[5]。巢蛋白在肺内研究鲜少,仅有少许报道在人体的胎肺及成人肺支气管细胞中检测到巢蛋白的表达[6]。本实验通过免疫组织化学染色检查可见,在正常肺组织动脉中仅见少许巢蛋白表达,慢性低氧大鼠肺细小动脉巢蛋白的表达显著高于N组,且较长低氧培养比短时间低氧表达有所增高。
本实验同时采用了逆转录PCR和蛋白印迹分析肺组织巢蛋白的表达水平探讨巢蛋白与肺动脉高压的关系,结果发现正常大鼠肺组织中巢蛋白mRNA及蛋白表达水平均很低,而低氧各组巢蛋白的mRNA及蛋白表达水平均高于N组。
有文献报道,离体培养的主动脉平滑肌细胞在血清刺激下通过依赖表皮生长因子触发的细胞外调节蛋白激酶途径可重新大量表达巢蛋白,可能与其细胞表型的改变有关[4,7-8]。Sakairi等[9]用低氧干预离体培养的LLC-PK1细胞后,发现伴随着细胞表型的改变,低氧诱导细胞巢蛋白蛋白表达增加。本研究通过低氧干预培养的离体大鼠肺动脉平滑肌细胞,采用蛋白印迹分析各组细胞巢蛋白的蛋白表达水平,发现在细胞培养相同时间时,低氧在蛋白水平上调了巢蛋白表达。
有研究用小片段RNAi技术在抗Thy1肾炎小鼠模型中,沉默巢蛋白表达,显著减弱因肾小球系膜损伤引起的肾小球系膜细胞增殖[10],提示巢蛋白可以促进细胞的增殖。Huang等[11]用RNA干扰技术抑制血管平滑肌细胞巢蛋白的表达,促进过氧化氢介导的血管平滑肌细胞凋亡,提示巢蛋白具有抗凋亡作用。结合本研究结果,提示慢性低氧可诱导大鼠肺动脉巢蛋白及其基因表达增高,与慢性肺动脉高压形成密切相关,但其具体作用机制尚待进一步研究探讨。
[1]Mokry J,Pudil R,Ehrmann J,et al.Re-expression of nestin in the myocardium of postinfarcted patients.Virchows Arch,2008,453:33-41.
[2]Stenmark KR,Fagan KA,Frid MG.Hypoxia-induced pulmonary vascular remodeling:cellular and molecular mechanisms.Circ Res,2006,99:675-691.
[3]Suguta M,Nakano A,Hoshino Y,et al.Nestin,a maker for multilineage potential of cells from human primary and restenotic coronary artery plaquesc.Int J Cardio,2007,121:53-56.
[4]Oikawa,H,Hayashi K,Maesawa C,et al.Expression profiles of nestin in vascular smooth muscle cells in vivo and in vitro.Exp Cell Res,2010,316:940-950.
[5]余鸿,吴雨岭,韩艺,等.缺氧条件下鼠胚软骨c-Fos和巢蛋白表达及当归的保护作用.中国临床康复,2006,10:111-113.
[6]Sabatini F,Petecchia L,Tavian M,et al.Human bronchial fibroblasts exhibit a mesenchymal stem cell phenotype and multilineage differentiating potentialities.Lab Invest,2005,85:962-971.
[7]Huang YL,Shi GY,Jiang MJ,et al.Epidermal growth factor up-regulates the expression of nestin through the Ras-Raf-ERK signaling axis in rat vascular smooth muscle cells.Biochem Biophys Res Commun,2008,377:361-366.
[8]Huang YL,Shi GY,Lee H,et al.Thrombin induces nestin expression via the transactivation of EGFR signalings in rat vascular smooth muscle cells.Cell Signal,2009,21:954-968.
[9]Sakairi T,Hiromura K,Yamashita S,et al.Nestin expression in the kidney with an obstructed ureter.Kidney Int,2007,72:307-318.
[10]Daniel C,Albrecht H,Lüdke A,et al.Nestin expression in repopulating mesangial cells promotes their proliferation.Lab Invest,2008,88(4):387-397.
[11]Huang YL,Wu CM,Shi GY,et al.Nestin serves as a prosurvival determinant that is linked to the cytoprotective effect of epidermal growth factor in rat vascular smooth muscle cells.J Biochem,2009,146:307-315.

