正交试验法优化苦豆子总生物碱的超声提取工艺
宁夏职业技术学院 宁夏中药材开发与利用工程技术研究中心,宁夏 银川 750021
正交试验法优化苦豆子总生物碱的超声提取工艺
李军郝彩琴马小兰王海霞王建建冷晓红
宁夏职业技术学院 宁夏中药材开发与利用工程技术研究中心,宁夏 银川 750021
目的优选苦豆子中总生物碱的超声提取工艺。方法以总生物碱提取率为指标,采用单因素和正交试验考察料液比、超声温度、乙醇浓度、超声时间、提取次数对提取工艺的影响,确定最佳提取工艺。结果各因素对超声提取工艺的影响顺序为超声温度>料液比>超声时间>乙醇浓度; 最佳提取工艺为用65%乙醇,按料液比1:16,温度30℃,超声提取2次,每次20min。结论优选的提取工艺稳定可行,提取率高。
苦豆籽;总生物碱;正交试验;超声提取
苦豆子(SophoraalopecuroidesL. ) 是宁夏地区重要的药用植物资源,野生资源分布较广[1]。苦豆子药用部位为花期的干燥地上部分称“苦豆草”及成熟的种子称“苦豆籽”。含有苦参碱(Matrine)、氧化苦参碱(Oxymatrine)、槐果碱( Sophocarpine)、槐定碱( Sophridine)、苦豆碱(Aloperine)等20多种生物碱[2],其中以槐定碱的含量最高[3]。苦豆子总生物碱不仅具有抗癌、抑癌、抑制和杀灭各种微生物的药理活性,而且对免疫系统、神经系统、心血管系统有广泛的药理作用[4]。目前苦豆籽提取主要为超声波、回流提取苦参碱[5、6],以及微波法和传统方法提取总生物碱[7]。鉴于超声波在中药成分提取中可缩短提取时间,提高效率[8]。且以苦参碱为指标的提取不能完全反映总生物碱的提取率。因此,本研究以苦豆籽总生物碱的提取率为指标,通过超声波提取法进行单因素和正交试验对影响总生物碱提取率的因素进行优化,选出最佳的提取工艺条件,为苦豆籽中总生物碱的提取及其产业化生产提供实验依据。
1 仪器及试药
1.1 仪器 HT-600A型超声波仪(天津东康科技有限公司);TU-1810型紫外分光光度计(北京普析通用仪器有限公司);AE-240电子天平(上海梅特勒-托利多有限公司);DKB-8A 电热恒温水槽(上海精宏仪器设备有限公司);130-A 型高速粉碎机(长沙市中南制药机械厂)。
1.2 试药 苦豆籽药材(采于盐池县花马池镇),经鉴定为豆科槐属植物苦豆子(Sophora alopecuroides L.)种子;槐定碱标准品(批号:110784-200303,中国药品生物制品检定所)。其余试剂均为分析纯,水均为纯化水。
2 方法与结果
2.1 总生物碱含量测定
苦豆籽总生物碱含20多种化合物,以槐定碱的含量最高,参考相关文献[9]采用溴麝香草酚蓝比色法以槐定碱为指标成分测定苦豆籽总生物碱含量(λ=410nm)。
2.1.1 标准曲线的制作 精密称定槐定碱对照品5.01mg,置5ml容量瓶中,加无水乙醇溶解并稀释至刻度,摇匀即得槐定碱对照液。取上述溶液0、20、40、60、80、100、120、140μl,分别置于50 ml的磨口锥形瓶中,挥尽乙醇,加溴麝香草酚蓝pH=7.6缓冲液12ml、氯仿12ml,密塞剧烈振摇2min,静置2h后分出氯仿层,以同法处理无槐定碱对照液为空白,于410nm处测定提取液的吸光度[8],以吸光度为横坐标,氯仿层浓度为纵坐标得回归方程:A=0.0131C+0.0002,r=0.9999。
2.1.2 含量测定 分别吸取提取液1ml,稀释至10ml,吸取0.2ml至锥形瓶中,加入溴麝香草酚蓝pH =7.6缓冲液12ml,氯仿12ml,密塞振摇2min,静置2h,分取氯仿层,以一定浓度的乙醇0.2ml,溴麝香草酚蓝pH=7.6缓冲液12ml和氯仿12ml同比操作为空白,于410nm处测定提取液的吸光度,从制作的标准曲线中查得相应的生物碱浓度,并算出苦豆籽总生物碱的提取率。
2.1.3 精密度实验 取同一批次提取的苦豆籽提取液,按照“2.1.2”项的方法操作,平行测定6次吸光度值,6次测定结果的RSD为0.57%,说明仪器精密度良好。
2.1.4 稳定性实验 取同一批次提取的苦豆籽提取液,按“2.1.2”项的方法操作,每隔30min于410nm波长处测定吸光度,共测5次,5次结果的RSD 0.45%,表明样品溶液在120min 内测定稳定。
2.1.5 重复性实验 取同一批次提取的苦豆籽提取物,按“2.1.2”项的方法平行制备6份供试品溶液,并测定吸光度,6次测定结果的RSD为1.13%,说明方法重复性较好。
2.2 单因素试验
2.2.1 料液比 准确称取5份10.0g的苦豆籽粉,分别置于三角瓶中,加入80、120、160、200、240 ml 55%乙醇,浸泡1h,超声波处理20 min后,滤过,滤液作为提取液。按照“2.1.2”项的方法测定生物碱提取率。由图1可知,当溶剂用量达到1∶24 时,苦豆子中生物碱提取率最高,考虑工业化生产中料液比不宜过大。因此,选择1∶16、1∶20、1∶24作为正交试验的3个考察水平。
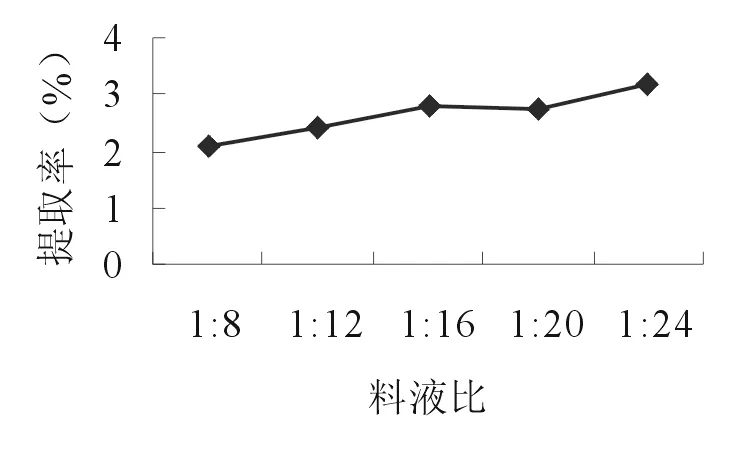
图1 料液比对提取率的影响
2.2.2 超声提取时间 准确称取5份10.0g的苦豆籽粉,分别置于三角瓶中,各加入160 ml 55%乙醇,浸泡1h,分别超声处理10、20、30、40、50min后,滤过,滤液作为提取液。按照“2.1.2”项的方法测定生物碱提取率。由如图2可知,在10~30min内,苦豆籽总生物碱的提取率随着超声时间基本保持不变,以后随着时间的延长,提取率有所下降。因此,选择10,20,30min 3个水平进行正交试验。
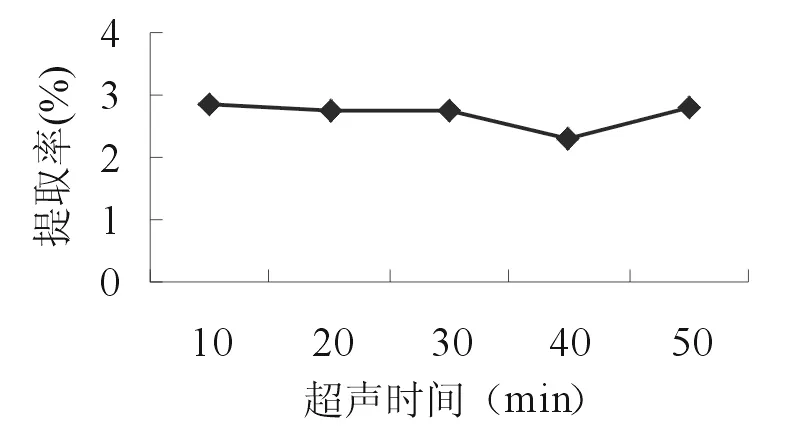
图2 超声提取时间对提取率的影响
2.2.3 超声提取次数 准确称取1份10.0g的苦豆籽粉,分别置于三角瓶中,各加入160 ml 55% 乙醇,浸泡1h,分别超声提取1次、2次、3次、4次、5次(每次超声20min)后,滤过,滤液作为提取液。按照“2.1.2”项的方法测定生物碱提取率。有图3可知,随着超声提取次数的增加,提取率逐渐降低,其中第3次超声提取的生物碱提取率只有0.09%,考虑生产成本和收率的关系,故选择超声提取2次。

图3 超声提取次数对提取率的影响
2.2.4 超声温度 准确称取4份10.0g的苦豆籽粉, 分别置于三角瓶中,各加入160 ml 55%乙醇,20、40、60、 80℃浸泡1h,分别在20、40、60、80℃超声20min后,滤过,滤渣继续超声1次,合并滤液作为提取液。按照“2.1.2”项的方法测定生物碱提取率。由图4可知,苦豆籽总生物碱的提取率在40℃时最高。因此,选择30、40、50℃ 3个水平进行正交试验。
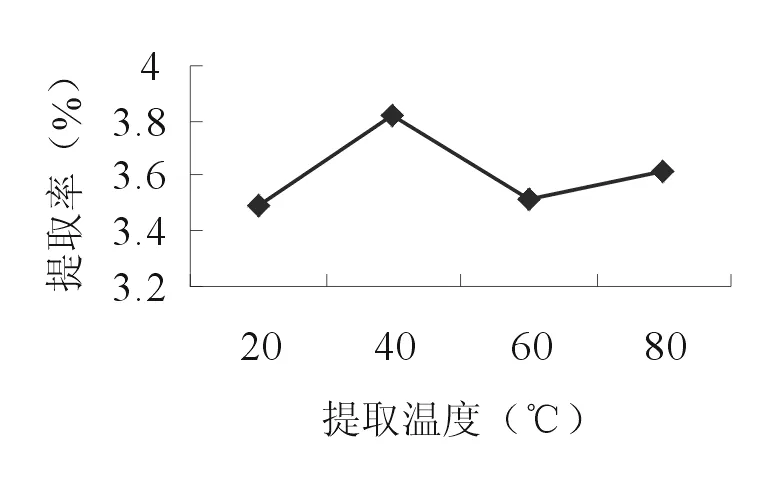
图4 超声温度对提取率的影响
2.2.5 溶剂浓度 准确称取4份10.0g的苦豆籽粉,分别置于三角瓶中,加入160 ml45、55、65、75%的乙醇,浸泡1h,超声处理2次,每次20min,合并滤液作为提取液。按照“2.1.2”的方法测定生物碱提取率。由图5可知,苦豆籽总生物碱的提取率随着溶剂浓度增加,提取率先增加后降低。因此,选择45、55、65% 3个水平进行正交试验。
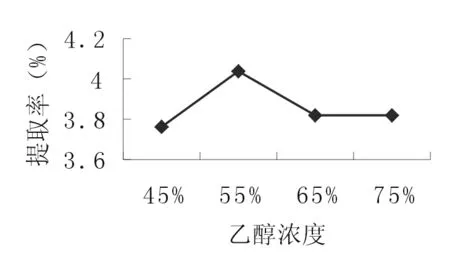
图5 溶剂浓度对提取率的影响
2.3 正交试验设计 准确称取9份苦豆籽粉,每份10.0g,以上述单因素试验结果为依据,确定溶剂浓度、料液比、超声时间、超声温度这四个因素做正交试验,采用L9 (34 ) 正交表(见表1)进行试验,确定最佳的提取条件。由表2可知,四个因素对提取率的影响主次顺序为B> A> D >C。由表3的方差分析可知,四个因素对苦豆籽总生物碱提取率无显著性影响,但温度对生物碱提取率的影响较重要,其他因素影响较小。综合考虑生产实际过程及正交实验结果,选择最佳的提取工艺条件是:A1B1C3D2,即用65%乙醇,按料液比1∶16,温度30℃,超声提取2次,每次20min。
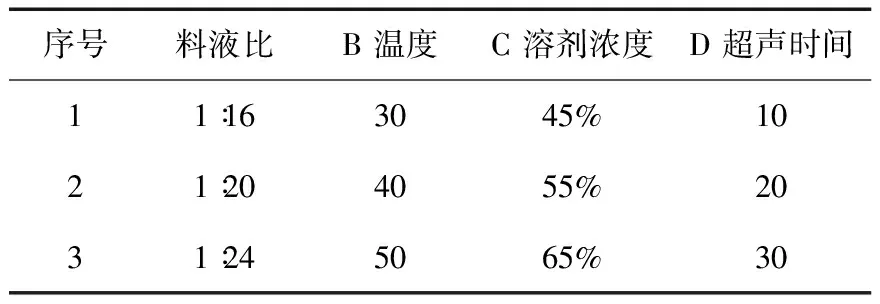
表1 正交试验因素水平表L9 (34)
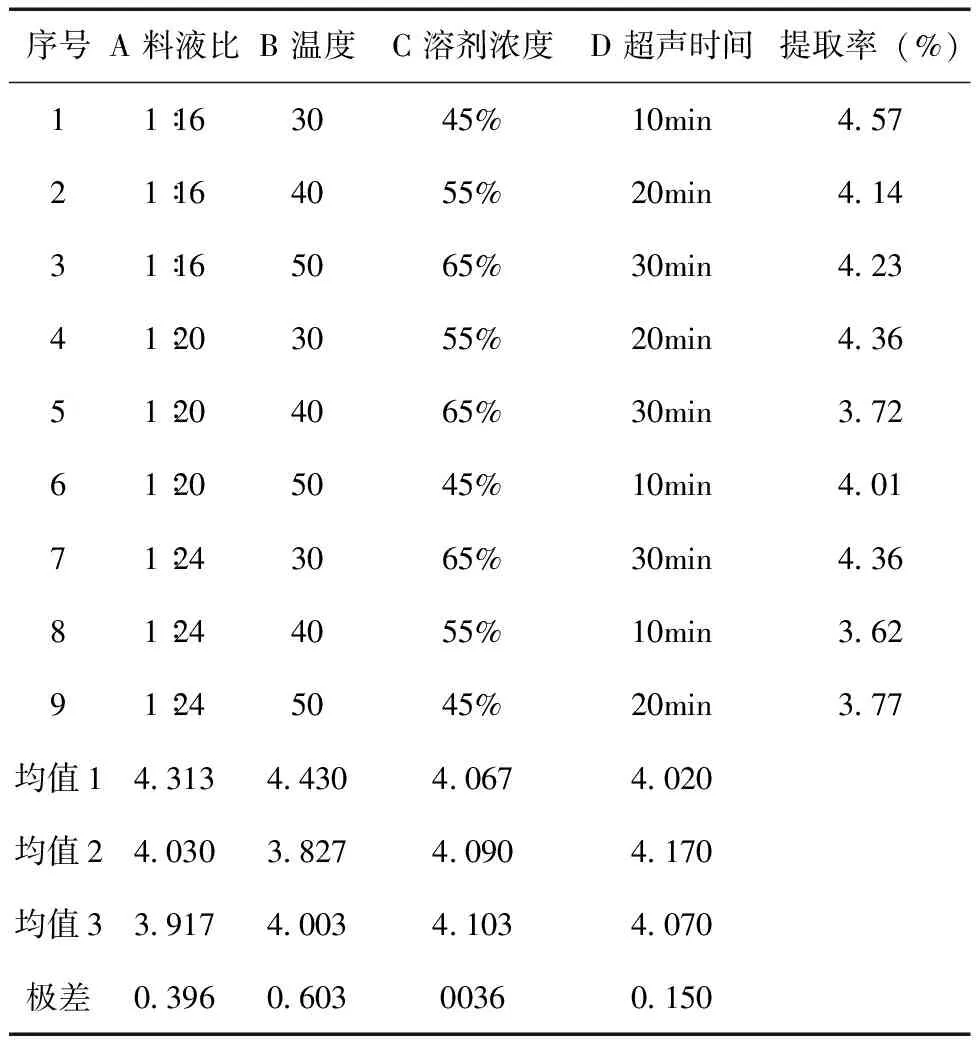
表2 正交试验结果
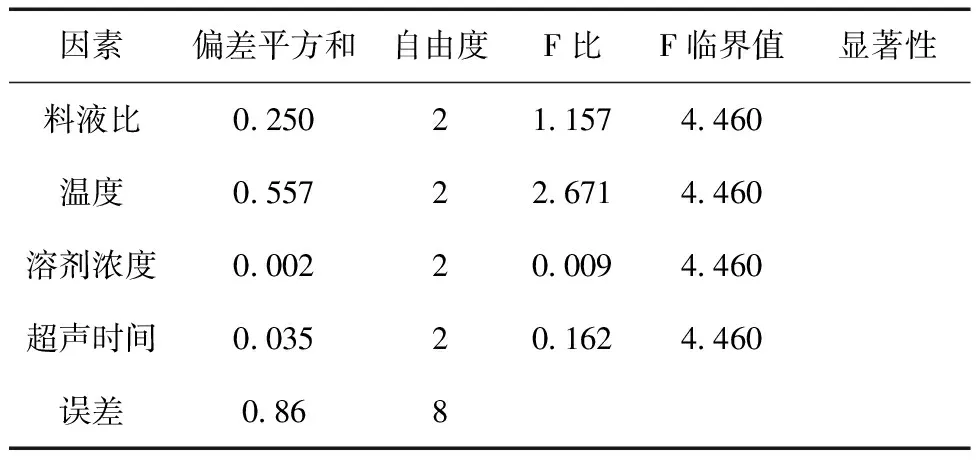
表3 方差分析表(α=0.05)
2.4 验证试验 准确称取3份10.0g的苦豆籽粉,分别置于三角瓶中,各加入160 ml 65% 乙醇,30℃浸泡1h,超声2次,每次20min,滤过,合并滤液作为提取液。按照“2.1.2”项的方法测定生物碱提取率。其提取率分别为4.55%、4.68%和4.59%,均值4.60%(RSD 1.45%),高于正交试验中的最高值,表明该工艺切实可行。
3 讨论
超声波提取法在中药成分提取中的应用越来越广,且用于生物碱的提取[10],且具有节约时间、节省成本、提取率高、纯度好等优点,对于能源消耗大、成本高、生产周期长的中药规模生产有一定的应用价值[11、12]。本试验以苦豆籽总生物碱的提取率为指标,采用超声提取苦豆籽总生物碱,可保证较高的提取效率且节约成本,为苦豆籽总生物碱的中试放大提供了工艺参数,为工业化生产提供了实验依据。
据报道,生物碱类成分的提取多用甲醇、乙醇等有机溶剂或1%左右的酸水(硫酸或醋酸)[13]。甲醇由于有毒,且不环保,工业生产中使用很少,而乙醇提取比酸水提取彻底,杂质少、提取时间短。故本试验选择乙醇作为溶剂进行超声提取。
试验选择了料液比、超声时间、超声提取次数、超声提取温度和溶剂浓度,尚有溶剂pH值、浸润时间、超声功率等因素可供选择。而在预实验中发现溶剂pH值、浸润时间和超声功率对苦豆籽总生物碱的提取率影响很小,因此后续的试验中只选择了试验的五个因素。其中超声提取次数经过单因素试验,超声提取第2次的提取率为0.42%,第3次的提取率仅有0.09%,故选择超声提取2次,未将其作为正交因素之一。正交试验结果表明,四个因素对苦豆籽总生物碱提取率无显著性影响,但温度对生物碱提取率的影响较重要,其他因素影响较小[14]。温度不宜过高,可能是温度太高会使生物碱的结构不稳定,发生分解,且温度太高,乙醇挥发严重,也会影响生物碱的提取[15]。另外,料液比对生物碱提取率的影响不大,可能是由于溶剂量的增大使其他成分的溶出率增大从而影响生物碱的溶出,导致提取率变化不大甚至下降[16]。正交试验为不完全组合性试验,对其优选出的最佳工艺要进行验证[17],工艺验证结果显示,优选的工艺合理、可行,可用于苦豆籽总生物碱的提取工艺。
[1] 张清云,杨朝霞,赵晓莉,等.宁夏苦豆子资源的保护及其开发利用[J].资源开发与市场, 2011,27(10): 897-899.
[2] 杨巧丽,顾政一,黄华.中药苦豆子的研究进展[J].西北药学杂志,2011,26(3): 232-236.
[3] 仲仁山.苦豆子研究及其应用[M].银川:宁夏人民出版社,983:5.
[4] 梁样红,刘颖男,陈光晓,等.苦豆子生物碱的提取方法[J].吉林医药学院学报,2008,29(3):168-170.
[5] 余永婷.超声波提取苦豆子生物碱的工艺研究[J].中国食品添加剂,2008,69(3):69-72.
[6] 张为民,蒲鹏,张德刚,等.从苦豆子种子中提取生物碱的方法研究[J].中国农学通报,2005,21(2):7-9.
[7] 李永春,叶新红,舒翔,等.微波法提取苦豆子生物碱的研究[J].中国食品添加剂.2008,19(5):73-76.
[8] 邱靖,陈永胜,穆莎茉莉,等.响应面分析法优化超声提取蓖麻碱工艺[J].天然产物研究与开发,2013,25(8):1124-1129.
[9] 李军,冷晓红,郝彩琴.苦豆草生物碱提取方法的研究[J].安徽农学通报,2010,16(17):47-48.
[10] 兰卫,陶宁,哈木拉提·吾甫尔.胡芦巴碱超声提取工艺研究[J],中草药,2012,43 (11):2200-2202.
[11] 欧小宏,王晓,杨雁,等.正交试验法优选三七皂苷成分超声提取工艺[J].中国现代中药,2012,14(4):48-52.
[12] 朱晓伟,陈建平,布仁,等.超声提取蒙药漏芦花中总皂苷工艺研究[J].中南药学,2013,11(11):812-814.
[13] 王绪英,向红,左经会,等.超声提取永思小檗盐酸小檗碱工艺的优化[J].南方农业学报,2012,43(4):502-505.
[14] 黄晓玲,郑兆广,封亮,等.正交试验优化板蓝根总生物碱的提取工艺[J].中国实验方剂学杂志,2013,19(9):66-68.
[15] 王玉玲,曾会明,张建秋,等.超声提取白刺中总生物碱及大孔树脂纯化的工艺研究[J].中南林业科技大学学报,2013,33(1):109-113.
[16] 杨丹丹,莫佳佳,陈林玲,等.超声提取款冬花中绿原酸的工艺研究[J].中华中医药学刊,2013,31(1):118-120.
[17] 梁洁,柳贤福,孙正伊,等.正交实验法优化龙眼叶提取工艺[J].中国民族民间医药,2013,22(1):22-25.
OptimizationofUltrasonicExtractionProcessforTotalAlkaloidsfromSophoraAlopecuroidesL.byOrthogonalTest
Li Jun Hao Cai-qin Ma Xiao-lan Wang Hai-xia Leng Xiao-hong
Ningxia Collage of Vocation and Technology,Ningxia Engineering Technology Research Center of Chinese Herbs Development and Utilization, Yinchuan 750021,China
ObjectiveTo optimize ultrasonic extraction process of total alkaloids from Sophora Alopecuroides L..MethodWith extraction rate of total alkaloids as index,effects of liquid-solid ratio,ultrasonic temperature, ethanol concentration,ultrasonic time, extraction times on extraction process were investigated by single factor test and orthogonal test.ResultThe influencing order of each factors on ultrasonic extraction process of total alkaloids was ultrasonic temperature>liquid-solid ratio>extraction time>ethanol concentration. Optimum extraction process was as following: ultrasonic extracted 2 times with 16 times the amount of 65% ethanol, 20 min one time, ultrasonic temperature 30℃.ConclusionsThis optimized process was stable and feasible with high extraction rate.
Sophora Alopecuroides L.,Total alkaloids, Orthogonal design, Ultrasonic extraction
R284.2
A
1007-8517(2014)08-0024-03
2014.02.10)

