白藜芦醇预防性给药对胃癌大鼠血清PG及相关细胞因子水平的影响
吴异兰 郑国华 庞书勤,李绵利,张琪
(福建中医药大学护理学院, 福建 福州 350122) (福建中医药大学中西医结合研究院,福建 福州 350122) (福建中医药大学护理学院, 福建 福州 350122)
白藜芦醇(resveratrol,Res),化学名称为反式-3,4,5-三羟基-1,2-二苯乙烯(亦称芪三酚),是葡萄属植物产生的一种植物抗毒素。白藜芦醇的生物活性作用不但包括抗氧化、抗炎、抗病毒、抑制血小板聚集、调节血脂,而且还具有一定的抗肿瘤作用[1-4]。课题组对白藜芦醇的前期体外研究发现其能够抑制胃癌细胞株的增殖并诱导凋亡[5-6];前期体内研究通过对N-甲基-N’-硝基-N-亚硝基胍(MNNG)等多因素染毒大鼠的死亡率、肿瘤发生率及胃体解剖组织学等指标的观察和分析,发现白藜芦醇还可有效提高大鼠对MNNG 等诱癌因素的耐受能力, 具有一定的预防作用[7]。在此基础上,观察白藜芦醇预防性给药对胃癌大鼠血清PG及相关细胞因子水平的影响,探讨其预防作用的可能机制。
1 材料与方法
1.1 实验动物与药品
雄性Wistar大鼠(上海斯莱克实验动物有限责任公司,质量许可证号:SCXK沪2007-0005)的饲养在福建中医药研究院动物实验中心进行。白藜芦醇购自西安赛德公司(98%,HPLC)。MNNG(5g/瓶,日本TCI)实验前用甲醇助溶后用去离子水配成1g/L的储备液(每周一配),4℃冰箱保存并避光,每天临用时稀释为100mg/L。大鼠胃蛋白酶原(pepsinogens,PG)、肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、缺氧诱导因子-1 (hypoxia inducible factor-1, HIF-1)酶联免疫检测试剂盒均购自美国R&D.
1.2 动物分组、染毒及给药方法
雄性Wistar大鼠95只,体质量90~100g,4周龄。随机数字表法分为5组:其中模型组25只以MNNG染毒,具体染毒方法、动物分组及给药方法同文献[7];空白对照组10只普通饲料喂养;白藜芦醇低剂量组(50mg/kg)、中剂量组(100mg/kg)和高剂量组(150mg/kg)各20只,染毒方法同模型组,选用在高盐饲料基础上加入不同剂量白藜芦醇配成的低、中、高浓度白藜芦醇饲料进行喂养,自由进食。30周后模型组和白藜芦醇各用药组均改为空白对照组喂养方式至38周实验结束。
1.3 大鼠血清PG及TNF-α、HIF-1水平检测
采用酶联免疫吸附法(ELISA)检测大鼠血清PG及TNF-α、HIF-1水平。实验结束前大鼠禁水12h、禁食24h。乙醚麻醉后剖腹,采腹动脉血,离心取血清。按照ELISA试剂盒说明书进行操作。分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准品孔和待测样品孔。标准品孔和样品孔首先分别加入稀释好的标准品和样品(离心后的血清),37℃反应30min。弃去液体,充分洗涤5次后加入酶标试剂,37℃反应30min。弃去液体,充分洗涤5次后加入显色液A、B,37℃显色10min后加入终止液。15min内在酶标仪波长450nm处测出OD值。所有OD值减除空白值后进行计算,以不同浓度的标准品OD值作出标准曲线,据每个待测样本的OD值在标准曲线上查得样品PG及TNF-α、HIF-1浓度。
1.4 统计学分析
所有数据用SPSS 13.0统计软件进行处理,多组间均数比较采用单因素方差分析后用SNK-q检验进行两两比较。P<0.05表明差异有统计学意义。
2 结果
2.1 各组大鼠血清PG水平
ELISA检测大鼠血清PG水平的结果见图1。

图1 ELISA检测大鼠血清PG水平结果
2.2 各组大鼠血清TNF-α水平
ELISA检测大鼠血清TNF-α水平的结果见图2。
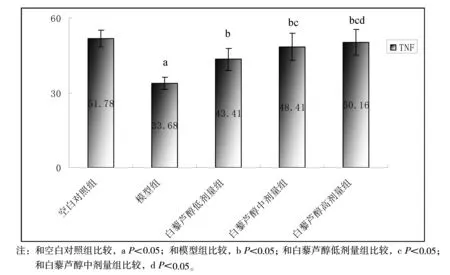
图2 ELISA检测大鼠血清TNF水平结果
2.3 各组大鼠血清HIF-1水平
ELISA检测大鼠血清HIF-1水平的结果见图3。
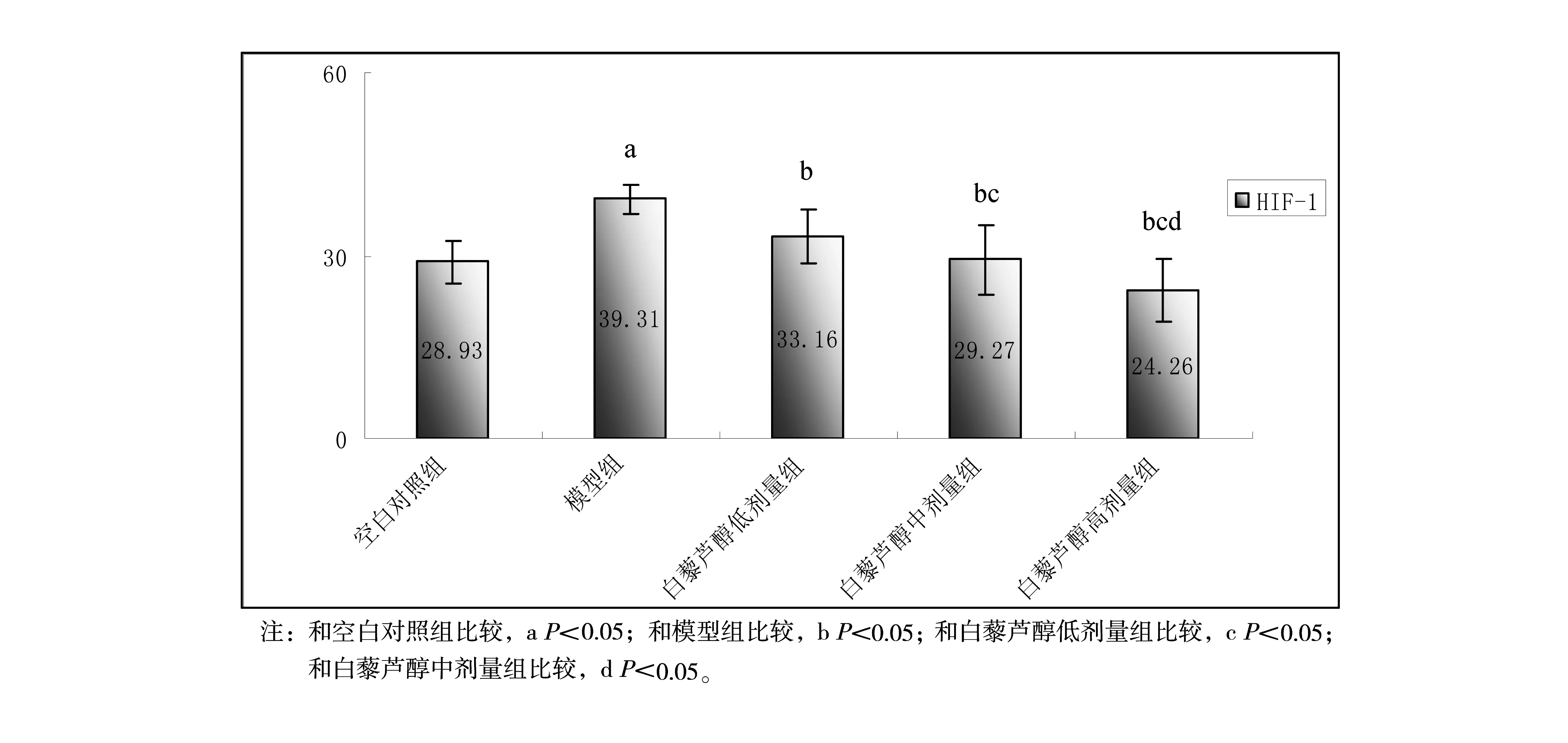
图3 ELISA检测大鼠血清HIF-1水平结果
3 讨论
PG是胃蛋白酶的前体,分为PGI、PGⅡ两个亚群。大部分酶原进入胃腔,经酸解成具有活性的胃蛋白酶发挥其消化蛋白质的作用。但也有少量透过胃黏膜毛细血管进入血液,故PG可从血清中检测。血清PG水平是反映胃黏膜形态和功能的良好指标。当胃粘膜发生病变时,血清中PG的含量也随之发生改变。PG作为一种新的肿瘤标志物,对于胃癌的早期诊断和筛选,以及胃癌术后复发与转移的检测都有重要的意义[8]。且幽门螺杆菌抗体与PG的浓度有很强的关联性[9]。本研究中ELISA结果提示模型组大鼠血清PG值明显低于空白对照组,而白藜芦醇的预防用药组的PG值与模型组相比有明显增高,并有一定的浓度依赖性,提示了白藜芦醇对胃部肿瘤的预防作用可能与其抗幽门螺杆菌的相关机制有所类似,有待进一步验证。
TNF-α主要由活化的单核一巨噬细胞产生,NK细胞、T细胞、B细胞、内皮细胞、成纤维细胞、表皮细胞、角质细胞、平滑肌细胞、星型细胞、成骨细胞等亦可产生。本研究ELISA结果显示,白藜芦醇给药组与模型组比较TNF-α值明显上升,提示白藜芦醇可能通过调节炎症因子TNF-α抑制p38 MAPK、NF-ΚB这两条炎症通路达到抗炎效果[10]。
由于肿瘤细胞生长迅速,肿瘤的部分细胞处于缺氧甚至无氧状态。HIF-1在细胞适应缺氧环境的各条信号传导通路中起到了核心作用,它可以促进肿瘤细胞在缺氧条件下的生长、迁移。本实验中,白藜芦醇给药组与模型组比较HIF-1值明显下降,并呈现一定的浓度依赖性,提示白藜芦醇具有抑制HIF-1的作用,白藜芦醇可能在HIF-1mRNA转录后通过各种信号通路增强其降解,阻碍其蛋白翻译。另有研究表明白藜芦醇可能通过对抗LPA(1ysophosphatidic acid)缺氧条件下引起的HIF-1和VEGF水平升高,从而抑制了LPA相关的肿瘤侵袭和转移[11]。自藜芦醇还可能通过多种机制抑制乳腺癌细胞的糖代谢,这种抑制作用与HIF-1被抑制的表象一致[12]。这些结果提示我们可以考虑以HIF-1为靶点对白藜芦醇对肿瘤的预防作用机制进行进一步的探讨。
[参考文献]
[1]Guerrero RF, Garcia-Parrilla MC, Puertas B, et al. Wine, resveratrol and health:a review[J]. Nat Prod Commun,2009, 4(5):635-658.
[2]Boscolo P, Del Signore A, Sabbioni E, et al. Effects of resveratrol on lymphocyte proliferation and cytokine release[J]. Ann Clin Lab Sci, 2003, 33(2):226-231.
[3]Athar M, Back JH, Kopelovich L, et al. Multipe molecular targets of resveratrol:Anti-carcinogenic mechanisms[J]. Arch Biochem Biophys,2009, 486(2):95-102.
[4]Kundu JK, Surh YJ. Cancer chemopreventive and therapeutic potential of resveratrol:mechanistic perspectives[J]. Cancer Lett,2008, 269(2):243-261.
[5]郑国华, 李会庆. 大蒜油和白藜芦醇联合应用对胃癌细胞抑制作用及其机制[J]. 福建中医学院学报,2006, 16(6):34-36.
[6]郑国华, 李颢, 李会庆. 大蒜油和白藜芦醇联合应用诱导胃癌细胞凋亡[J]. 中国公共卫生,2005, 2l(l0):1205-1207.
[7]郑国华,谌海英,吴华嵩.白藜芦醇对MNNG等多因素诱导大鼠胃部肿瘤的预防作用[J].中国自然医学杂志,2010,12(5):321-323.
[8]金妮,沈铭昌. 胃蛋白酶原在胃癌及癌前病变组织中的表达[J].中华病理学杂志,1991,20(2):84-86.
[9]Kikuchi S, Kurosawa M, Sakiyama T, et al. Long-term effert of Helicobacter pylori infection on serum pepsinogens[J]. Jpn J Cancer Res, 2000,9(5):471-476.
[10]Manna SK, Mukhopadhyay A, Aggarwal BB1 Resveratrol suppress TNF-2 induced activation of unclear transcription factors NF-Κb, activator protein-1 and apoptosis:potential role of reactive oxygen intermediates and lipid peroxidation [J]. Immunol, 2001,164(11):6509.
[11]Park SY,Jeong KJ,Lee J,et al.Hypoxia enhances LPA-induced HIF-1alpha and VEGF expression: their inhibition by resveratrol[J].Cancer Lett,2007,258:63-69.
[12] Kueck A,Opipari AW,Gdth KA,et al.Resveratrol inhibits glucose metabolism in human ovarian cancer cells[J].Gynecol Onco,2007, 107:450-457.

