Biglycan及血管内皮生长因子对结肠癌细胞迁移、侵袭能力的影响及机制
邢晓静 谷小虎 马天飞
(辽宁省肿瘤医院肿瘤防治办公室,*胃肠外科,辽宁沈阳 110042)
结肠癌是全球常见的恶性肿瘤。在欧美国家,结肠癌的致死率位居恶性肿瘤的第2位,结肠癌的发病率在我国呈现逐年上升趋势[1-2]。biglycan是富含亮氨酸的小分子蛋白聚糖家族(small leucine-rich proteoglycans,SLRPs)的成员,也是细胞外基质(extracellular matrix,ECM)的组成部分[3]。近年来的研究[4-7]表明,biglycan基因在多种肿瘤组织中高表达,例如肝癌、卵巢癌、牙源性腺样癌。我们的前期研究[6]表明,biglycan在结肠癌中高表达,且与结肠癌的低分化、淋巴结转移和远处转移正相关。淋巴结转移和血行转移是肿瘤的主要转移途径,新生血管的形成又是肿瘤血行转移的基础,血管内皮生长因子(vascular endothelial growth factor,VEGF)在多种血管生长因子中起中心调控作用。本研究在结肠癌细胞系HCT116中转染biglycan cDNA和VEGF siRNA,企图从迁移、侵袭方面探讨biglycan及VEGF对结肠癌细胞的影响及机制,以期为治疗结肠癌提供依据。
1 资料与方法
1.1 细胞株与试剂 结肠癌细胞系HCT116购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,VEGF siRNA购自上海吉玛制药技术有限公司,转染试剂Lipofectamine 2000购自美国Invitrogen公司,Snail、E-钙黏蛋白(E-cadherin)、波形蛋白(vimentin)、基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)抗体及辣根过氧化物酶标记的山羊抗兔IgG购自辽宁省沈阳万类生物科技有限公司;DMEM培养基购自美国Invitrogen公司,胎牛血清购自美国Hyclone公司,引物由生工生物(上海)有限公司合成,Matrigel胶购自美国BD公司,Transwell小室购自美国Corning公司。
1.2 细胞培养 将细胞接种于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的低糖DMEM培养液中,在37 ℃、CO2体积分数为5%、饱和湿度条件下培养。每2~3 d更换1次培养液,待细胞生长至80%~90%融合时进行传代。
1.3 实验分组和细胞转染 实验设置未转染对照组(mock组)、空载质粒和非特异性干扰片段转染组(vector+siRNA-NC组)、biglycan cDNA和非特异性干扰片段转染组(biglycan+siRNA-NC组)以及biglycan cDNA和VEGF siRNA共转染组(biglycan+siRNA-VEGF组)。本实验室前期已经成功构建biglycan稳定转染的HCT116细胞系。VEGF siRNA由上海吉玛制药技术有限公司设计并合成,反义链:5′-AAAGUAGUGCUUCACCACUUC-3′,正义链:5′-UCAUCACGAAGUGGUGAAGAA-3′,阴性对照由该公司配套提供。转染前24 h,将处于对数生长期的细胞用0.25%胰蛋白酶消化并接种于6孔培养板,之后按Lipofectamine 2000说明书操作,将siRNA-NC及siRNA-VEGF片段按实验分组转染至对应细胞中,干扰片段转染量为160 pmol/孔。
1.4 实时荧光定量逆转录聚合酶链反应(RT-PCR)法检测biglycan、VEGF mRNA的表达 采用Trizol法提取各组细胞的总RNA,按照cDNA第一链合成试剂盒说明书将mRNA反转录为cDNA。以β-actin为内参照,进行聚合酶链反应(polymerase chain reaction,PCR)反应。biglycan的上、下游引物序列为:5′-GGTCTCCAGCACCTCTACGCC-3′,5′-AACACTCCCTTGGGCACCTT-3′,扩增片段长度203 bp;VEGF的上、下游引物序列为:5′-CCTGAAATGAAGGAAGAGGAGACT-3′,5′-CTCGGTGATTTAGCAGCAAGA-3′,扩增片段长度105 bp;β-actin的上、下游引物序列为:5′-CTTAGTTGCGTTACACCCTTTCTTG-3′,5′-CTGTCACCTTCACCGTTCCAGTTT-3′,扩增片段长度为156 bp。参照2×Taq PCR Master Mix试剂盒说明书,在反应管中加入cDNA模板2 μL,上下游引物各1 μL,2×Taq PCR Master Mix 10 μL,最后加入双蒸水(double distilled water,ddH2O)补足总体积至20 μL。PCR反应条件为:95 ℃预变性5 min;95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸5 min。PCR反应结束后用1.5%琼脂糖凝胶进行电泳,应用凝胶成像系统将图片扫描入电脑并采用GelPro4.0软件对电泳结果进行灰度分析。
1.5 划痕实验检测迁移能力 取对数生长期的各组细胞,胰酶消化后接种于6孔板。待细胞完全贴壁后用200 μL灭菌枪头在6孔板底部单层细胞的中央划一道痕,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤细胞后在显微镜下摄影。加入细胞培养液后于37 ℃、CO2体积分数为5%的培养箱中培养24 h,观察细胞生长情况并用显微镜摄影,用Image-Pro Plus软件分别测量处理前后细胞划痕边界的距离,计算迁移率。
1.6 Transwell实验检测侵袭能力 将Matrigel胶4 ℃过夜以解冻,用无血清培养基将Matrigel胶在冰上按1∶2稀释。将Transwell小室放入24孔板中,用50 μL预先稀释好的Matrigel胶包被小室膜,在37 ℃培养箱中放置2 h,使Matrigel胶凝固。各组细胞经0.25%胰酶消化后稀释至密度为5×104个/mL的细胞悬液。将处理后的Transwell小室放入24孔板中,下室加入含20% FBS的培养液800 μL,上室加入细胞悬液200 μL,使细胞数达1×104个/孔,置于培养箱中培养24 h。取出Transwell小室,用PBS轻轻冲洗,用棉签擦去微孔膜上层细胞,在多聚甲醛中室温固定20 min,苏木素染液染色7 min,蒸馏水冲洗。在倒置显微镜下(200×)计数迁移至微孔膜下层的细胞。每个样本选取5个视野计数细胞个数,取均数。
1.7 蛋白质印迹(Western blotting)法检测SNAIL、E-cadherin、vimentin、MMP-2、MMP-9蛋白的表达 转染后48 h收获细胞,加入RIPA裂解液提取总蛋白质,采用BCA法测定蛋白质浓度。取40 μg总蛋白,经10%分离胶、5%浓缩胶的聚丙烯酰胺凝胶电泳后电转移至聚偏氟乙烯膜;用含5%脱脂奶粉的TBST封闭1 h,分别加入含SNAIL、E-cadherin、vimentin、MMP-2、MMP-9的一抗封闭液,置于4 ℃摇床,过夜;PBS洗膜后,加入辣根过氧化物酶标记的二抗,室温孵育1 h;将膜与电化学发光液静置反应5 min,转入暗盒中,在暗室进行曝光。独立实验重复3次。
1.8 明胶酶谱法检测MMP-2、MMP-9活性 转染后48 h收获细胞,提取总蛋白质,采用BCA法测定蛋白质浓度。加入非还原型电泳缓冲液后,用含有1%明胶底物的8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳2 h,用2.5% TritonX-100室温洗涤30 min,转移至底物消化缓冲液中,37 ℃过夜。固定2 h后,用考马斯亮蓝染色20 min,脱色直至出现清晰的条带,对电泳结果进行图像扫描分析。

2 结 果
2.1 biglycan、VEGF mRNA的表达 biglycan+siRNA-NC组和biglycan+siRNA-VEGF组biglycan mRNA的表达水平均显著高于mock组及vector+siRNA-NC组(P<0.05);biglycan+siRNA-NC组VEGF mRNA的表达水平显著高于mock组和vector+siRNA-NC组(P<0.05);biglycan+siRNA-VEGF组VEGF mRNA的表达水平显著低于biglycan+siRNA-NC组(P<0.05)。见图1。
2.2 迁移能力的检测结果 与mock组及vector+siRNA-NC组比较,biglycan+siRNA-NC组细胞明显从划痕边缘向划痕内迁移,细胞迁移能力显著提高,差异有统计学意义(P<0.05);biglycan+siRNA-VEGF组与biglycan+siRNA-NC组比较,细胞迁移能力显著下降(P<0.05)。见图2~3。
2.3 侵袭能力的检测结果 与mock组及vector+siRNA-NC组比较,biglycan+siRNA-NC组细胞侵袭能力显著提高(P<0.05);biglycan+siRNA-VEGF组与biglycan+siRNA-NC组比较,细胞侵袭能力明显下降(P<0.05)。见图4~5。
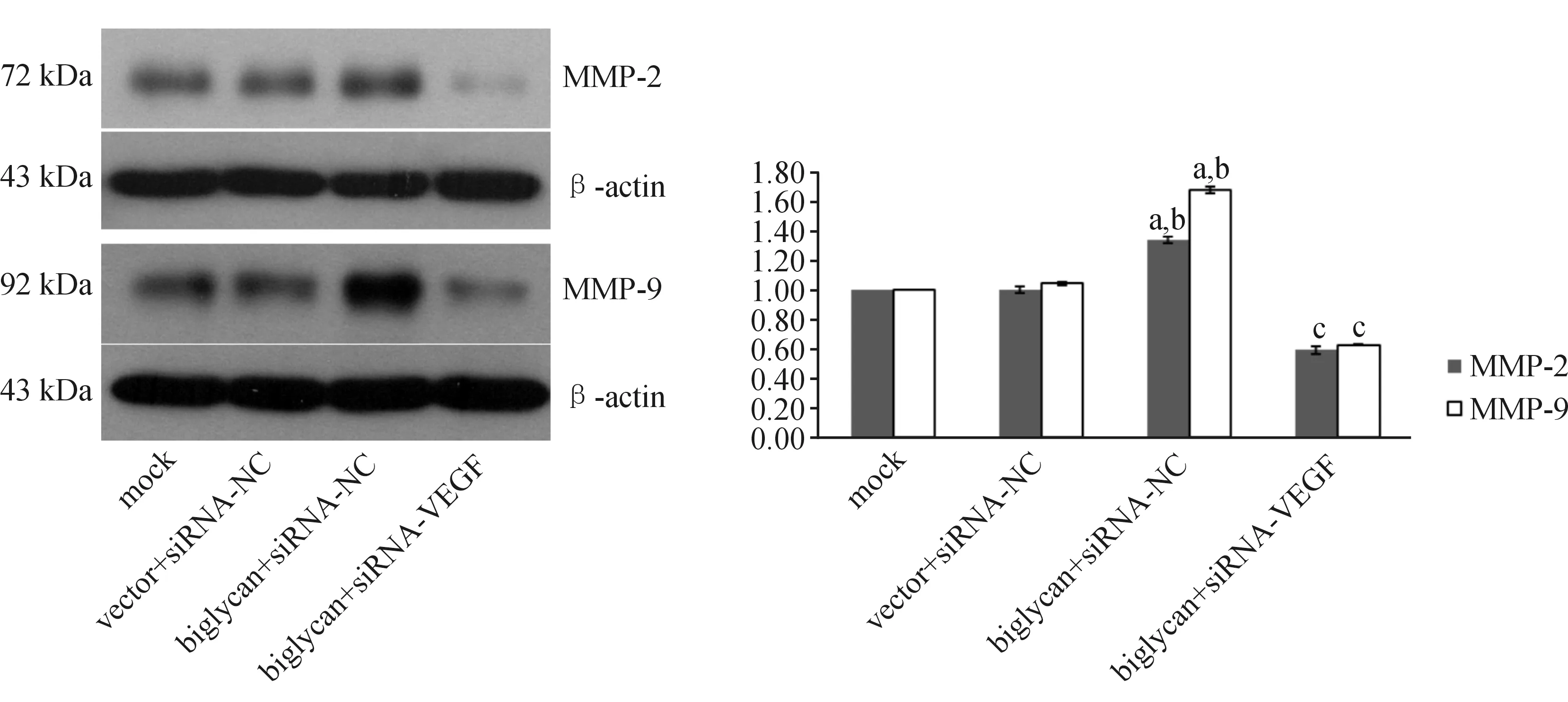
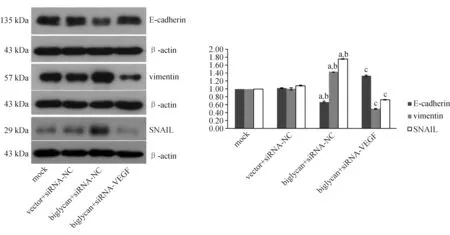
2.4 Western blotting法检测结果 与mock组和vector+siRNA-NC组比较,biglycan+siRNA-NC组MMP-2、MMP-9、vimentin、SNAIL蛋白的表达水平显著升高,E-cadherin蛋白的表达水平则显著降低(P<0.05);与biglycan+siRNA-NC组比较,biglycan+siRNA-VEGF组MMP-2、MMP-9、vimentin、SNAIL蛋白的表达水平显著降低,E-cadherin蛋白的表达水平则显著提高(P<0.05)。见图6~7。
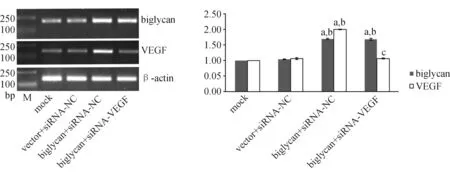
与mock组比较,aP<0.05;与vector+siRNA-NC组比较,bP<0.05;与biglycan+siRNA-NC组比较,cP<0.05

A、B、C、D分别为mock组、vector+siRNA-NC组、biglycan+siRNA-NC组、biglycan+siRNA-VEGF组划痕后0 h结果;a、b、c、d分别为相应组划痕后培养24 h结果
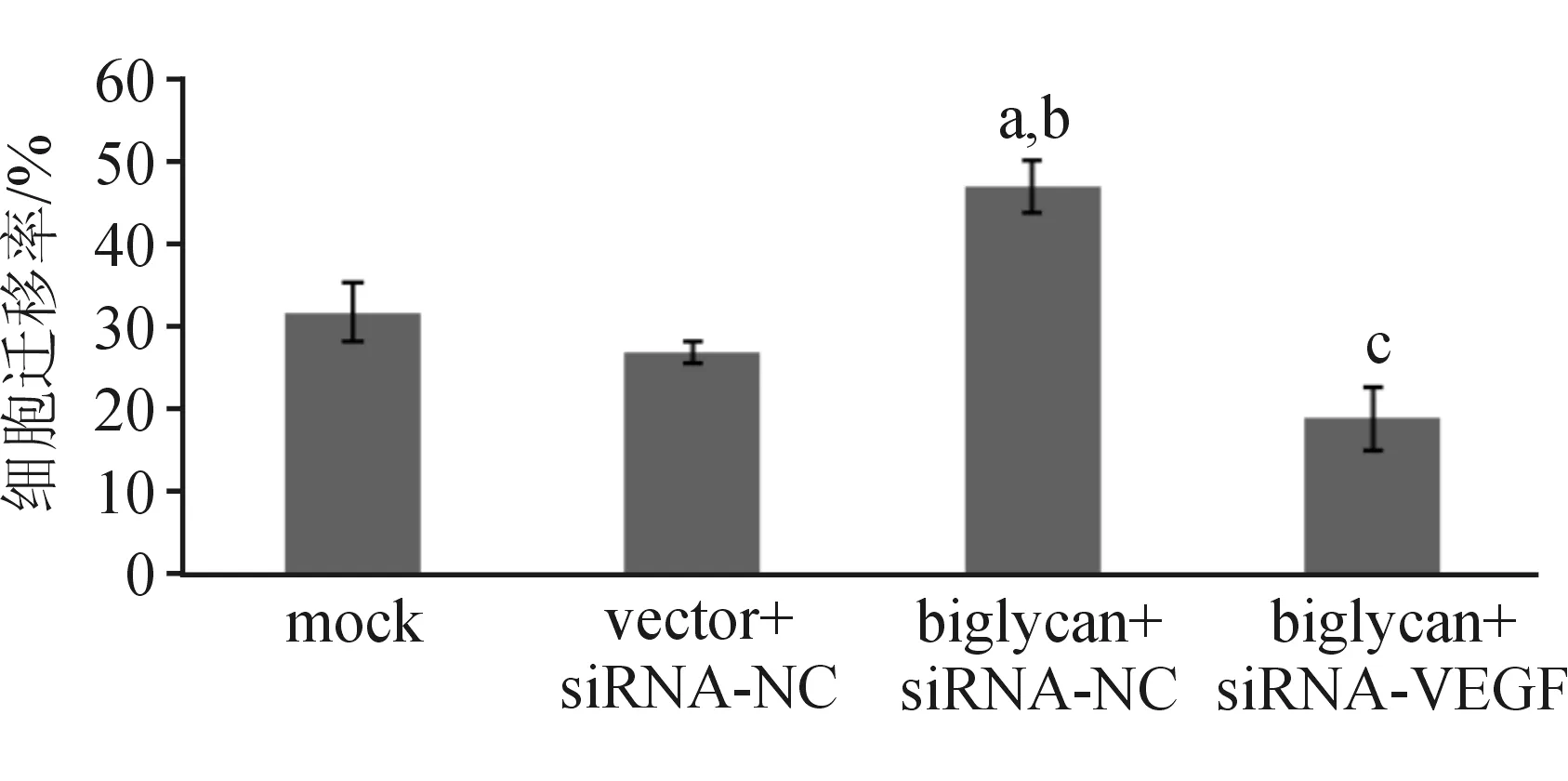
与mock组比较,aP<0.05;与vector+siRNA-NC组比较,bP<0.05;与biglycan+siRNA-NC组比较,cP<0.05
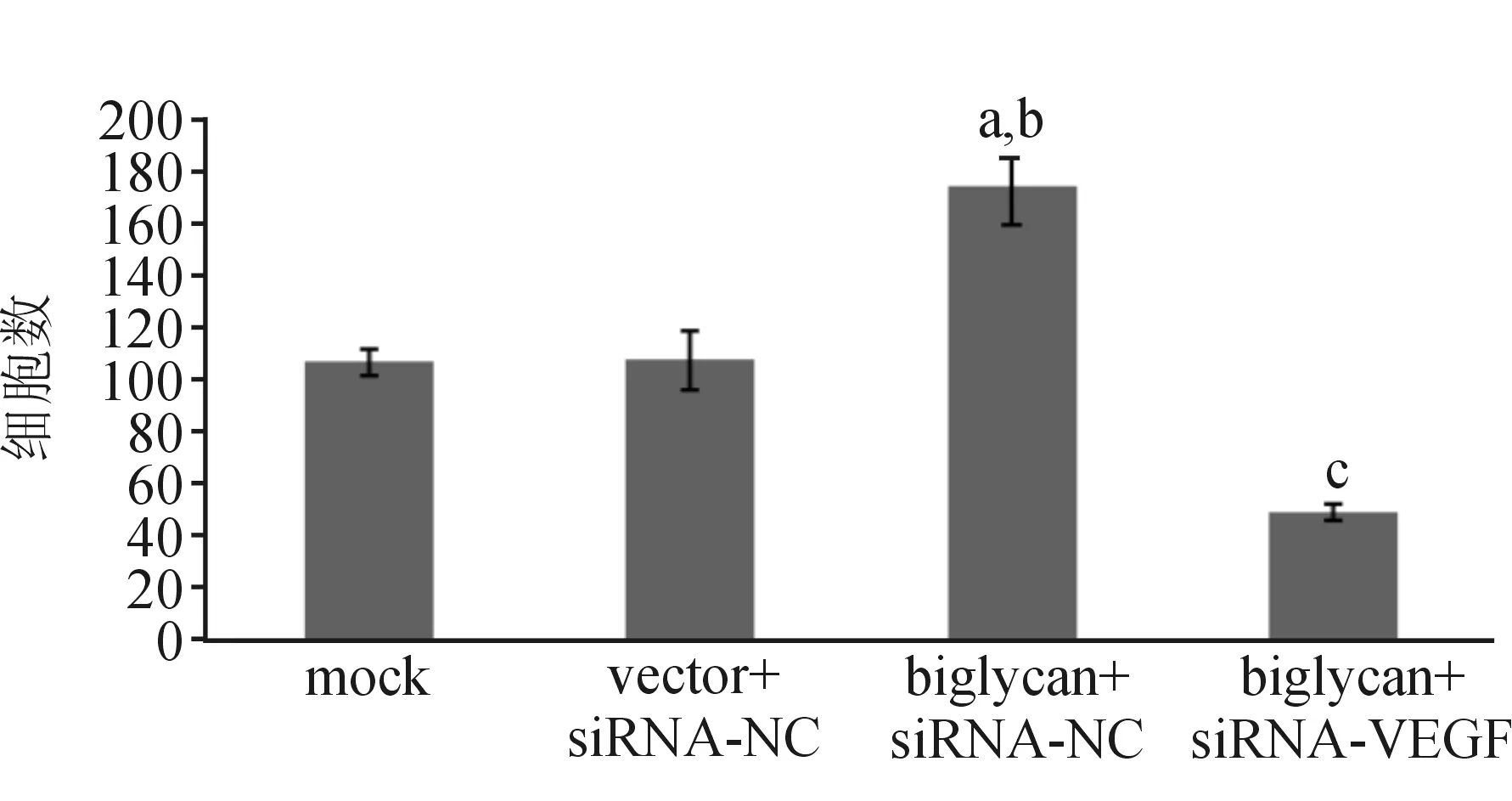
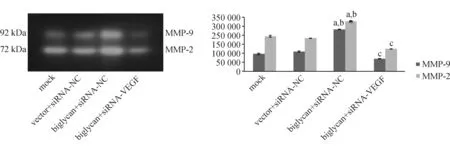
与mock组比较,aP<0.05;与vector+siRNA-NC组比较,bP<0.05;与biglycan+siRNA-NC组比较,cP<0.05
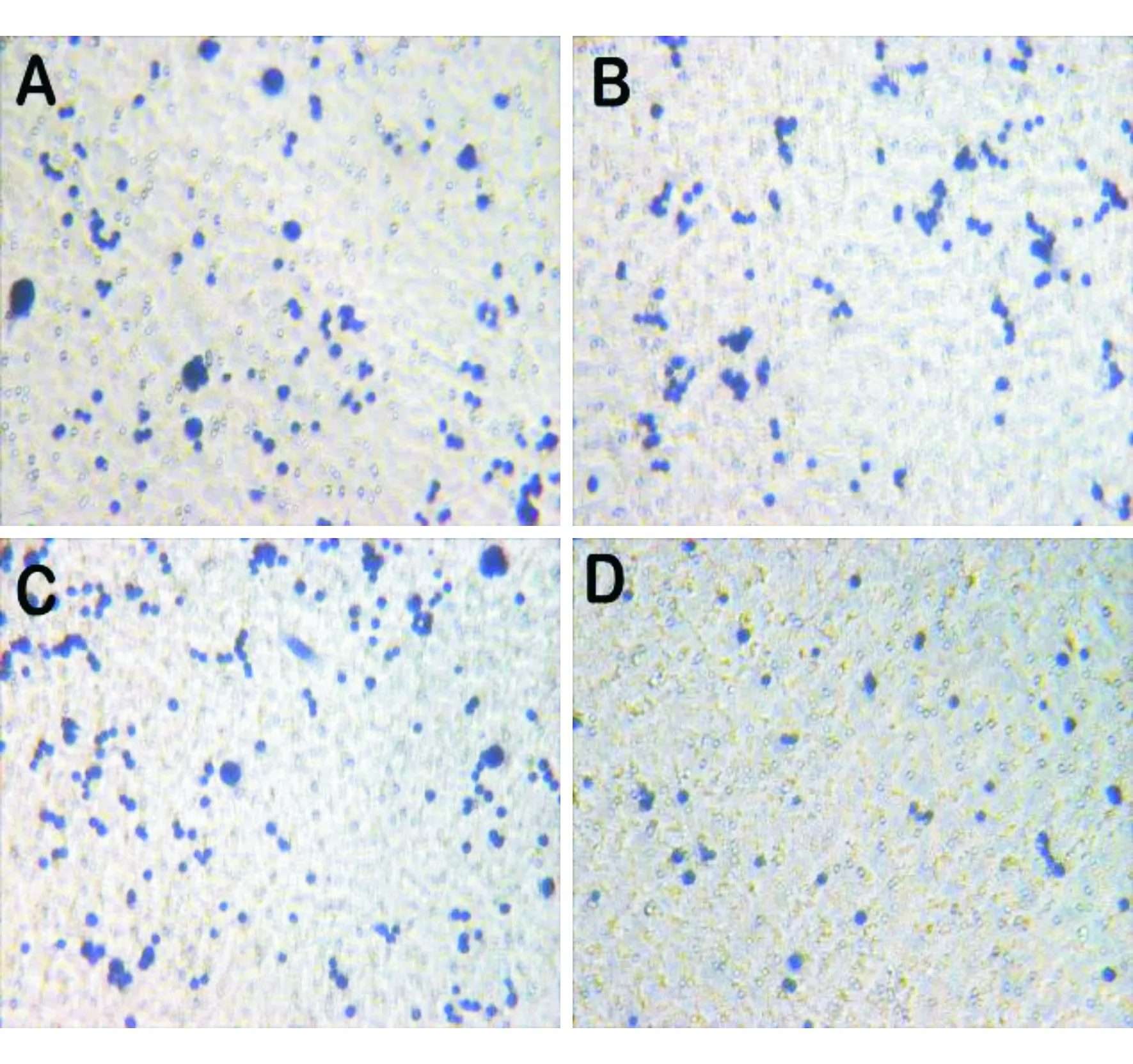
A、B、C、D分别为mock组、vector+siRNA-NC组、biglycan+siRNA-NC组、biglycan+siRNA-VEGF组
2.5 明胶酶谱法的检测结果 与mock组及vector+siRNA-NC组比较,biglycan+siRNA-NC组MMP-2及MMP-9的活性明显增加(P<0.05);而与biglycan+siRNA-NC组比较,biglycan+siRNA-VEGF组MMP-2及MMP-9的活性显著下降(P<0.05)。见图8。
与mock组比较,aP<0.05;与vector+siRNA-NC组比较,bP<0.05;与biglycan+siRNA-NC组比较,cP<0.05
与mock组比较,aP<0.05;与vector+siRNA-NC组比较,bP<0.05;与biglycan+siRNA-NC组比较,cP<0.05
与mock组比较,aP<0.05;与vector+siRNA-NC组比较,bP<0.05;与biglycan+siRNA-NC组比较,cP<0.05
3 讨 论
结肠癌术后肿瘤复发和转移是结肠癌病死的主要原因之一[8]。肿瘤细胞从原发部位脱落,侵入到ECM,通过基底膜细胞间质中的一些黏附分子激活基底膜细胞,并促使其合成和分泌各种降解酶;肿瘤细胞在这些酶的协助下进入血管,在某些因子作用下运行并穿过血管壁渗到继发部位,形成转移灶[9]。
biglycan是一种重要的ECM组成成分,是SLRPs家族成员之一。biglycan通过与转化生长因子-β(transforming growth factor-β,TGF-β)、胶原分子以及其他基质因子相结合,参与ECM的聚集、细胞迁移与细胞黏附[10]。研究[11-12]表明,biglycan与肿瘤的发生、发展有重要关系,已经成为多种肿瘤的标志物。biglycan在肿瘤的迁移、侵袭中也发挥重要作用。研究[13]显示,biglycan在肿瘤血管内皮中的表达水平高于正常组织,下调biglycan的表达可抑制细胞的迁移能力。研究[14]显示,过表达biglycan可提高胃癌细胞的血管侵袭能力,且biglycan高表达与淋巴结转移、肿瘤分期有关;biglycan高表达的患者肿瘤复发率高、生存期短。在本研究中,当过表达biglycan时,划痕实验和Transwell实验显示,结肠癌细胞HCT116的迁移和侵袭能力显著增强,与已有的研究[14]结果一致;当过表达biglycan的同时下调VEGF时,biglycan促进肿瘤迁移和侵袭的作用则受到抑制。
vimentin是间质细胞标志因子,它的过表达标志着上皮-间质转化的发生,即启动了肿瘤转移。E-cadherin是一类介导同种细胞互相黏附的钙依赖性跨膜糖蛋白,参与形成和维护正常细胞间的联结,是介导细胞间连接最重要的一类分子。SNAIL是E-cadherin的转录抑制子[15]。MMP-2和MMP-9在肿瘤细胞从肿瘤组织脱离及进入转移部位的过程中发挥重要作用,它们共同参与降解ECM大分子[16]。本研究中,当biglycan过表达时,VEGF的表达水平显著提高,介导细胞间连接的E-cadherin表达水平降低,而具有降解ECM作用的MMP-2、MMP-9、vimentin以及E-cadherin的转录抑制子SNAIL的表达水平均显著提高,MMP-2和MMP-9的活性显著升高。以上结果说明,biglycan的过表达能促进VEGF的表达并能增强HCT116细胞的迁移和侵袭。当biglycan过表达的同时,又干扰下调VEGF的表达时,上述与细胞迁移、侵袭相关的因子的表达水平均发生逆向的变化,MMP-2和MMP-9的活性也显著降低;这说明,干扰VEGF的表达可抑制biglycan对HCT116细胞迁移、侵袭的促进作用。
综上所述,biglycan通过促进VEGF的表达来促进结肠癌细胞HCT116的迁移和侵袭,下调VEGF的表达可逆转biglycan对HCT116细胞迁移和侵袭的促进作用。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2007[J].CA Cancer J Clin,2007,57(1):43-66.
[2]Nishino R,Honda M,Yamashita T,et al.Identification of novel candidate tumour marker genes for intrahepatic cholangiocarcinoma[J].J Hepatol,2008,49(2):207-216.
[3]Schaefer L,Iozzo RV.Biological functions of the small leucine-rich proteoglycans:from genetics to signal transduction[J].J Biol Chem,2008,283(31):21305-21309.
[4]Pan S,Cheng L,White JT,et al.Quantitative proteomics analysis integrated with microarray data reveals that extracellular matrix proteins,catenins,and p53 binding protein 1 are important for chemotherapy response in ovarian cancers[J].OMICS,2009,13(4):345-354.
[5]Modolo F,Biz MT,Martins MT,et al.Expression of extracellular matrix proteins in adenomatoid odontogenic tumor[J].J Oral Pathol Med,2010,39(3):230-235.
[6]Gu X,Ma Y,Xiao J,et al.Up-regulated biglycan expression correlates with the malignancy in human colorectal cancers[J].Clin Exp Med,2012,12(3):195-199.
[7]Allard D,Figg N,Bennett MR,et al.Akt regulates the survival of vascular smooth muscle cells via inhibition of FoxO3a and GSK3[J].J Biol Chem,2008,283(28):19739-19747.
[8]Shi H,Zhou Y,Liu H,et al.Expression of CIAPIN1 in human colorectal cancer and its correlation with prognosis[J].BMC Cancer,2010,10:477.
[9]Barkan D,Green JE,Chambers AF.Extracellular matrix:a gatekeeper in the transition from dormancy to metastatic growth[J].Eur J Cancer,2010,46(7):1181-1188.
[10]Hocking AM,Shinomura T,McQuillan DJ.Leucine-rich repeat glycoproteins of the extracellular matrix[J].Matrix Biol,1998,17(1):1-19.
[11]Bischof AG,Yüksel D,Mammoto T,et al.Breast cancer normalization induced by embryonic mesenchyme is mediated by extracellular matrix biglycan[J].Inteqr Biol(Camb),2013,5(8):1045-1056.
[12]Zhu YH,Yang F,Zhang SS,et al.High expression of biglycan is associated with poor prognosis in patients with esophageal squamous cell carcinoma[J].Int J Clin Exp Pathol,2013,6(11):2497-2505.
[13]Yamamoto K,Ohqa N,Hida Y,et al.Biglycan is a specific marker and an autocrine angiogenic factor of tumour endothelial cells[J].Br J Cancer,2012,106(6):1214-1223.
[14]Wang B,Li GX,Zhang SG,et al.Biglycan expression correlates with aggressiveness and poor prognosis of gastric cancer[J].Exp Bio Med(Maywood),2011,236(11):1247-1253.
[15]Becker KF,Rosivatz E,Blechschmidt K,et al.Analysis of the E-cadherin repressor Snail in primary human cancers[J].Cell Tissues Organs,2007,185(1-3):204-212.
[16]Buccione R,Caldieri G,Ayala I.Invadopodia:specialized tumor cell structures for the focal degradation of the ectracellular matrix[J].Cancer Metastasis Rev,2009,28(1-2):137-149.

