放大内镜窄带成像技术在结直肠早癌诊断中的应用进展
蔡世伦 钟芸诗
随着内镜检查的逐渐普及,原始的内镜系统已经不能满足当今各种疾病的诊断需要,因此许多改良内镜开始进入临床医生的视线,例如高清电子内镜、放大内镜、色素内镜、窄带成像内镜(narrow-bandimaging,NBI)、自体荧光内镜(autofluorescence imaging,AFI)及共聚焦激光显微内镜(confocal laser endomicroscopy,CLE)等,这些检查手段显著提高了消化道疾病的检出率,给临床诊断工作带来便利。
传统的消化道内镜采用氙灯作为光源,这种表现为白色的照明光其实由三种宽带光谱组成,由于光谱较宽,不同波长之间的光在组织的不同层面上反射,得到叠加图像为我们正常肉眼所见的组织图像。放大内镜窄带成像术(magnifying endoscopy with narrow-banding imaging,ME-NBI)通过窄带滤光片,将原始光分为605 nm的红光、540 nm的绿光和415 nm的蓝光,这三种光对组织的穿透率不同,红光可深达黏膜下层,用于显示黏膜下血管网,绿光则能较好地显示中间层的血管。由于血液对蓝、绿光吸收较强,因此在ME-NBI显像中血管表现为深色,黏膜表现为红色,这种显示方式增强了不同组织之间的对比度,同时放大内镜可将图像放大至最适合操作者观察的倍数,如此一来内镜医生就能对病灶进行更直观详细的观察。在消化道早癌的诊断方面,ME-NBI内镜的应用更为广泛,其能显示肿瘤性和非肿瘤性病变的表浅结构差异,有助于提高临床上微小病变及早期癌变的检出率[1]。
结直肠早癌指病变仅局限于黏膜或黏膜下层,无淋巴结转移或远处转移。原发灶的T分期可分为:Tis(高级别上皮内瘤变)与T1期(癌侵达黏膜下层)。病变的TNM分期为0期(TisNoMo)与Ⅰ期(T1NoMo)。目前国际上在结直肠早癌的ME-NBI分型上尚无统一的标准,主要的分型有下列几种:(1)结肠横向发育型肿瘤(LST);(2)结肠管状绒毛状腺瘤;(3)直肠上皮内瘤变高级别伴局灶癌变(图1)。
一、Hiroshima分型
Hiroshima分型[2-3]包括A、B、C1、C2和C3五型,分型内容同时包括黏膜的表面分型与微血管结构分型,黏膜表面的白色部分为黏膜分型的主要判断部位。A型特点是微血管结构模糊,表面黏膜正常,见于增生性结直肠息肉。B型常见于腺瘤,特征为清晰的或规律的表面腺体结构,绕腺管开口的微血管密度增加或形成规律的网状血管结构。C1型常见于黏膜内癌和表浅的黏膜下浸润癌,表现为不规律的黏膜形态,环绕腺管开口微血管的密度增加,血管管径及分布均一。C2型表现为不规律的黏膜形态,但出现比C1型更高的血管密度和不均一的血管管径及分布。C2型可见于黏膜内癌和较深的浸润癌,大约60%的C2型见于深层的黏膜下浸润癌[3]。C3型表现为不清晰或消失的黏膜形态,消失的微血管结构或者只存在分散的微血管碎片,C3型常见于深层的黏膜下侵润癌(图2)[4]。在Oba,s[3]的研究中,C1、C2、C3型的肿瘤黏膜下层侵润率分别为5.2%、60.5%与92.7%,可见根据C分型程度的逐渐升高,肿瘤的侵润范围逐渐加深,对治疗而言,内镜治疗无法完全切除时需采用外科手术治疗。

注:a图为结肠横向发育型肿瘤普通肠镜图像;b图为结肠横向发育型肿瘤NBI模式下图像;c图为结肠绒毛管状腺瘤普通肠镜图像;d图为结肠绒毛管状腺瘤NBI模式下图像;e图为直肠上皮内瘤变高级别伴局灶癌变普通肠镜图像;f图为直肠上皮内瘤变高级别伴局灶癌变NBI模式下图像
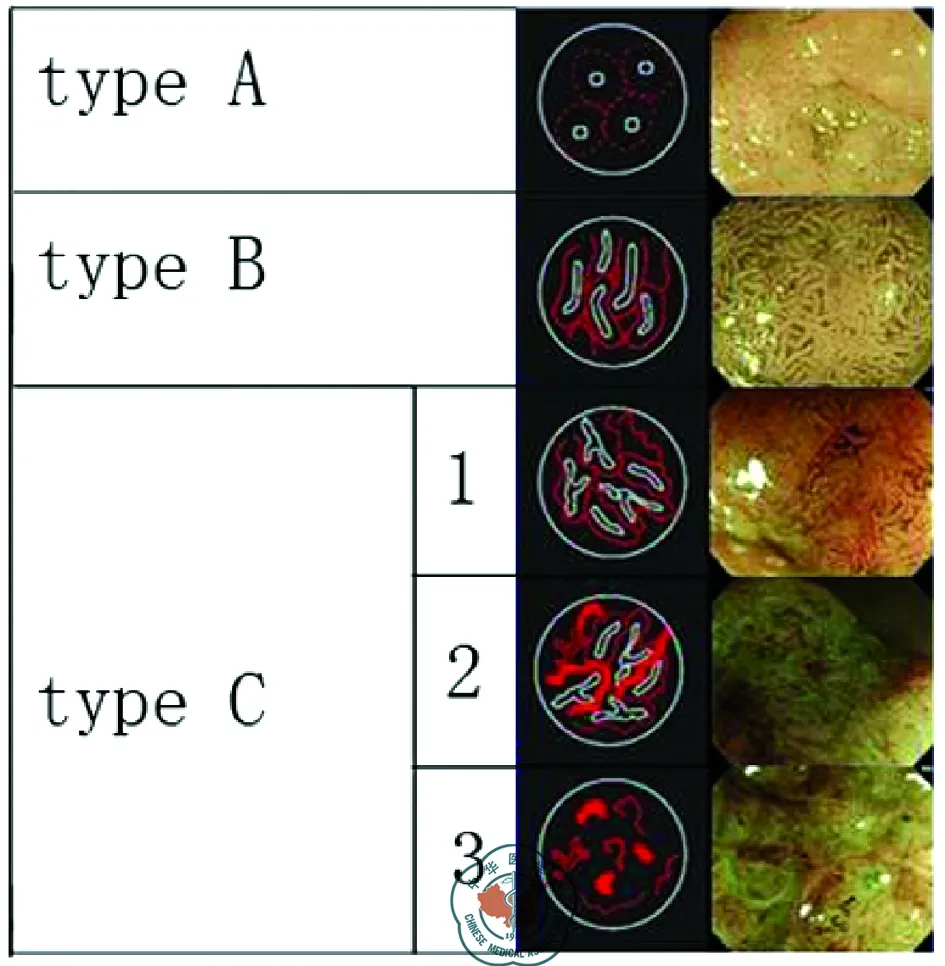
注:A型微血管结构模糊,表面黏膜正常;B型存在清晰的腺体结构,微血管密度增加;C1型不规律的黏膜形态,密度增加,血管管径及分布均一;C2型不规律的黏膜形态,比C1型更高的血管密度和不均一的血管管径及分布;C3型不清晰或消失的黏膜形态,消失的微血管结构或者只存在分散的微血管碎片
二、Sano分型
Sano分型[5]将病变表面微血管结构表现分为Ⅰ、Ⅱ、ⅢA和ⅢB四型。Ⅰ型表现为内镜下病灶中无可明确辨认的网状毛细血管,常见于增生性息肉;Ⅱ型特征为清晰的网状毛细血管包绕着黏膜腺体,常见于腺瘤;Ⅲ型常见于腺癌,特点是网状毛细血管出现盲端、分支和不规则的减少,其中Ⅲ型分为两个亚型,ⅢA型为微血管密度不均匀增高,ⅢB型表现为病灶中出现部分区域无血管或微血管密度疏松,常见于黏膜下层浸润癌(图3)。在预测肿瘤的侵润深度方面,Sano分型的Ⅲ型分类敏感度、特异度和总体精确度分别84.8%,88.7%和87.7%,有较高的实用价值。
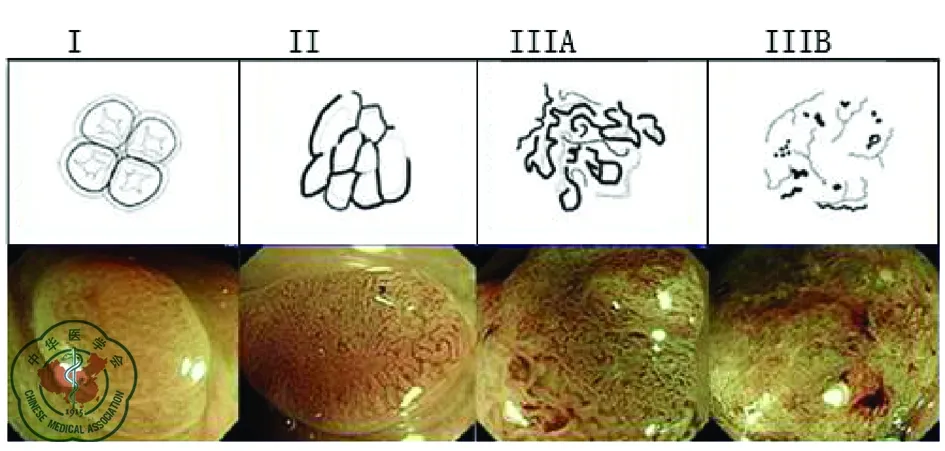
注:Ⅰ型病灶中无可明确辨认的网状毛细血管;Ⅱ型清晰的网状毛细血管包绕着黏膜腺体;Ⅲ型网状毛细血管出现盲端、分支和不规则的减少,其中ⅢA型为微血管密度不均匀增高,ⅢB型表现为病灶中出现部分区域无血管或微血管密度疏松
三、Showa分型
Showa分型[6]主要根据结直肠早癌的微血管特征进行分型,分为五型:正常、模糊、网状、密集、不规则和稀疏。模糊型表现为环绕腺体的微血管结构难以辨认,常见于增生性息肉。网状型表现为网状血管环绕腺体,结构均匀,常见于管状腺瘤和管状腺瘤合并黏膜内癌。密集型表现为增粗和密度增高的微血管,可见于绒毛状/管状绒毛状腺瘤和黏膜内癌,尤其是管状绒毛状腺瘤。不规则型表现为不规则的微血管管径增粗、高度扭曲和微血管网中断。稀疏型表现为由于微血管的高度破坏而散乱的微血管碎片及无血管区域。不规则型和稀疏型常提示肿瘤侵润程度较深,在治疗方案上应有别于其余三种类型。
四、Jikei分型
Jikei分型[7]根据病灶中微血管管径的增粗程度,分为1、2、3V、3I和4五型。1型表现为不可辨认的微血管结构;2型表现为微血管的管径轻度增粗;3型表现为微血管管径显著增粗,分为3V型3I型两个亚型:3V型为规律的微血管结构和绒毛状的腺管开口,3I型为不规律的微血管结构而没有观察到腺管开口;4型特征是稀疏甚至消失的微血管结构。其中3I型与4型提示病灶癌变可能性较高,此分型在预测侵润深度上较为局限。
五、NICE分型
NICE分型[8]由日本、美国、法国和英国内镜专家在内的国际组织共同制定,是目前覆盖面最广的分型。该分型通过病灶的三个部分来评定恶性程度:色泽、表面结构与血管结构,主要分为三型。其中NICE分型对良性与恶性病灶鉴别的准确率,敏感度以及阴性预测值分别为89%、98%与95%,Ⅱ型与Ⅲ型的预测准确度分别为84.3%与90.0%,其中Ⅲ型提示病灶为黏膜深层浸润癌,需要更加谨慎的临床处理。NICE分型以及其对应的其他分型方法的级别见表1。
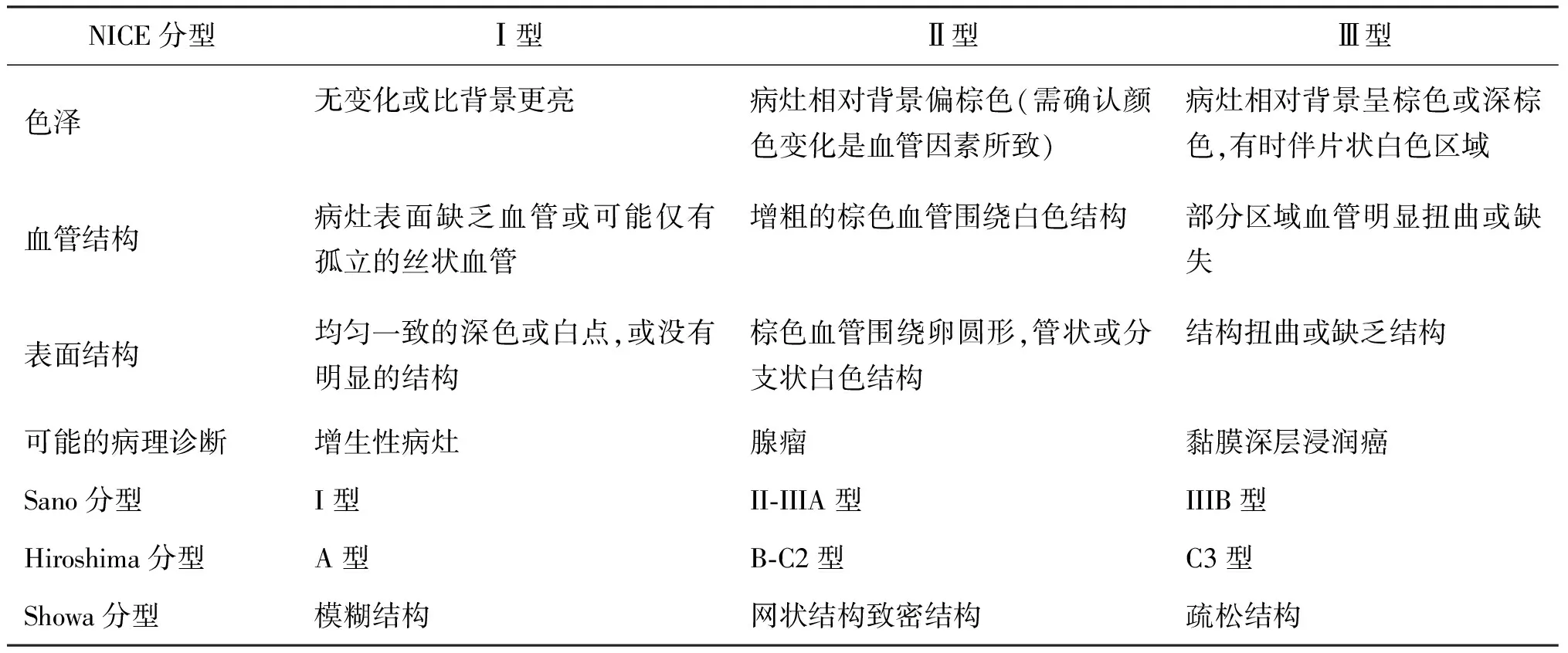
表1 NICE分型与其他分型对应方法表
目前,没有关于这些分类在鉴别结直肠良恶性病变以及判断早期结直肠癌浸润深度准确性中的对比研究,我们也很难客观的评判各种分类的优劣,因此统一结直肠早癌的ME-NBI分型有着十分重要的临床意义。纵然分型尚未有统一标准,但是M-NBI在结直肠早癌诊断中有其突出的优势。Sakamoto[9]纳入300例结直肠病灶,比较M-NBI与放大色素内镜在操作时间,以及对良恶性结直肠病变的鉴别能力上进行比较,结论为两者在敏感度,特异度以及准确性上没有显著差异,但M-NBI在操作时间上(中位时间:12s;95% CI 7-19s)明显短于色素放大内镜(17s,95% CI 12-24s;P<0.001)。Wu L[10]在2012年对11篇研究NBI在诊断结直肠肿瘤性病变进行Meta分析后得到结论:NBI技术对诊断结直肠肿瘤的敏感度,特异度分别为92%(95% CI 90%-93%)与83%(95% CI 81%-86%),其中,使用放大内镜时的敏感度,特异度为92%(95% CI 90%-94%)与81%(95% CI 78%-84%)。NBI对黏膜形态的敏感度与特异度为90%(95% CI 85%-94%)与88%(95% CI 82%-93%);对血管形态的敏感度与特异度为92%(95% CI 90%-94%)与88%(95% CI 83%-91%)。Takata[11]对224例息肉病变、133例颗粒型横向发育型肿瘤(LST-G)和140例非颗粒型横向发育型肿瘤(LST-NG)在ME-NBI下观察,有部分LST-NG的表面结构显示出息肉样病变的腺管开口表现,但病理结果为高分化腺瘤,同时几乎所有表面结构紊乱的LST-NG病理结果均为结直肠早癌。
综上所述,NBI放大内镜对结直肠早癌及癌前病变的诊断优势是显而易见的,操作简便,耗时少,通过观察黏膜表面形态和微血管形态能够发现普通内镜下较难观察的病灶。对于已发现的病灶,ME-NBI能有效鉴别肿瘤性与非肿瘤性病变,并能在标本的病理诊断前,对病变的恶性程度、浸润深度进行一个初步的评价,这对内镜下病情的诊断、预后判断以及治疗方案的选择等均有重要意义。随着NBI放大内镜的临床分型的统一以及专项培训的开展,进一步普及NBI放大内镜的临床应用和规范化操作的推广,更多的消化道早癌患者将从中受益。
[1] Maki S,Yao K,Nagahama T,et al.Magnifying endoscopy with narrow-band imaging is useful in the differential diagnosis between low-grade adenoma and early cancer of superficial elevated gastric lesions.Gastric Cancer,2013,16(2):140-146.
[2] Oka S,Tanaka S,Takata S,et al.Clinical usefulness of narrow band imaging magnifying classification for colorectal tumors based on both surface pattern and microvessel features.Dig Endosc,2011,23(1):101-105.
[3] Oba S,Tanaka S,Oka S,et al.Characterization of colorectal tumors using narrow-band imaging magnification:combined diagnosis with both pit pattern and microvessel features.Scand J Gastroenterol,2010,45(9):1084-1092.
[4] Kanao H,Tanaka S,Oka S,et al.Narrow-band imaging magnification predicts the histology and invasion depth of colorectal tumors.Gastrointest Endosc,2009,69(3):631-636.
[5] Uraoka T,Saito Y,Ikematsu H,et al.Sano’s capillary pattern classification for narrow-band imaging of early colorectal lesions.DigEndosc,2011,23(1):112-115.
[6] Misawa M,Kudo S E,Wada Y,et al.Magnifying narrow-band imaging of surface patterns for diagnosing colorectal cancer.Oncol Rep,2013,30(1):350-356.
[7] Saito S,Tajiri H,Ohya T,et al.Imaging bymagnifying endoscopy with NBI implicates the remnant capillary network as an Indication for endoscopic resection in early colon cancer.Int J Surg Oncol,2011,2011:242608.
[8] Wani S,Rastogi A.Narrow-band imaging in the prediction of submucosal invasive colon cancer:how "NICE" is it?.Gastrointest Endosc,2013,78(4):633-636.
[9] Sakamoto T,Matsuda T,Aoki T,et al.Time saving with narrow-band imaging for distinguishing between neoplastic and non-neoplastic small colorectal lesions.J Gastroenterol Hepatol,2012,27(2):351-355.
[10] Wu L,Li Y,Li Z,et al.Diagnostic accuracy of narrow-band imaging for the differentiation of neoplastic from non-neoplastic colorectal polyps:a meta-analysis.Colorectal Dis,2013,15(1):3-11.
[11] Takata S,Tanaka S,Hayashi N,et al.Characteristic magnifying narrow-band imaging features of colorectal tumors in each growth type.Int J Colorectal Dis,2013,28(4):459-468.

