IBD的内镜诊治
郑萍
炎症性肠病(inflammatory bowel disease,IBD)是一种病因尚不十分明确的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(Ulcerative Colitis,UC)和克罗恩病(Crohn’s Disease,CD)。在过去的几十年里,西欧及北美地区发病率较高,其UC和CD的年发病率分别为10-20/10万和5-10/10万,患病率100-200/10万和50-100/10万[1]。但现在这些地区的发病率趋于稳定,甚至还有所降低[2]。而以往发病率较低的东欧以及亚洲地区,其发病率却在逐年升高[3]。据文献报道,我国自1990年至今,IBD的发病率升高了将近4倍[4]。
UC是一种慢性非特异性结肠炎症,病变主要累及结肠黏膜和黏膜下层,范围多自远段结肠开始,呈连续性分布,因其主要累及黏膜层,固临床表现为腹泻、腹痛和粘液脓血便。后者为一种慢性肉芽肿性炎症,病变以末段回肠及其邻近结肠为主,呈穿壁性炎症,临床主要表现为腹痛、腹泻、瘘管、肛门病变等。两者均可合并不同程度的全身症状。严重时可出现急性穿孔及肠腔狭窄梗阻。
IBD的诊断是基于临床表现、内镜检查以及组织学检查的结果,尚无诊断的金标准[5]。因此消化内镜在IBD的诊治过程中,对于该病的诊断和鉴别诊断、确定病变范围、评估疾病活动性及治疗效果监测等都具有十分重要的意义。内镜不仅提供了病变胃肠道的直视证据还可进行组织活检,而且可以进行治疗干预,比如狭窄扩张、黏膜切除等[6]。近年来超声内镜(endoscopic ultrasonography,EUS)、放大内镜和色素内镜、窄带成像内镜(narrow-band imaging,NBI)以及胶囊内镜等新内镜技术的发展,为IBD的诊治开启了一片新天地。
IBD的内镜下诊断内镜检查所获得的信息,在IBD的诊断中具有重要价值。有经验的内镜医师能够通过识别典型的内镜变化诊断IBD并鉴别UC和CD。
一、IBD内镜检查的适应证
IBD内镜检查的适应证有:明确诊断(包括内镜和组织学上的正确诊断);评估疾病的活动性和炎症程度;药物治疗后疗效判断;监测长期患IBD的患者恶变的可能性[6]。禁忌证相对较少,多为相对禁忌,比如疑有肠穿孔及腹膜炎者、腹痛伴急性肠梗阻、中毒性巨结肠、心肺功能重度不良或衰竭。
二、电子结肠镜下IBD的表现
电子结肠镜在IBD的诊断中具有重要地位,应用结肠镜做全结肠以及末端回肠的检查,并取活组织检查,可确定病变的范围和评价其严重性。
(一)UC内镜诊断要点
UC病变多从直肠开始,呈连续性、弥漫性分布,表现为:(1)黏膜血管纹理模糊、紊乱或消失、充血、水肿、质脆、出血和脓性分泌物附着,亦常见黏膜粗糙,呈细颗粒状;(2)病变明显处可见弥漫性、多发性糜烂或溃疡;(3)缓解期患者可见结肠袋变浅、变钝或消失以及假息肉和桥黏膜等[7]。(图1)
可根据结肠镜下表现将病变分级:0级为黏膜正常;1级为黏膜血管充血、水肿、血管模糊;2级为接触性出血;3级为自发性出血;4级为溃疡形成[8]。
内镜下病变活动度判断按Truelove分级:I级,接触出血,伴有黏膜充血水肿,有粘液或脓性分泌物附着;II级,黏膜变脆更明显,点状出血,因隐窝脓肿表面有黄色或绿色脓性液,擦拭后可见表浅的小溃疡;III级,黏膜水肿更明显,伴粘液及血性渗出,溃疡变得大和深。内镜判断UC愈合的依据主要是有无溃疡、黏膜质脆、颗粒状病变小时;在病变完全缓解期,由于慢性炎症可残留炎性息肉或黏膜红斑和血管纹理紊乱。内镜下UC愈合的判断与病变活动性有良好相关性,但是和组织学的活动性并不完全一致。
2005年蒙特利尔世界胃肠病学会议强调了病变累及范围的重要性,以内镜下的表现和随访期间病变累及的最大范围来确定UC的病变范围,根据病变范围将UC分为:(1)溃疡性直肠炎;(2)左侧溃疡性结肠炎;(3)广泛的溃疡性结肠炎[9]。
(二)CD内镜诊断要点
结肠镜检查和活检应列为CD诊断的常规首选检查,镜检应达末端回肠。镜下一般表现为节段性、非对称性的各种黏膜炎症表现,其中具有特征性的内镜表现为非连续性病变、纵行溃疡和卵石样外观。
内镜下早期可见针尖大小红斑,以后发展成阿弗他溃疡,散在分布,相间的黏膜可正常。随着病变的进展,小溃疡可变深变大,成匐行性或裂隙样,相互融合,并沿肠管纵轴分布,形成纵行或裂隙溃疡。晚期肠壁纤维化常引起肠腔狭窄、炎性息肉、假性憩室。(图2)

注:a图中可见溃疡性结肠炎患者黏膜粗糙,呈细颗粒状;b图中可见溃疡性结肠炎患者肠管弥漫性、多发性糜烂或溃疡;c图中可见溃疡性结肠炎缓解期患者结肠袋变浅、变钝;d图中可见溃疡性结肠炎缓解期患者有假息肉和桥黏膜的表现
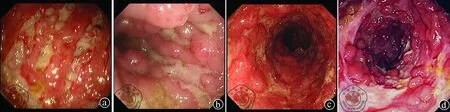
注:a图中可见克罗恩病患者肠管内针尖大小红斑;b图中可见克罗恩病患者肠管内阿弗他溃疡;c图中可见晚期克罗恩病患者裂隙样溃疡;d图中可见克罗恩病患者肠腔狭窄及炎性息肉、假性憩室形成
非干酪性肉芽肿是CD的主要组织学特征,但是在黏膜活检中仅有3%~50%能观察到,这取决于活检的数量和部位。仅黏膜固有层中的肉芽肿才是确诊CD的特征[10]。内镜下CD的严重程度分级为(1)轻度:局部或多处红斑,脆性增加,无上皮损伤;(2)中度:阿弗他溃疡或浅表小溃疡;(3)重度:大溃疡或多处溃疡,有肠腔狭窄、瘘管、大出血等并发症。
与UC相比,常规肠镜对于CD诊断的价值相对较小,有研究显示常规肠镜对于UC的确诊率为94%~97%,而CD则为40%~77%。
三、超声内镜在IBD的鉴别诊断中有重要意义
由于UC和CD所累及的肠壁深度不同,因此根据炎症或溃疡所涉及的深度与范围,利用高分辨率超声内镜可以区分UC和CD。比如UC主要表现为黏膜层与黏膜下层的结构不清,而肌层与浆膜层结构清晰;CD的肠壁各层结构均不清,而周围正常黏膜的结构层次分明。同时,超声内镜还有助于发现腹腔内肿块或脓肿等,还可以用来评估CD直肠和肛门周围的合并症。
四、胶囊内镜与小肠镜在IBD诊断中的应用
胶囊内镜和小肠镜在确定是否存在小肠病变方面具有重要价值。小肠镜可在直视下进行活组织检查和内镜下治疗,但是其缺点是检查耗时,患者也比较痛苦,同时有一定的并发症发生率。胶囊内镜则是诊断小肠IBD,特别是CD有力的技术手段。有研究表明在确立CD的诊断和评估病变范围方面,胶囊内镜较之全消化道钡餐和CT肠造影法来的更为敏感[11-12],但是其缺点是不能获得组织学标本,而且胶囊内镜还有一定的禁忌症,比如胃肠道梗阻、狭窄或瘘管形成、起搏器置入或其他植入性电子设备以及吞咽困难者[13]。
五、内镜在IBD治疗中的作用
(一)指导药物治疗
对于UC患者,病变主要在左半结肠以下者,内镜表现为I级和(或)II级者,可选用水杨酸类制剂进行局部强化治疗;对于广泛性结肠以上病变者,或不管病变范围如何,只要内镜表现为严重的III级和(或)IV级者,以及合并有肠管狭窄者,均应选用SASP或5-ASA加上糖皮质类固醇激素和(或)免疫抑制剂进行治疗;合并重度不典型增生或癌变应尽早进行手术治疗。
一旦肠镜结合超声内镜确诊CD者,应尽早采用激素和(或)免疫抑制剂进行治疗,有条件者,可尽早应用生物制剂治疗;合并瘘管形成者,应尽早应用免疫抑制剂和甲硝唑进行治疗;对于初发或可疑病例,一般选用SASP或5-ASA进行治疗,并进行密切随访,确诊后按上述原则进行治疗。对于内镜随访1年以上,结肠黏膜持续无好转或在药物维持阶段,黏膜愈合反复者,可选用生物制剂或干细胞移植治疗。
(二)肠腔狭窄的内镜下治疗
肠腔狭窄是IBD患者的重要并发症,其中CD患者的发生率高于UC患者。其临床表现与疾病活动度无关。有报道手术治疗的CD患者中有20%是由于肠腔完全或部分梗阻[13]。IBD患者并发肠腔狭窄时可用球囊扩张术及内镜引导下置入支架扩张治疗,目前被认为是简单、安全和有效的治疗方法。无症状的狭窄不主张特殊干预。行球囊扩张或支架置入术前,无需常规使用抗菌药物。有些患者可能需要多次扩张治疗才能达到满意的疗效。
在对某些临床上无梗阻症状,但是存在肠腔狭窄的患者行胶囊内镜检查时,可能出现胶囊内镜滞留于狭窄部位,此时可采用小肠镜或结肠镜于狭窄段行球囊扩张处理后,取出胶囊内镜,少数情况下可能需要手术治疗。
此外尚有报道采用内镜下小针刀狭窄切开,可用于治疗回结肠狭窄及贮袋狭窄,可在超声引导下进行治疗。内镜下寻找到狭窄部位后,置入多普勒超声探头,探头可用以辨别血流是否丰富,尽可能避免切开血流丰富的部位[14]。有经验的内镜医生可以安全有效的进行操作。
(三)息肉及肿瘤的内镜下治疗
近年来内镜下黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已逐渐成为消化道癌前病变及早癌的标准微创治疗手段。在内镜随访的过程中,如发现有腺瘤性息肉、不典型增生等,应及早在内镜下进行治疗。
(四)IBD的内镜随访
IBD是一种慢性疾病,病情可反复发作,迁延不愈,因此在治疗过程中的内镜随访十分重要。在临床上患者症状不明显或经治疗后症状缓解的患者,其肠道黏膜的炎症仍可持续存在。有研究表明,部分患者即使临床症状好转,但肠道内仍有明显病变[15]。一般认为,强化治疗2~3个月后,复查肠镜,如黏膜病变明显好转或范围明显缩小,可考虑减药。随后,每2~3个月复查1次肠镜,主要是观察病变的肠段,不需要进行全结肠的检查,如在减药过程中,黏膜病变继续好转,无恶化,可继续减药,直至找出最小的维持量进行维持治疗。
激素依赖型IBD在激素足量治疗2~3个月时,黏膜病变会明显好转,但在激素逐渐减量的过程中,肠道黏膜病变有恶化,则提示该患者为激素依赖型IBD,应尽早加用或改用免疫抑制剂进行治疗。
炎症过后,黏膜上皮细胞仍会发生变化,如息肉形成。所以即使是完全缓解的患者,仍需要定期的内镜随访。特别是在缓解病例,如短期内出现新的溃疡,并逐渐扩大者,需警惕结肠癌的可能。UC的恶变率与一般人群相比要高5~20倍,10年以上患者恶变率每年递增1~2%[16]。因此,多数学者主张,病程10年以上者,需每年行1~2次结肠镜检查。CD的恶变风险较UC为低,但近年的研究表明其恶变率仍然较正常人群高约6倍[16],因此其随访原则基本与UC相同。
内镜在IBD的诊治中占有重要的地位,对该病的诊断和鉴别诊断、疾病活动性和程度的判断、药物治疗的指导、并发症的治疗以及恶变的监测等方面均具有重要意义。内镜下黏膜愈合是判断药物治疗有效的重要依据,但是更为准确的内镜下病变评分系统尚有待完善。新内镜诊疗技术改变了传统的理念,在IBD的诊治中也发挥了积极的作用。可以预见,随着内镜技术的进一步发展,将有望开辟IBD领域更加微创、简便和安全的治疗新篇章。
[1] Carter MJ,Lobo AJ,Travis SP.Guidelines for the management of inflammatory bowel disease in adults.Gut,2004,53(5):1-16.
[2] Molinié F,Gower-Rousseau C,Yzet T,et al.Opposite evolution in incidence of Crohn’s disease and ulcerative colitis in Northern France(1988-1999).Gut,2004,53:843-848.
[3] Thia KT,Loftus EV,Sandborn WJ,et al.An update on the epidemiology of inflammatory bowel disease in Asia.Am J Gastroenterol,2008,103:3167-3182.
[4] Jiang L,Xia B,Li J,et al.Retrospective survey of 452 patients with inflammatory bowel disease in Wuhan city,central China.Inflamm Bowel Dis,2006,12:212-217.
[5] Ouyang Q,Tandon R,Goh KL,et al.Management consensus of inflammatory bowel disease for the AsiaPacific region.J Gastroenterol Hepatol,2006,21:1772-1782.
[6] Hommes DW,van D eventer SJ.Endoscopy in inflammatory bowel diseases.Gastroenterology,2004,126(6):1561-1573.
[7] Danese S and Fiocchi C.Ulcerative colitis.N Engl J Med,2011,365(18):1713-25.
[8] Barom JH,Connell AM,Lennard-Jones JE.Variation between observers in describing mucosal appearances in proctocolitis.Br Med J,1964,1:89-92.
[9] Silverberg MS,Satsangi J,Ahmad T,et al.Toward an integrated clinical,molecular and serological classification of inflammatory bowel disease:Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology.Can J Gastroenterol,2005,19:5-36.
[10] Mahadeva U,Martin JP,Patel NK,et al.Granulomatous ulcerative colitis:a reappraisal of the mucosal granuloma in the distinction of Crohn’s disease from ulcerative colitis.Histopathology,2002,41(1):50-55.
[11] Eliakim R,Fischer D,Suissa A,et al.Wireless capsule video endoscopy is a superior diagnostic tool in comparison to barium follow-through and computerized tomography in patients with suspected Crohn’s disease.Eur J Gastroenterol Hepatol,2003,15(4):363-367.
[12] Mow WS,Lo SK,Targan SR,et al.Initial experience with wireless capsule enteroscopy in the diagnosis and management of inflammatory bowel disease.Clin Gastroenterol Hepatol,2004,2(1):31-40.
[13] Hommes DW,van Deventer SJ.Endoscopy in inflammatory bowel diseases.Gastroenterology,2004,126(6):1561-1573.
[14] Li Y,Shen B.Doppler ultrasound-guided endoscopic needle-knife treatment of an anastomotic stricture following subtotal colectomy.Endoscopy,2011,43(2):343.
[15] 钟英强,朱兆华,陈为宪,等.活动期溃疡性结肠炎的内镜特点及其与临床的关系研究.中国内镜杂志,2000,6(4):7-8.
[16] 欧阳钦.炎症性肠病的内镜诊断价值与X线诊断.医学新知杂志,2001,11(2):63-64.

