吡拉西坦片溶出度测定方法研究
李明 王晓琦 王永新 窦红允 黄东杰
(沧州市食品药品检验所,河北 沧州061000)
吡拉西坦片为脑代谢药,适用于急、慢性脑血管病、脑外伤、各种中毒性脑病等多种原因所致的记忆减退及轻、中度脑功能障碍。也可用于儿童智能发育迟缓。现行标准收录于 《中国药典》(2010年版)二部,但标准中没有吡拉西坦的溶出度限度要求。溶出度是片剂质量控制的一个重要指标,药物在体内吸收速度常由溶解的快慢而决定,固体制剂中的药物在被吸收前,必须经过崩解和溶解然后转为溶液的过程,如果药物不易从制剂中释放出来或药物的溶解速度极为缓慢,则该制剂中药物的吸收速度或程度就可能存在问题。为更好地控制药品的内在质量,本研究建立了测定吡拉西坦溶出度的检查方法,并进行了相关的方法学研究。此法操作简便,专属性强,可有效地控制药品的质量。
1 仪器与试药
RZQ-8D溶出实验仪(天津市天大天发科技有限公司);高效液相色谱仪(Agilent1100型高效液相色谱仪); C18色谱柱(4.6 mm × 250 mm,5 μm)(Agilent公司)吡拉西坦片(11个厂家共31批样品);吡拉西坦对照品(中国食品药品检定研究院提供,批号:100386-200702,含量 100%);甲醇(色谱纯,黄骅市江峰化学品有限公司)。
2 方法与结果
2.1 供试品溶液的制备
取本品6片,照溶出度测定法[1],以水1 000 mL为溶出介质,转速100 r/min,依法操作,经 20 min时,取溶液适量,滤过,精密量取续滤液5 mL,置20mL量瓶中,加流动相稀释至刻度作为供试品溶液。
2.2 吡拉西坦对照品的制备
精密称取吡拉西坦对照品适量,加流动相溶解并稀释成每1 mL含0.1 mg的溶液。
2.3 阴性对照溶液的制备
不加供试品,其他操作同2.1。
2.4 吡拉西坦溶出量的测定
照高效液相色谱法(HPLC)[1]测定。色谱条件与系统适用性试验:用十八烷基硅烷键合硅胶为填充剂;以甲醇-水(10∶90)为流动相;流速为0.8 mL/min;检测波长为210 nm。取上述供试品溶液和对照品溶液各10 μL,注入液相色谱仪,记录色谱图。按外标法以峰面积计算每片中吡拉西坦的溶出量。限度为标示量的80%,符合规定。
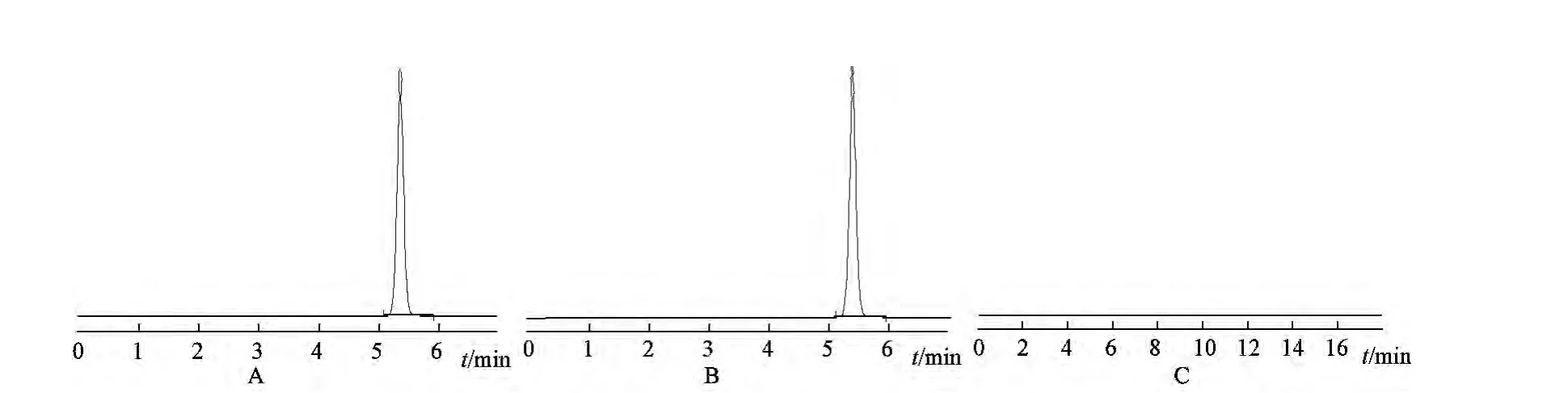
图1 吡拉西坦HPLC图
3 溶出度方法学试验
3.1 线性关系试验
分别精密称取吡拉西坦对照品0.005 01,0.007 50,0.010 09,0.012 55,0.015 08 g 分置 100 mL量瓶中,加甲醇-水(10∶90)稀释至刻度,混匀。 照上述色谱条件测定。以面积(A)对进样量(C)线性回归,回归方程为
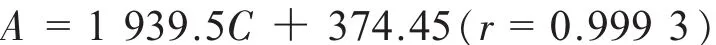
结果表明,吡拉西坦在0.05~ 0.15 mg/mL的范围内,面积与进样量呈良好的线性关系。
3.2 精密度试验
精密称取吡拉西坦对照品,照2.4项下的方法,溶解稀释。按溶出度测定项下操作,同法连续测定6次,结果吡拉西坦峰面积的RSD为0.50%。结果表明吡拉西坦精密度均良好。
3.3 溶液稳定性试验
取3.2项下的浓度的溶液,测定不同间隔时间色谱峰面积的变化。结果显示测定溶液在12 h内色谱峰面积基本无变化(RSD=0.45%),溶液稳定。
3.4 回收率试验
按处方量的 80%、100%、120%,精密称取吡拉西坦原料适量,同时按处方配比加入辅料,分置1 000 mL量瓶中,加水溶解并稀释至刻度,混匀,过滤,精密量取续滤液5 mL置20 mL量瓶中,加甲醇-水(10∶90)稀释至刻度,混匀,作为对照品溶液。
分别精密称取吡拉西坦对照品0.010 19,0.010 09 g 分置 100 mL 量瓶中,加甲醇-水(10∶90)溶解并稀释至刻度,混匀。作为对照品溶液。
用HPLC法测定吡拉西坦的峰面积,计算回收率。测得吡拉西坦回收率为99.5%,RSD为0.44%。结果见表1。
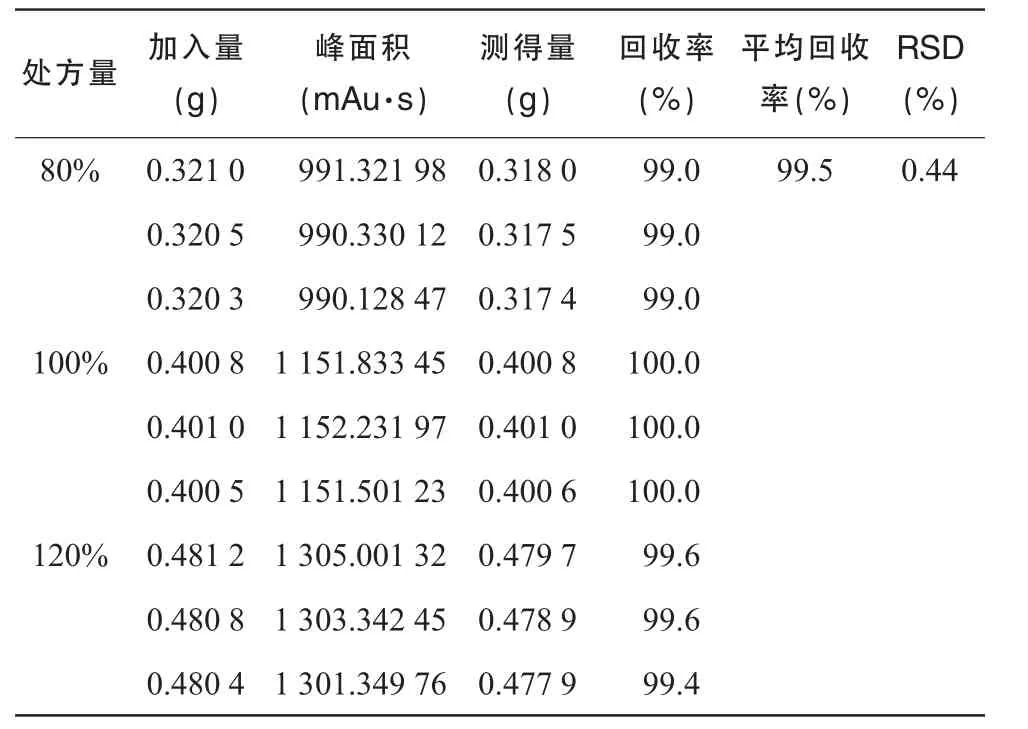
表1 吡拉西坦回收率试验结果
3.5 溶出曲线
随机取厂家A、B、C各一个批次,照溶出度测定法[1],以水 1 000 mL为溶出介质,转速为100 r/min,依法操作,分别在在 5,10,15,20,25,30,35,40 min取样 10 mL过滤,精密量取续滤液5 mL,置 20 mL 量瓶中,加甲醇-水(10∶90)稀释至刻度,照上述测定方法测定溶出量,以每个时间点6个溶出杯平均溶出量为纵坐标,溶出时间为横坐标,绘制溶出曲线,见图2。结果表明,20 min时,吡拉西坦溶出度均达到标示量的80%以上;溶出均一性良好,故将限度定为20 min。
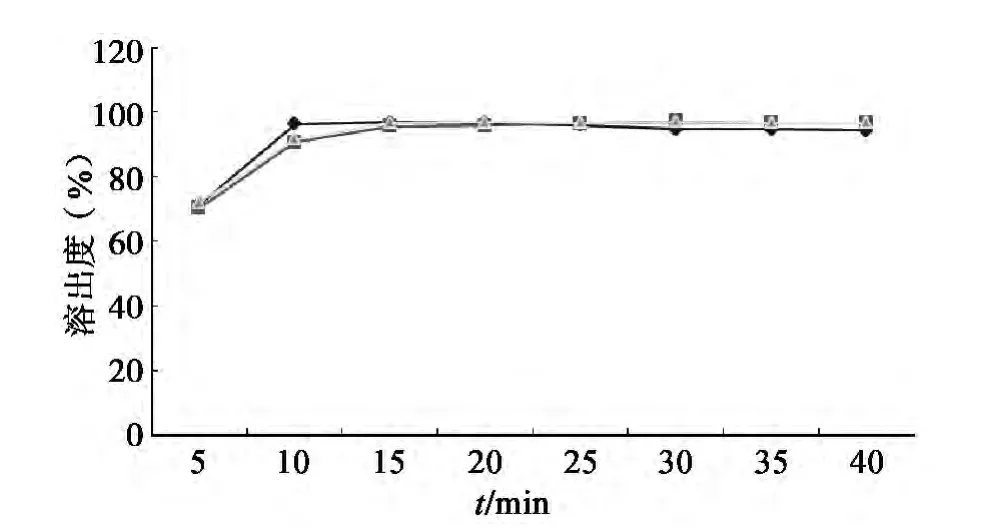
图2 吡拉西坦累积溶出速率曲线
4 样品的测定
取31批样品,照上述方法测定溶出度,每批测定一次,结果见表2。

表2 31批样品溶出度测定结果
5 讨论
溶出度是指药物从片剂等固体制剂在规定溶剂中溶出的速度和程度,是片剂质量控制的一个重要指标,对难溶性的药物一般都应作溶出度的检查。过去认为只有难溶性药物才有溶出度的问题,但近年来研究证明,易溶性药物也会因制剂的配方和工艺不同导致药物溶出度有很大差异,从而影响药物生物利用度和疗效,在《美国药典》中规定测定溶出度的制剂有相当数量是易溶性药物。吡拉西坦在水中易溶[1],故选择水为溶出介质。检测波长与流动相的选择参照《中国药典》(2010年版)二部中吡拉西坦片含量测定项下检测方法。分别采用3种不同生产厂家的色谱柱进行考察:①C18(4.6 mm × 250 mm,5 μm,Thermo),②C18(4.6 mm × 250 mm,5 μm,Agilent),③C18(4.6mm ×150 mm,5 μm,Waters),均符合试验的要求,最终选择 C18(4.6 mm × 250 mm,5 μm,Agilent)。 对31批样品进行溶出度测定的结果显示上述样品均符合拟定的溶出度限度要求。
依靠崩解时限检查作为所有片剂、胶囊等固体制剂在体内吸收的评定标准显示然是不够完善的,因为药物溶解后通过崩解仪筛网粒径常在1.6~2.0 mm之间,而药物需呈溶液状态才能被机体吸收,其粒子大小以A来计算,所以崩解仅仅是药物溶出的最初阶段,而后面的继续分散和溶解过程,崩解时限检查是无法控制的,且固体制剂的崩解还要受到处方设计、制剂制备、贮存过程及体内许多复杂因素的影响,所以崩解时限检查不能客观反映药物与赋形剂之间的关系和影响,而溶出度检查却包括了崩解及溶解过程,因此研究溶出度就有更重要的意义。本研究通过对吡拉西坦片中吡拉西坦溶出度检验方法的研究,为进一步完善其质量标准提供参考。
[1]国家药典委员会.中华人民共和国药典(2010年版)二部[S].北京:中国医药科技出版社,2010:附录XC,337-338.

