甲钴胺和谷胱甘肽预防奥沙利铂所致神经毒性的效果分析
朱西平, 喻永龙, 胡 舰, 胡守友
(1. 安徽省宁国市人民医院 肿瘤科, 安徽 宁国, 242300; 2. 江苏省中医院 肿瘤科, 江苏 南京, 210029)
奥沙利铂(L-OHP)作为第3代铂类化疗药物,在临床得到广泛应用,已成为治疗大肠癌不可或缺的药物,在辅助化疗和姑息化疗中均有良好表现[1]。它的骨髓抑制度低,胃肠道反应小,无明显肾脏毒性、耳毒性。但临床较常见神经毒性,严重的神经毒性会影响患者日常生活质量[2]。所以对其神经毒性的监控和预防具有重要的临床意义。目前还没有预防和减轻奥沙利铂神经毒性的标准药物。作者采用随机、双盲、安慰剂对照的方法,通过分组观察甲钴胺和还原性谷胱甘肽在预防奥沙利铂引起神经毒性方面的作用。
1 资料与方法
1.1 一般资料
选取2011年6月—2013年11月在本院经手术完全切除经病理确诊为腺癌的高危Ⅱ期和Ⅲ期结直肠癌患者96例,接受L-OHP联合5-Fu辅助化疗,随机分为对照组 、甲钴胺组、还原性谷胱甘肽组。3组患者在性别、年龄构成方面无显著差异(P>0.05)。
1.2 方法
3组患者均给予L-OHP+5-Fu+CF化疗。其中L-OHP的用量为90 mg/m2, 滴注时间为2~4 h; 5-Fu用量为400 mg/m2, 静脉推注d1, 1 200 mg/m2, 46 h持续泵入;每2周重复。甲钴胺组:在化疗前予甲钴胺500 μg静脉滴注, 1次/d, d1~3。还原性谷胱甘肽组:还原性谷胱甘肽1.2 g静脉滴注, 1次/d, d1~3。对照组:生理盐水静脉滴注, 1次/d, d1~3。在治疗期间,根据每次神经毒性评价结果调整L-OHP的剂量。出现Ⅰ度神经毒性,不调整剂量。出现Ⅱ度神经毒性时,如果在下一周期前未恢复至Ⅰ度,则将L-OHP剂量减少25%。如果出现Ⅲ度神经毒性,则停用L-OHP。
1.3 疗效评价
利用奥沙利铂专用神经毒性分级和神经症状评分(NSS)指标观察患者神经毒性发生率和严重程度。
1.3.1 L-OHP专用分级标准: 采用L-OHP研发机构Sanofi-synthelabo公司肿瘤中心,针对L-OHP诱发独特的神经系统症状专门分级衡量标准作为分级标准。Ⅰ度:短时间的感觉异常,感觉麻木;Ⅱ度:治疗周期间持续存在的感觉异常,感觉异常;Ⅲ度:感觉异常,感觉麻木引起功能障碍。
1.3.2 神经症状评分(NSS): 据患者下肢有无疼痛或不适评分,有麻木、烧灼样痛或刺痛则记2分,有乏力、抽搐或隐痛则记1分,无则记0分;上述症状出现在足部则记2分,小腿则记1分,其他部位记0分;上述症状只出现在白天记0分,白天和黑夜均出现记1分,夜间症状加重记2分;若患者曾因为疼痛或者不适而从睡眠中被惊醒则再加1分。根据以下方法能否减轻疼痛或不适评分,坐位或卧位记0分,站立位记1分,行走记2分。NSS 总分3~4分为轻度神经病变症状,5~6分为中度神经病变症状,7~9分为重度神经病变症状。NSS总分≥1为异常。
2 结 果
2.1 样本纳入情况
纳入研究的患者96例,其中有3例未能完成3周期治疗而不纳入最终分析。实际完成93例。其中男49例,女44例;年龄24~78岁,平均(47.1±15.2)岁。3组患者在性别、年龄构成方面无显著差异(P>0.05)。
2.2 急性神经毒性发生率
急性神经毒性一般在输液24 h内出现,多表现为肢体末端疼痛、麻木和感觉减退,均为1~2级。对照组、甲钴胺组和还原性谷胱甘肽组急性神经毒性总发生率分别为:28例(90.3%)、14例(46.7%)、19例(59.4%)。所有患者均未出现喉痉挛。
2.3 化疗不同周期各组慢性神经毒性分度发生率
化疗3周期和6周期时,甲钴胺组神经毒性Ⅱ~Ⅲ度发生率显著低于对照组(P<0.01或P<0.05), 而还原性谷胱甘肽组神经毒性Ⅱ~Ⅲ度发生率低于与对照组,但无显著性差异(P>0.05), 甲钴胺组神经毒性Ⅱ~Ⅲ度发生率低于还原性谷胱甘肽组,但无显著性差异(P>0.05)。见表1。
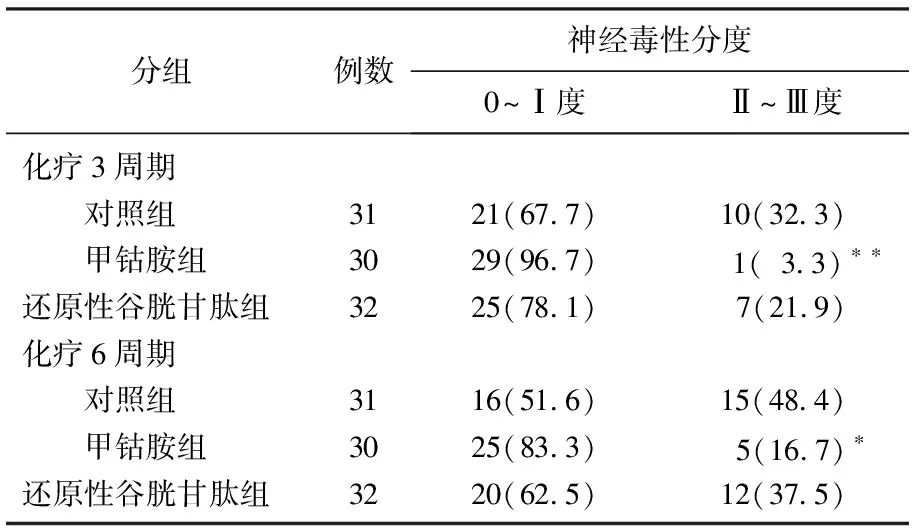
表1 化疗不同周期时各组患者神经毒性分度发生率[(n)%]
2.4 化疗不同周期时各组患者NSS评分
根据NSS评分标准,化疗3周期时,甲钴胺组NSS评分显著均低于对照组和还原性谷胱甘肽组(P<0.05), 而还原性谷胱甘肽组均与对照组无显著性差异(P>0.05)。6周期时,甲钴胺组NSS评分显著均低于对照组和还原性谷胱甘肽组(P<0.01), 而还原性谷胱甘肽组均与对照组无显著性差异(P>0.05)。见表2。
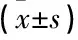
表2 化疗不同周期时各组患者NSS评分
3 讨 论
L-OHP联合5-Fu已经成为可完全切除结直肠癌的标准辅助化疗方案,疗效肯定,安全性良好,得到临床医生的广泛认同[3-4]。但大剂量应用L-OHP所致神经毒性仍然给临床应用带来很大困扰。目前尚无有效方法预防。很多药物被尝试用来减少L-OHP神经毒性,其中包括钙镁合剂、还原性谷胱甘肽、卡马西平、氨磷丁和甲钴胺[6]。本研究证实甲钴胺可以减少急慢性神经毒性发生概率,但是谷胱甘肽无此作用。L-OHP所致神经毒性临床可以分为急性神经毒性,以及几周后出现的慢性毒性。慢性毒性主要表现为迟发型感觉障碍,这种病变因积累用药剂量越多而持续时间越长。但是L-OHP神经毒性发生机制目前尚不清楚。本实验中3组急性神经毒性均低于国外研究。这可能是由于我们在用药期间护理特别要求患者注意防寒保暖、避免寒冷刺激;同时国人,特别是中老年人较西方人群有明显的喜热饮、热食的习惯,这些均有利于急性神经毒性的预防和控制。急性神经毒性发生率中,甲钴胺组和还原性谷胱甘肽组均低于对照组,显示二者在降低急性神经毒性方面有作用。甲钴胺是维生素B12的衍生物,其中钴分子上结合一个活性的甲基基团,是一种内源性辅酶B12。外源性用药可进入神经细胞,可促进核酸、蛋白的合成。由于可以提高蛋氨酸合成酶的活性,促进髓鞘的主要结构磷脂酰胆碱合成,故可促进髓鞘的形成。甲钴胺可改善周围神经病变的症状,增加神经传导速度。结合本实验特点可以有效改善急慢性神经毒性发生几率和程度。
Cascinu等[7]在谷胱甘肽预防L-OHP神经毒性的临床研究中发现,应用L-OHP之前给予还原性谷胱甘肽1 500 mg/m2, 完成8程和12程化疗时,治疗组与对照组的周围神经病变发生率存在显著差异。但是本组实验中未见到此作用。结合其他实验,还原性谷胱甘肽作用有限。本实验中利用NSS评分,以化疗前为基线,化疗3周期后3组评分均上升, 6周期时安慰剂和谷胱甘肽组均分值均较前再次升高,证明L-OHP神经毒性呈剂量累积性。但是甲钴胺组分值下降,能有效减少神经毒性。
总之,甲钴胺可以有效预防L-OHP相关神经毒性,值得临床关注。
[1] Alberts S R, Sargent D J, Nair S, et al. Effect of oxaliplatin, fluorouracil, and leucovorin with or without cetuximab on survival amongpatients withresected stage Ⅲ colon cancer: a randomized trial[J]. JAMA, 2012, 307(13): 1383.
[2] Tournigand C, Cervantes A, Figer A, et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in astop-and-Go fashion in advanced- colorectal cancer-a GERCOR study[J]. J Clin Onco, 2006, 24(3): 394.
[3] Haller D G, Tabernero J, Maroun J, et al. Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage Ⅲ colon cancer[J]. J Clin Oncol, 2011, 29(11): 1465.
[4] 徐静, 孙秀华, 高冲. 结直肠癌多学科综合治疗新进展[J]. 国际肿瘤学杂志, 2013, 40(009): 699.
[5] Gamelin L, Boisdron-Cellel M, Delva R, et al. A retrospective study of 161-patients receiving oxaliplatin combined with 5- fluorouncil and leucovorin for advanced cobrectal cancer[J]. Clin Cancer Res, 2004, 10(25): 4055.
[6] Grothey A, Nikcevich D A, Sloan J A, et al. Intravenous Calcium and Magnesium for Oxaliplatin-Induced Sensory Neurotoxicity in Adjuvant Colon Cancer: NCCTG N04C7[J]. J Clin Oncol, 2011, 29(4): 421.
[7] Caxciru S, Catalano V, Cordella L, et al. Neuroprotective effect of reduced glutathione on oxaliplatin-based chemotherapy in advanced cobrectal cancer a randomized, double-blind, placebo-controlled trial[J]. Clin Oncol, 2002, 20(16): 478.

