老年COPD患者急性加重期T淋巴细胞功能的变化
汤丽萍,解立新
(解放军总医院解放军医学院,北京,100853)
慢性阻塞性肺疾病(COPD)是一种好发于老年人群,表现为气流受限呈不完全可逆性的[1]、进行性发展的疾病,发病常与有害颗粒、气体、细菌、病毒等有关。机体肺部组织释放大量的氧自由基、蛋白酶等因子,导致对致病因素的异常性的炎症反应,是其主要发病机制[2]。目前,中国老年中的COPD患者数量迅速增加,发病率越来越高,且无特殊有效的治疗方案,COPD已成为全世界的一大公共卫生问题[3]。COPD急性期患者最为常见的病因为空气、呼吸道的感染,反复的急性发作可逐渐损害患者的肺功能,加重经济负担,而且使得死亡率也升高,危害性极大[4]。本研究探讨老年急性加重期的COPD患者的T淋巴细胞免疫功能的变化,现报告如下。
1 资料与方法
1.1 一般资料
分析2011年6月—2013年8月在本院呼吸内科接受住院治疗的急性加重期老年COPD患者的临床资料。纳入标准:结合患者症状、体征,根据2007年中华医学会呼吸病学分会制定的COPD诊治指南明确诊断为COPD的老年患者(≥60周岁); FEV1/FVC(一秒用力呼吸容积/用力肺活量)< 70%,FEV1<预计值(在患者吸入β2受体激动剂之后所测的值)的80%; 患者处于急性加重期,至少包括以下中的一项症状:合并肺炎、咳嗽出现加重、出现脓痰或痰量增加、发热、呼吸困难症状加重。排除标准:伴发有免疫缺陷的患者(先天或后天性)、免疫系统疾病者,伴有活动性结核者;伴有恶性肿瘤者;伴有严重心、肝、肾等重要脏器功能不全者;仅1月内服用过免疫调节、抑制剂如激素者。入组的患者均需签署相关研究知情同意书。选取正常体检老年人作为对照组。2组受试者的性别、年龄、BMI和空腹血糖均无显著差异(P均>0.05),具有可比性。见表1。
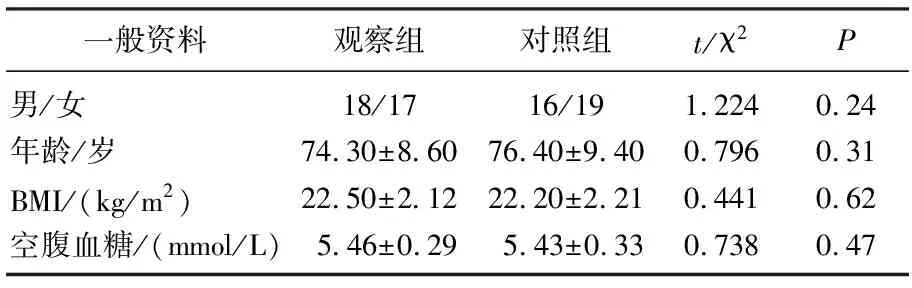
表1 2组受试者一般资料比较
1.2 研究方法
患者入组后按COPD中华医学会的诊治指南予抗生素治疗,待病原菌确定后及时调整方案,并辅以解痉、止咳平喘以及对症支持等治疗方案。比较2组受试者的一般信息(包括性别、年龄、BMI等)、肺功能指标(包括一秒用力呼吸容积/用力肺活量FEV1/FVC、FEV1占预计值比例FEV1%pred等)、免疫系统T淋巴细胞亚群(CD4+与CD8+比例)、炎性指标(包括TNF-α、IFN-γ、IL-4、IL-6等)等指标。炎性指标均由ELISA法测得。
1.3 统计学方法
数据采用SPSS 19.0软件进行统计分析。计量资料以均数±标准差表示,比较采用t检验。率的比较使用卡方(χ2)检验。P<0.05为差异具有统计学意义。
2 结 果
观察组患者的肺功能FEV1%pred(t=31.48,P<0.01)和FEV1/FVC(t=23.39,P<0.01)均显著低于对照组。见表2。观察组患者的TNF-α(t=2.224,P=0.029)、IL-4(t=5.065,P<0.01)、IL-6(t=2.551,P=0.013)水平均显著高于对照组。见表3。观察组患者的CD4+比例(t=8.322,P<0.01)和CD4+/CD8+的比值(t=7.712,P<0.01)均显著小于对照组,而CD8+比例(t=6.235,P<0.01)显著高于对照组。见表4。

表2 2组受试者肺功能比较 %
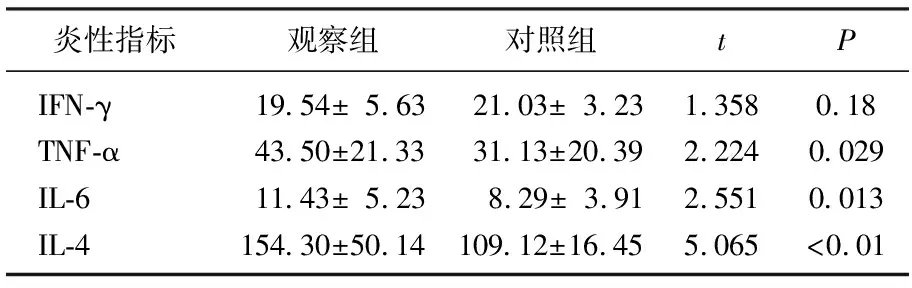
表3 2组炎性指标对比 ng/L

表4 2组受试者T淋巴细胞分群比较
3 讨 论
本研究主要将老年急性加重期的COPD患者与正常老年体检者进行T淋巴细胞免疫功能比较,结果发现与同龄健康老年人相比,老年急性加重期的COPD患者的肺功能明显受损,表现为FEV1%pred和FEV1/FVC明显下降[5],而且COPD患者出现了T淋巴细胞亚群分化异常,即CD4+T淋巴细胞所占比例明显下降,而CD8+T细胞却有所增加,且CD4+/CD8+比例出现倒置[6]。本研究还比较2组受试者的炎性指标,结果发现COPD患者的血液炎性指标TNF-α、IL-4、IL-6水平均显著升高。作者考虑COPD疾病主要病变位于小气道,其发病机制涉及多种炎性细胞之间的相互作用[7],而COPD反复发作及加重的主要原因即为感染,而感染对患者的机体免疫系统也有着重要的影响,其一方面可增强免疫系统,病原体(或其产物)活化可导致机体的非特异性免疫增强,以抵抗病原菌的感染;另一方面,COPD患者反复感染后可出现机体免疫系统受抑制,出现免疫功能底下[8]。在COPD急性加重期中,细胞免疫是抗感染的主要力量,CD4+作为辅助性T细胞,其比例的下降使得机体产生的细胞活性因子以及辅助B细胞或其他淋巴细胞发挥作用的功能减弱,提示了机体的免疫功能下降[9]。而CD8+作为细胞毒性T细胞,当其数量过度增加时可损伤机体。已有大量研究证实CD8+细胞是COPD炎症发病过程中的优势细胞[10]。国内外已有学者证实绝大多数的老年COPD患者会伴发有免疫功能的下降,尤其是在急性加重期,主要表现为细胞免疫功能出现下降,且T淋巴细胞扩增也有所减少。CD4+/CD8+比例倒置、T细胞功能紊乱以及免疫功能受损很可能是COPD患者疾病呈不完全可逆性的进展的重要内源性因素[11]。
[1]Hou J,Sun Y,Hao Y,et al.Imbalance between subpopulations of regulatory T cells in COPD[J].Thorax,2013,68(12): 1131.
[2]Van Remoortel H,Hornikx M,Demeyer H,et al.Daily physical activity in subjects with newly diagnosed COPD[J].Thorax,2013,68(10): 962.
[3]van den Berge M,Steiling K,Timens W,et al.Airway gene expression in COPD is dynamic with inhaled corticosteroid treatment and reflects biological pathways associated with disease activity[J].Thorax,2014,69(1): 14.
[4]Rovina N,Koutsoukou A,Koulouris N G.Inflammation and immune response in COPD: where do we stand[J].Mediators Inflamm,2013,2013:413735.
[5]Chen L,Shen Y,Liu L,et al.Interleukin-13 -1112 C/T promoter polymorphism confers risk for COPD: a meta-analysis[J].PLoS One,2013,8(7):e68222.
[6]Grundy S,Plumb J,Lea S,et al.Down regulation of T cell receptor expression in COPD pulmonary CD8cells[J].PLoS One,2013,8(8): e71629.
[7]Hodge G,Holmes M,Jersmann H,et al.The drug efflux pump Pgp1 in pro-inflammatory lymphocytes is a target for novel treatment strategies in COPD[J].Respir Res,2013,14(1): 63.
[8]Cosgrove D,Macmahon J,Bourbeau J,et al.Facilitating education in pulmonary rehabilitation using the living well with COPD programme for pulmonary rehabilitation: a process evaluation[J].BMC Pulm Med,2013,13: 50.
[9]Ramponi S,Tzani P,Aiello M,et al.Pulmonary rehabilitation improves cardiovascular response to exercise in COPD[J].Respiration,2013,86(1): 17.
[10]Ricci R,Palmero C,Bazurro G,et al.The administration of a polyvalent mechanical bacterial lysate in elderly patients with COPD results in serological signs of an efficient immune response associated with a reduced number of acute episodes[J].Pulm Pharmacol Ther,2014,27(1): 109.
[11]Boiselle P M,Litmanovich D E,Michaud G,et al.Dynamic expiratory tracheal collapse in morbidly obese COPD patients[J].COPD,2013,10(5): 604.

