肝脏去交感神经状态对大鼠脂类和激素代谢的影响
宦宏波,夏 锋,吴 林,吴黎雳,邓 翔,马宽生,别 平
(第三军医大学西南医院全军肝胆外科研究所,重庆,400038)
肝脏拥有广泛的神经纤维分布,相关研究[1-3]表明,这些神经纤维在肝脏的生理病理过程中将会发挥重要的调控功能。交感神经是自主神经中重要的组成部分,对肝脏的生理功能具有重要的调控作用,目前有研究[4-6]表明刺激肝脏神经支可引发血糖、肝血流量的变化等。肝脏周围的韧带中分布有大量支配肝脏的神经纤维,其中含有很多交感神经纤维,肝脏外科手术中常会大范围地游离这些韧带,也必然会损伤肝脏的神经丛,从而导致肝脏的去神经状态[7]。同时,肝脏外科手术可因对肝脏的直接创伤和缺血再灌注损伤等造成肝组织的急性损害。作者前期研究证实,肝损伤情况下去交感神经状态有利于蛋白合成、胆红素代谢、能量代谢和排泄功能,同时也使低血钾的程度减轻[8-9]。在肝脏去神经状态下,是否对肝脏脂类和激素的代谢产生影响,目前鲜有报道。本实验应用大鼠急性肝损伤模型模拟临床外科手术对肝脏的急性损伤,应用去交感神经动物模型模拟临床外科手术中游离肝周韧带致去交感神经状态,探讨此时大鼠肝脏的脂类和激素代谢在正常和化学性急性肝损伤不同情况时的变化,以了解去交感神经状态对肝脏脂类和激素代谢的影响。
1 材料与方法
1.1 试剂及仪器
6-羟基多巴胺(6-Hydroxydopamine,6-OHDA)(Sigma,美国),CCl4(重庆化学试剂公司),血清皮质醇(Cor)放射免疫分析试剂盒(3V诊断技术公司),血浆醛固酮(ALD)放射免疫分析测定盒(北京北方生物技术研究所),免疫活性胰岛素IRI放射免疫分析试剂盒(成都华西糖尿病科技开发研究所),甘油三酯(TG)试剂盒(氧化酶法),胆固醇(Tch)试剂盒(氧化酶法)均购自上海科华东菱诊断用品有限公司。全自动生化分析仪Synchron CX7 (Beckman)。
1.2 实验动物与分组
健康雄性Wistar大鼠共80只,体质量180~220 g,均由第三军医大学实验动物中心提供。按照随机数字表法分成4组,每组20只。A: 对照组,麻醉状态下于大鼠腹部切一长约1 cm的小口随即缝合; B: 肝损伤模型组,大鼠按0.4 mL/100 g的剂量于腹部皮下多点注射60% CCl4(CCl4和灭菌液状石蜡之比为6∶4),在实验后第4天追加注射1次; C: 去交感神经模型组,参考文献[11]的方法建立去交感神经动物模型; D: 实验组,先建立交感神经动物模型,再按肝损伤模型组方法注射60% CCl4。所有大鼠于实验后第7天由腹主动脉抽血2~3 mL,离心取上清,-20 ℃保存备用。
1.3 肝脏去交感神经状态动物模型建立
参考文献[11],6-OHDA用灭菌生理盐水配制成100 mg/L的溶液(现用现配)。Wistar大鼠行乙醚吸入麻醉,固定于大鼠手术板上。大鼠腹部局部消毒,于腹部正中做切开一长约1 cm纵向切口,用镊子轻轻夹出小肠,理出空肠段系膜,找到肠系膜血管,用4号半头皮针刺入肠系膜静脉中,注入2 mL 6-OHDA(含200 μg)。注射完毕后用棉签压迫针眼约3~5 min后,止血后还纳肠道,缝合腹壁,常规饲养[10-11]。
1.4 肝脏脂类的检测
取冷冻保存的血清,应用甘油三酯和胆固醇试剂盒在全自动生化分析仪Synchron CX7(Beckman)上进行检测。
1.5 应用放射免疫法测定激素代谢的变化
1.5.1 血清皮质醇(Cor)检测:检测步骤按照试剂盒说明书进行。A: 取8支离心管,分为4组,每组2支,分别标注非特异结合管(NSB)、零结合管(So)、标准管(S1-S6)、样本管(U); B: 向NSB管加入150 μL零标准,向So管加入50 μL零标准,向标准管和样本管分别加入50 μL相对应的标准品或样本; C: 所有试管中加入100 μL125I-皮质醇,再向除NSB离心管外的其他试管中加入100 μL皮质醇抗体,振荡摇匀; D: 37 ℃温育1 h,然后4 ℃放置0.5 h。再向所有的试管中加入1 000 μL分离剂,振荡摇匀; E: 4 ℃放置15 min; F: 检测放射性计数,取其平均计数为总放射性计数。3 500 rpm离心20 min,弃上清,测沉淀放射性计数。结果计算:按下列公式分别计算出NSB、So、S1-S6及U各管的结合率:
B为每组试管计数的均值,B0为零结合管计数的均值,NSB为非特异管两管计数的均值。非特异结合率和最大结合率分别为: NSB/T,B0-NSB/T,其中T、B0、NSB为扣除本底的净计数。以各标准管的B/B0%为纵坐标,以皮质醇标准浓度为模坐标,在Logit-Log双对数坐标纸上做标准曲线。根据待测样本的结合率,从标准曲线上查出相应的皮质醇含量。
1.5.2 血清醛固酮(ALD)检测:检测步骤按照试剂盒说明书进行。操作基本步骤同上,本方法用ANS为阻断剂,使标本内的醛固酮呈游离状态存在。
1.5.3 免疫活性胰岛素(IRI)检测:检测步骤按照试剂盒说明书进行。试剂配制方法:胰岛素标准品S0用1.0 mL蒸馏水溶解,其他试剂用0.5 mL蒸馏水溶解,充分混匀使用,浓度分别为0、5、10、20、40、80和160 mIU/L(相当于0、0.0323、0.0626、0.125、0.25、0.5及1.0 nmol/L)。抗胰岛素抗体用10 mL蒸馏水溶解,充分混匀后使用。125I单碘胰岛素用10 mL蒸馏水,充分混匀后使用。质控血清分别用0.5 mL蒸馏水溶解,充分混匀。与样品一样投入测定。复合分离剂用前必须充分振摇,并且边摇边加。操作程序同上。


1.6 统计学处理
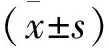
2 结 果
2.1 去交感神经状态对脂代谢的影响

图1 不同处理组7 d后血清中TG的含量
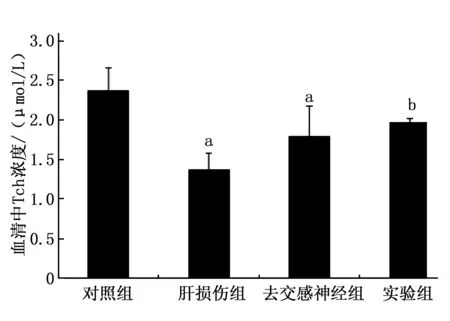
图2 不同处理组7 d后血清中Tch的含量
2.1.1 各组TG的检测结果:肝损伤模型组血清TG为(0.87±0.09) μmol/L,较对照组(1.22±0.18) μmol/L明显下降,差异有统计学意义(P<0.05); 实验组TG(1.05±0.04) μmol/L与肝损伤模型组相比有上升趋势;单纯去交感神经组血清TG含量与对照组相比无明显差异。见图1。
2.1.2 各组Tch的检测结果:肝损伤模型组Tch(1.47±0.21) μmol/L,去交感神经组Tch(1.79±0.38) μmol/L较对照组(2.37±0.29) μmol/L相比明显下降(P<0.05),实验组Tch(1.96±0.06) μmol/L较肝损伤组有明显上升,差异具有统计学意义(P<0.05)。见图2。
2.2 去交感神经状态对激素代谢的影响
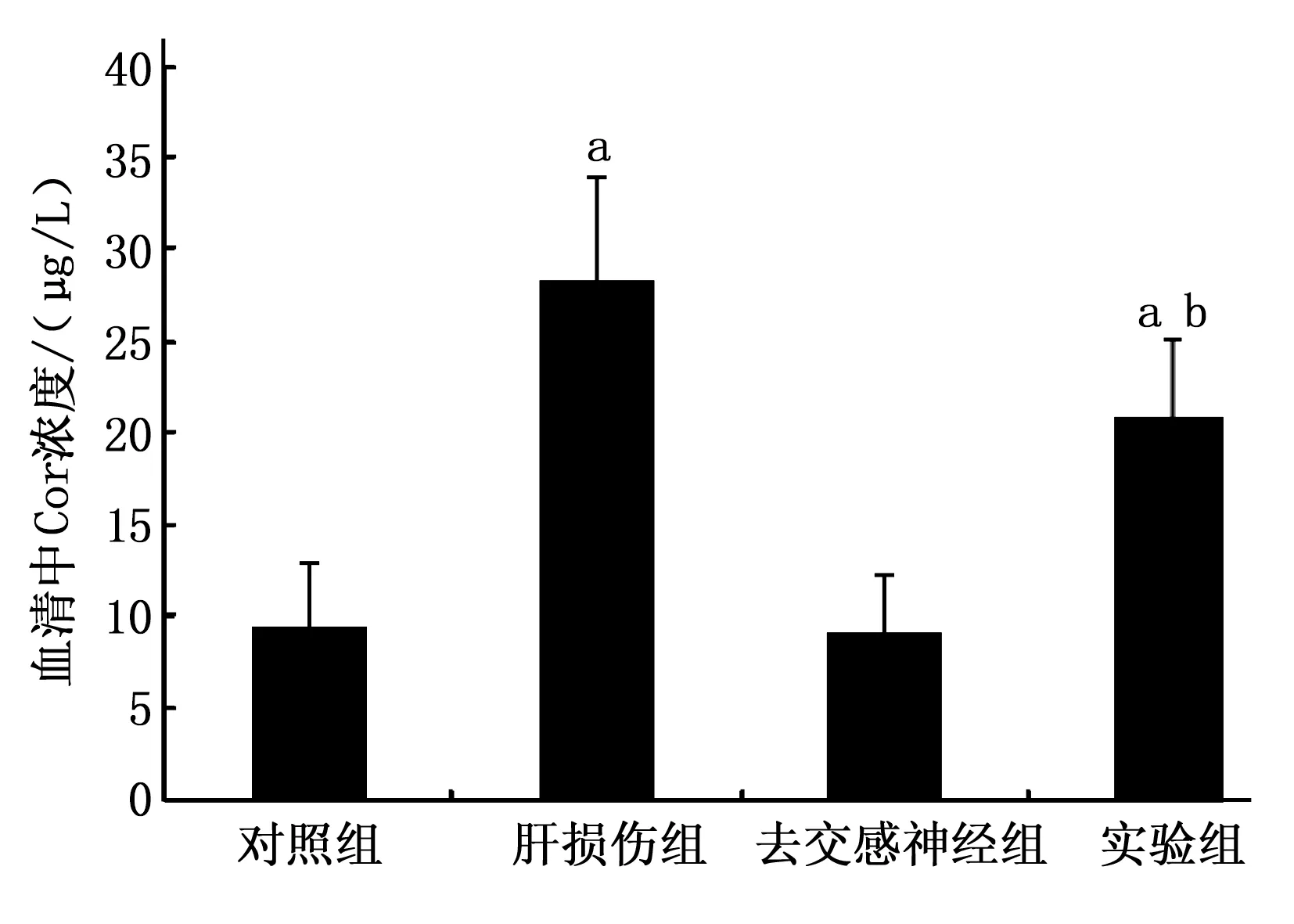
图3 不同处理组7 d后血清中Cor的含量

图4 不同处理组7 d后血清中ALD的含量
2.2.1 去交感神经对Cor代谢影响的检测结果:实验组和肝损伤模型组的Cor分别为(20.9±4.2) μg/L和(28.3±5.6) μg/L,实验组血清Cor含量较肝损伤模型组明显下降,差异有统计学意义(P<0.05; 但较对照组(9.5±3.4) μg/L,明显升高(P<0.05); 而去交感神经组Cor(9.1±3.2) μg/L与对照组相比无差异。见图3。
2.2.2 去交感神经对ALD代谢影响的检测结果:实验组和肝损伤模型组的ALD分别为(471.73±72.9) ng/L和(651.6±82.3) ng/L,实验组血清ALD含量较肝损伤模型组明显下降,差异有统计学意义(P<0.05); 但较对照组(196.5±47.3) ng/L明显升高(P<0.05); 而去交感神经组ALD(209.1±47.5) ng/L与对照组相比无差异。见图4。
2.2.3 去交感神经对IRI代谢影响的检测结果:对于免疫活性胰岛素(IRI),实验组(29.39±7.67) mIU/L、去交感神经组(18.79±4.69) mIU/L和肝损伤模型组的(20.37±5.57) mIU/L与对照组(12.48±3.03) mIU/L比较均明显升高(P<0.05),而且实验组IRI较肝损伤组与去交感神经组均明显升高,差异有统计学差异(P<0.05)。见图5。
3 讨 论
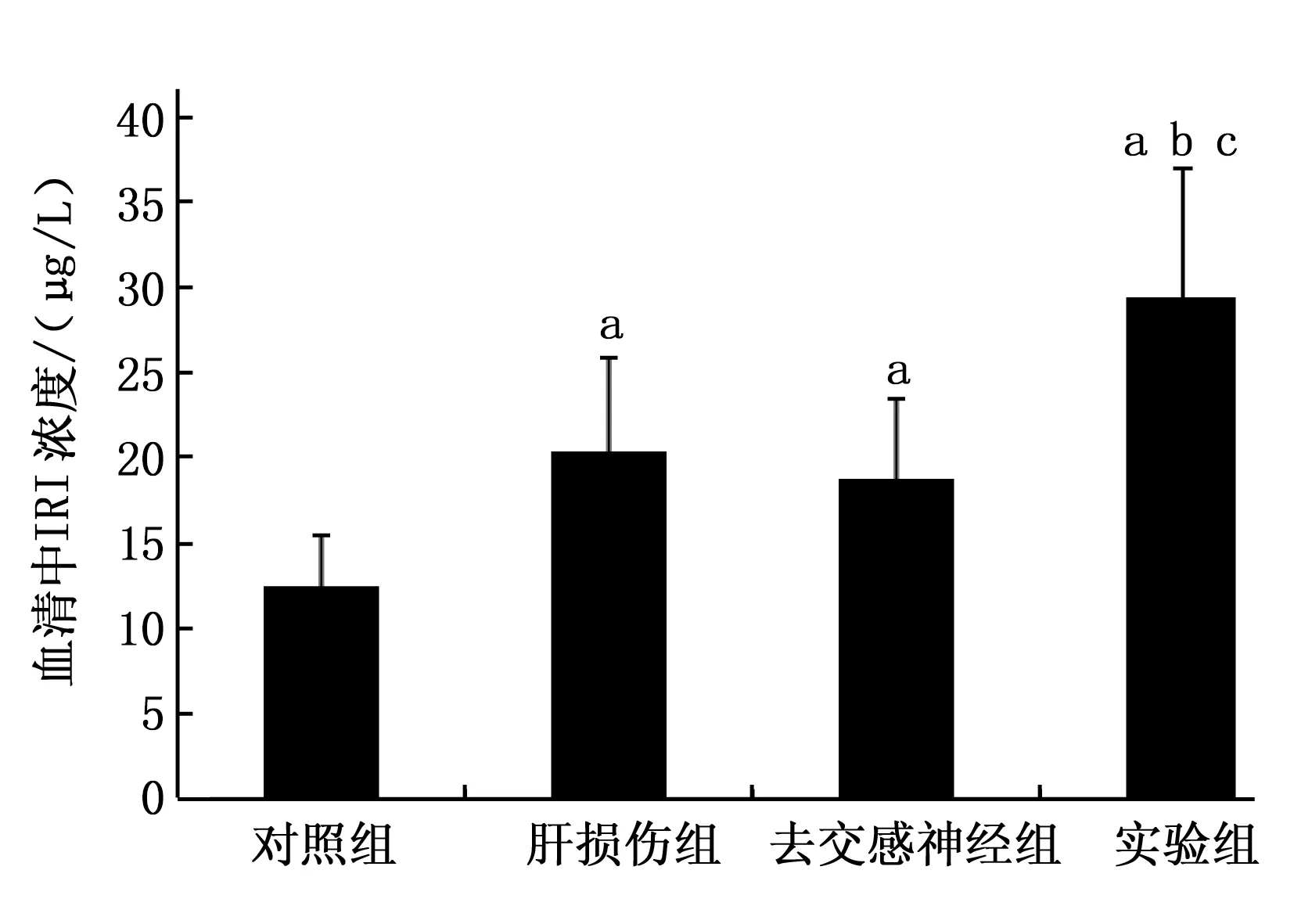
图5 不同处理组7 d后血清中IRI的含量
肝脏是人体最重要的器官之一,具有多种多样的代谢功能,对糖、脂类、蛋白质、维生素和激素等的代谢均有重要作用[12]。肝脏功能受体液和神经2大作用方式的调节,已有文献报道,刺激肝脏交感神经可引起代谢方面的多种变化[13-14]。作者前期的研究以及相关报道证实,刺激肝脏交感神经可引起血糖升高和肝血流量的减少[15-16]。Martin等[17]研究证实,刺激游离的灌流肝脏交感神经可引起乳酸释放,尿酸盐和尿素的形成,减少酮体和尿酸的释放和氨的摄取。另外,刺激交感神经还可引起肝内血流动力学的改变,使肝窦闭塞等。总之,神经调节对肝脏的各项功能有着重要的调节作用。在CCl4引起的急性肝损伤的情况下,Iwai等[18]报道交感神经兴奋可加重肝损伤的程度。夏锋等[8]研究报道证实了化学性去交感神经有利于减轻CCl4致肝损伤程度,促进肝脏蛋白的合成、胆红素的代谢、能量的代谢和排泄功能,同时也使低血钾程度减轻。本研究中化学性去除交感神经能改善CCl4所致急性肝损伤时肝脏对脂类的合成功能和对激素的灭活功能,为证实去除交感神经能改善急性肝损伤时肝脏代谢等生理功能提供了更多佐证,这与已有的研究结果一致。
肝脏是脂类代谢的主要器官,脂肪不断地被水解成甘油和脂肪酸而进入血液,进而运送至肝脏进行代谢。在肝脏病变严重时,肝脏对甘油三酯的合成功能受损,不能将摄入的脂肪酸合成甘油三酯输出,导致血浆脂肪酸的含量增高,而甘油三酯反而下降[19]。本研究中,急性肝损伤后血清甘油三酯和胆固醇均下降,是由于CCl4造成急性肝损伤,使肝脏对脂类合成的功能受损,使得转运出肝脏的脂类减少。单纯去除交感神经后,甘油三酯变化与对照组无差异,而胆固醇较对照组明显下降,可能是由于儿茶酚胺可增加β-羟-β甲-戊二酸单酰CoA还原酶(HMGCoA还原酶)的合成,而该酶是胆固醇合成的限速酶,去除交感神经后,减少了儿茶酚胺类激素的含量,使得HMGCoA还原酶合成减少,最终使得胆固醇合成降低。在急性肝损伤的基础上去除交感神经,使血液中甘油三酯、胆固醇含量较单纯肝损伤组有所上升,是由于急性肝损伤后去除交感神经能够改善肝脏功能,促进其合成功能有所恢复。
肝脏是降解灭活类固醇激素的主要器官。皮质醇和醛固酮等皮质激素在肝细胞内主要经过还原、羟化、侧链裂解、氧化及结合酯化5个反应步骤而失去基本的活化基团,经胆汁及尿液排出。当肝细胞功能受损时则激素的降解灭活过程受阻,从而使皮质激素浓度升高。本研究中单纯CCl4致肝损伤组皮质醇和醛固酮的含量较对照组均明显升高,这是由于肝损伤后,激素在肝细胞降解灭活的过程受到影响,皮质激素不能在肝脏灭活,使得皮质激素的浓度升高。实验组中皮质激素含量较肝损伤组明显下降,则是由于去除交感神经后,肝脏的功能得到一定程度的恢复,肝细胞对皮质激素的灭活作用也得到了改善。
本实验中肝损伤组胰岛素明显升高,是由于胰岛素的灭活也在肝脏内完成,肝损伤后灭活作用减弱,使得胰岛素浓度升高。同时胰岛素的分泌亦受到自主的神经调节,α肾上腺素能兴奋剂肾上腺素和去甲肾上腺素等能够抑制胰岛素的分泌,因此实验中去除交感神经亦有可能去除了调控胰腺的交感神经,使抑制胰岛素分泌的因素减少,最终使胰岛素含量较对照组明显升高,且在急性肝损伤后,灭活作用的减弱和胰岛素分泌的增多,使实验组胰岛素浓度明显升高。
综上所述,本实验通过构建急性肝损伤模型和化学性去交感神经模型,了解化学性去交感神经对急性肝损伤后大鼠肝脏脂类和激素代谢的影响,结果证实:去交感神经状态能够促进肝损伤时肝脏脂类合成功能和激素代谢功能的改善,促进急性肝损伤时肝脏功能的恢复。
[1]Dicostanzo C A,Dardevet D P,Neal D W,et al.Role of the hepatic sympathetic nerves in the regulation of net hepatic glucose uptake and the mediation of the portal glucose signal[J].Am J Physiol Endocrinol Metab,2006,290(1): E9.
[2]Puschel G P.Control of hepatocyte metabolism by sympathetic and parasympathetic hepatic nerves[J].Anat Rec A Discov Mol Cell Evol Biol,2004,280(1): 8548.
[3]Andrews W H,Orbach J.Sodium receptors activating some nerves of perfused rabbit livers[J].Am J Physiol,1974,227(6): 1273.
[4]Geary N,Sauter J L,Noh U.Glucagon acts in the liver to control spontaneous meal size in rats[J].Am J Physiol,1993,264(1 Pt 2): R116.
[5]Henderson J M,Mackay G J,Lumsden A B,et al.The effect of liver denervation on hepatic hemodynamics during hypovolemic shock in swine[J].Hepatology,1992,15(1): 130.
[6]Nogueiras R,Tschop M H,Zigman J M.Central nervous system regulation of energy metabolism: ghrelin versus leptin[J].Ann N Y Acad Sci,2008,1126(14/19): 125.
[7]Moghimzadeh E,Nobin A,Rosengren E.Adrenergic nerves and receptors in the liver[J].Brain Res Bull,1982,9(1/6): 709.
[8]夏锋,何振平,李昆,等.去交感神经状态对大鼠肝功能的影响[J].第三军医大学学报,2004,26(3): 230.
[9]Xia F,He Z,Li K,et al.Evaluation of the role of sympathetic denervation on hepatic function[J].Hepatol Res,2006,36(4): 259.
[10]Lackovicova L,Banovska L,Bundzikova J,et al.Chemical sympathectomy suppresses fibrosarcoma development and improves survival of tumor-bearing rats[J].Neoplasma,2011,58(5): 424.
[11]夏锋,何振平,董家鸿,等.去交感神经状态对肝切除后肝再生的影响[J].第三军医大学学报,2001,23(4): 416.[12]Lautt W W.Afferent and efferent neural roles in liver function[J].Prog Neurobiol,1983,21(4): 323.
[13]NParfenova N S.The liver and the nervous system[J].Biomed Khim,2004,50(2): 136.
[14]Chida Y,Sudo N,Takaki A,et al.The hepatic sympathetic nerve plays a critical role in preventing Fas induced liver injury in mice[J].Gut,2005,54(7): 994.
[15]Ramnanan C J,Edgerton D S,Cherrington A D.Evidence against a physiologic role for acute changes in CNS insulin action in the rapid regulation of hepatic glucose production[J].Cell Metab,2012,15(5): 656.
[16]Perseghin G,Regalia E,Battezzati A,et al.Regulation of glucose homeostasis in humans with denervated livers[J].J Clin Invest,1997,100(4): 931.
[17]Martin D D,Cincotta A H,Meier A H.Hepatic vagotomy abolishes the circadian rhythm of lipogenic responsiveness to insulin and reduces fat stores in hamsters[J].Neuroendocrinology,1990,52(1): 9.
[18]Iwai M,Shimazu T.Exaggeration of acute liver damage by hepatic sympathetic nerves and circulating catecholamines in perfused liver of rats treated with D-galactosamine[J].Hepatology,1996,23(3): 524.
[19]Pinzani M,Failli P,Ruocco C,et al.Fat-storing cells as liver-specific pericytes.Spatial dynamics of agonist-stimulated intracellular calcium transients [J].J Clin Invest,1992,90(2): 642.

