江苏省南京地区肺炎链球菌对β-内酰胺类抗生素耐药及传播机制
丁晶晶,苗立云,李 燕,蔡后荣
(南京大学医学院附属鼓楼医院 呼吸科,江苏 南京,210008)
肺炎链球菌是儿童和成人社区获得性肺炎的最重要病原菌,同时也是引起中耳炎、鼻窦炎、脑膜炎的主要病原菌。长期以来,青霉素等-内酰胺类抗生素是治疗肺炎链球菌感染的首选抗生素。但近年来,耐青霉素肺炎链球菌逐年增多,亚洲地区耐药情况尤为严重,已引起临床的广泛关注。肺炎链球菌对-内酰胺类抗生素耐药机制主要通过青霉素结合蛋白(PBP)改变而产生,与-内酰胺类抗生素耐药性关系密切的有pbp1A、pbp2B和pbp2X基因,pbp2B和pbp2X与低水平耐药相关,而pbp1A的改变导致高水平耐药,pbp2B和pbp2X分别是青霉素和头孢菌素的第一靶位[1-3]。由于肺炎链球菌对β-内酰胺类抗生素的耐药率逐年增加且存在明显的地区差异,而南京地区尚未有相关的大型流行病学调查,因此本研究探讨南京地区肺炎链球菌临床分离株对β-内酰胺类抗生素的耐药性及耐药机制,了解其主要突变类型及耐药传播方式,为今后快速诊断耐药株及阻止高耐株的传播打下基础。
1 材料与方法
1.1 实验试剂和仪器
optochin纸片(OXOID,UK),Mueller-Hinton培养基(OXOID,UK),哥伦比亚培养基(OXOID,UK),Taq聚合酶(TAKARA,Japan),HinfI 内切酶(TAKARA,Japan),VIABANKTM菌种保存盒(MW&E,UK),细菌基因组DNA提取试剂盒(AXGEN,USA),高速冷冻离心机Z-303K(HERMLE,Germany),PCR扩增仪PTC-100TM(MJ Research Inc,USA),稳压稳流电泳仪 3000Xi (Biorad,USA),捷达凝胶成像系统(江苏捷达科技发展有限公司),H.SWX-600BS数显电热恒温水浴箱(上海新苗医疗器械公司),所有PCR引物均由invitrogen公司合成提供。药品来源:青霉素(山东鲁杭)、头孢呋辛钠(葛兰素史克)、头孢噻肟(苏州二叶)、头孢曲松钠(台湾泛生)、头孢吡肟(施贵宝)、阿莫西林(苏州二叶)、红霉素(大连美罗大)、阿奇霉素(辉瑞)、左旋氧氟沙星(浙江医药)、莫西沙星(拜耳)、美罗培南(柱友制药)、万古霉素(浙江医药)、替加环素(惠氏制药)、利奈唑胺(辉瑞制药)。
1.2 菌株的采集、分离和鉴定
收集2010年3月—2012年6月南京地区7家医院(南京市鼓楼医院,南京军区南京总医院,南京市儿童医院,江苏省人民医院,南京医科大学第二附属医院,东南大学附属中大医院,南京市第一医院)微生物室分离的肺炎链球菌菌株共130株,其标本来源主要为痰、血、脑脊液、鼻咽拭子、中耳分泌物、眼分泌物、脓汁、气管抽吸物等。标本采集1 h内接种于哥伦比亚琼脂血平板,置5% CO2培养箱内37 ℃孵育,分离出的菌株用optochin纸片和胆汁溶菌试验鉴定为肺炎链球菌,菌株于VIABANKTM菌种保存管中-70 ℃冰冻保存。
1.3 抗生素敏感性检测
肺炎链球菌对抗生素敏感性的检测采用美国临床和实验室标准协会(CLSI)推荐的琼脂稀释法,共有14种抗生素进行了最低抑菌浓度(MIC)的测定:青霉素、头孢呋辛、头孢噻肟、头孢曲松、头孢吡肟、阿莫西林、红霉素、阿奇霉素、左旋氧氟沙星、莫西沙星、美罗培南、万古霉素、替加环素、利奈唑胺。采用含5%脱纤维羊血的M-H药敏培养基,37 ℃、5% CO2条件下孵育18~24 h后观察结果,标准菌株ATCC 49619跟随全程作为质量控制。结果判定依据2004年NCCLS标准,替加环素、利奈唑胺按照FDA2005诊断标准进行判定。
1.4 β-内酰胺类耐药相关基因的扩增及测序
肺炎链球菌基因组DNA的提取按照Axygen细菌基因组DNA提取试剂盒的说明进行,所得产物-20 ℃保存作为PCR反应的模板。β-内酰胺类耐药相关基因pbp1A、pbp2B、pbp2X的扩增引物见表1,扩增体系均为: 25 ng DNA模板,2 mM MgCl2,200 μM dNTP,1.5 U Taq 聚合酶,总反应体积为25 μL。pbp 基因的反应条件为: 94℃预变性5 min,94 ℃变性1 min,55℃退火1 min,72 ℃延伸(pbp1A 2.5 min、pbp2B1.5 min、pbp2X 2 min),循环33次后再延伸7 min。murM基因的反应条件为: 94 ℃预变性5 min,94 ℃变性40 s,52 ℃退火40 s,72 ℃延伸1 min,循环30次。扩增产物经纯化后交由上海Invitrogen公司,采用ABI PRISMTM 3730自动测序分析仪进行测序分析,测序结果通过DNASIS软件和在线BLAST软件进行比对分析(http://www.ncbi.nlm.nih.gov)。
1.5 pbp指纹图谱分型
前面所得到的pbp1A、pbp2B、pbp2X扩增产物,片段长度分别为2.4 kb、1.5 kb、2 kb,取6 μL经1%琼脂糖凝胶电泳,确认无非特异性条带后,进行限制性内切酶长度多态性分析(RFLP),所得图谱即pbp指纹图谱[4]可用作菌株同源性比较。取10 μL扩增产物加入1 μL(10 U) HinfI内切酶,37 ℃孵育4 h,取消化产物进行1.5%琼脂糖凝胶电泳,紫外光下成像,判断结果。
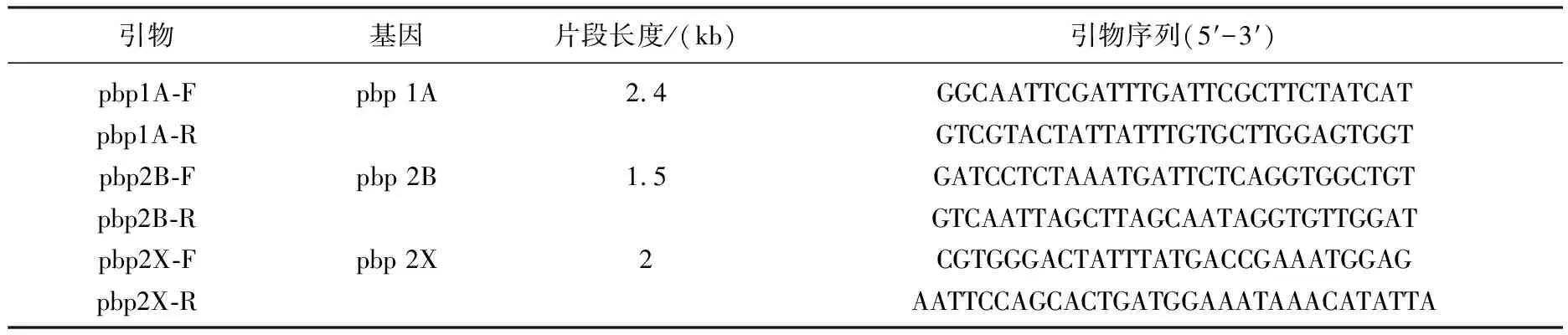
表1 β-内酰胺类耐药相关基因扩增引物序列
1.6 统计分析
应用WHONET 5.0建立药敏检测数据库并进行药敏数据分析,应用统计软件SPSS 13.0对率进行χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般情况
分离到肺炎链球菌患者的主要疾病分布为急性支气管肺炎(n=80,61.5%)、肺炎(n=27,20.8%)、菌血症(n=7,5.4%)、中耳炎(n=7,5.4%)、上呼吸道感染(n=4,3.1%)、结膜炎(n=3,2.3%)、脑膜炎(n=2,1.5%)。患者中位年龄为3岁(1月~88岁),62.3%为男性,在34例成人患者中有27例(79.4%)合并有其他基础疾病:慢性肾病(20.6%),COPD(17.6%),肿瘤(14.7%),心血管疾病(11.8%),糖尿病(5.9%),脑血管疾病(2.9%),除肾脏病外其他激素服用者(5.9%)。
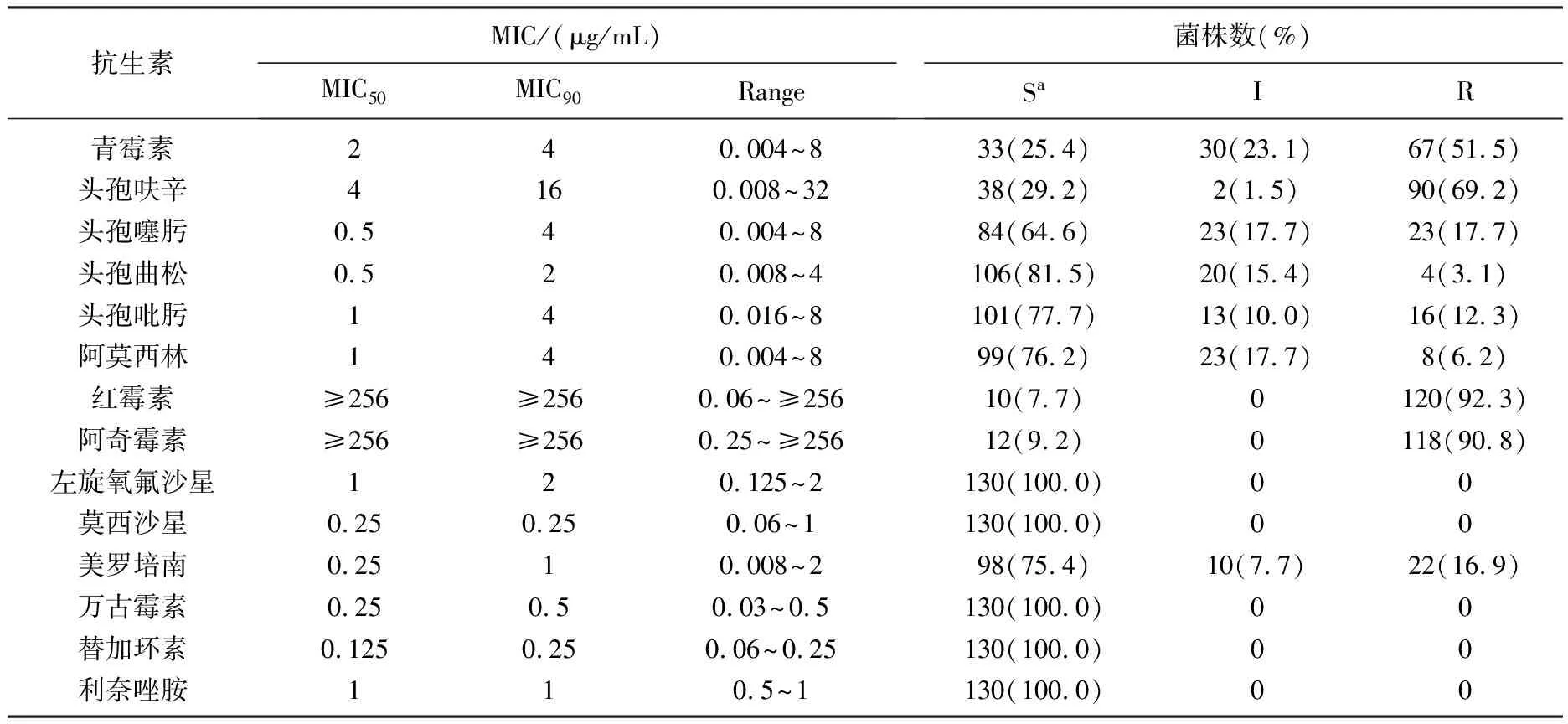
表2 130株肺炎链球菌对14种常用抗生素的敏感性检测
2.2 药敏结果及联合耐药情况
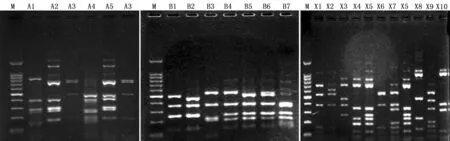
肺炎链球菌对14种常用抗生素的敏感性检测结果见表2表明,南京地区临床分离的肺炎链球菌青霉素不敏感率为74.6%,其中23.1%中介,51.5%耐药,MIC50和MIC90分别为2 μg/mL、4 μg/mL。在检测的4种头孢菌素中,头孢呋辛耐药率最高,为69.2%,且耐药水平较高,其MIC50、MIC90分别为2 μg/mL、4 μg/mL,头孢噻肟、头孢吡肟的耐药率也较高,分别为17.7%和12.3%。而在β-内酰胺类抗生素中,头孢曲松和阿莫西林有相对较好的敏感性,其耐药率分别为3.1%、6.2%。大环内酯类抗生素如红霉素、阿齐霉素均有很高的耐药率(92.3%、90.8%),且绝大多数菌株耐药水平≥256 μg/mL。本地区肺炎链球菌对喹诺酮类药物的敏感性较好。所有130株临床分离株对左氧氟沙星、莫西沙星、万古霉素、替加环素、利奈唑胺均敏感。然而,美罗培南的敏感性并不理想,中介率为7.7%,耐药率为16.9%。由于该研究中肺炎链球菌主要分离自儿童,将患者分成儿童组和成人组后发现,儿童分离株青霉素耐药率为65.6%,而成人分离株青霉素耐药率仅为11.8%,且儿童组MIC水平普遍高于成人组。作者将患者细分为4组(表3):学龄前儿童(0~3岁)、学龄儿童(4~14岁)、中青年(15~64岁)、老年(65~88岁),利用χ2检验比较各组耐药率、不敏感率的差异,学龄前儿童和学龄儿童、中青年和老年,其青霉素耐药率、不敏感率差异均无统计学意义。通过青霉素与其他β-内酰胺类抗生素MIC水平的相关性比较发现,在青霉素耐药株中,头孢呋辛、头孢噻肟、头孢曲松、头孢吡肟、阿莫西林和美罗培南的耐药率及耐药水平均显著高于青霉素敏感株。通过Spearman秩相关分析,青霉素与其他β-内酰胺类抗生素MIC水平呈正相关(0 表3 青霉素敏感性与患者年龄的关系 对3组pbp基因进行限制性内切酶长度多态性分析(RFLP),所得图谱作为肺炎链球菌pbp指纹图谱用于分析其同源性(图1)。本研究中pbp1A共得到5种谱型: A1~A5; pbp2B共得到7种谱型: B1~B7; pbp2X共得到10种谱型: X1~X10。在青霉素敏感株中,最常见的pbp1A谱型为A3,pbp2B中最常见的为B3型,而pbp2X中没有与青霉素敏感株密切相关的谱型,但与头孢曲松敏感株关系密切的是X5型。结合pbp指纹图谱,在β-内酰胺类抗生素耐药株中,最常见的耐药型为A1-B1-X1,共有25株。在8株阿莫西林耐药株中,有5株为A1-B1-X1型,且阿莫西林、青霉素、头孢曲松的MIC分别为8 μg/mL、4 μg/mL、4 μg/mL,这5株均来自儿童医院,分离时间间隔不超过15 d,可能为同一多耐药克隆株。其余阿莫西林高耐株的分子表型为A1-B2-X7、A2-B1-X6、A1-B5-X9。 (M,100bp marker; A1~A5: pbp1A; B1~B7: pbp 2B; X1~X10: pbp2X) 目前肺炎链球菌青霉素耐药较严重地区有[5-8]: ① 亚洲(韩国、日本、越南、泰国); ② 欧洲西部和南部(西班牙、法国、葡萄牙); ③ 欧洲中东部地区(匈牙利、罗马尼亚、比利时、土耳其); ④ 俄罗斯西北部; ⑤ 南非; ⑥ 巴布新几内亚; ⑦ 美国的阿拉斯加; ⑧ 美国东南部; ⑨ 南美。中国的肺炎链球菌青霉素耐药率也呈逐年上升趋势。刘又宁等[9]对国内7个城市12个中心的665例成人社区获得性肺炎患者进行调查,其中肺炎链球菌检出率为10.3%,青霉素中介株(PISP)占17.4%,耐药株(PRSP)占2.9%。王辉等[10]搜集2002—2003年共410株肺炎链球菌,PISP为23.9%,杭州最高占44.1%; PRSP平均占22.7%,上海最高占31.9%。本调查结果显示,南京地区临床分离株青霉素不敏感率为74.6%,显著高于其他城市,且其他β-内酰胺类抗生素如头孢呋辛、头孢噻肟的敏感率也并不理想,可能与此类抗生素的使用不当导致耐药株的筛选和传播有关。而该人群中使用头孢吡肟、美罗培南的患者并不多,但这2种抗生素也存在一定的耐药率,可能是由于药物结构相似导致了交叉耐药的出现。本地区的高耐药性可能与标本主要来自儿童有关。 本研究发现,从儿童分离的肺炎链球菌,其耐药率及耐药水平均明显高于成人,而以往报道的耐药相关危险因素[11]包括在日托中心或幼儿园等人口密集处、有基础疾病或入住康复中心的老年患者等。因此我们把患者分为学龄前儿童、学龄儿童、中青年、老年,但学龄前儿童与学龄儿童的耐药率并无显著差异,说明本地区儿童耐药率主要与用药习惯有关,而没有出现明显的幼儿园或学校内传播,中青年与老年的耐药率也无显著差异。Ronald等[12]在一项大样本多中心的研究中分析了年龄与肺炎链球菌耐药型的关系,结果表明:在≥65岁的人群中,对喹诺酮类抗生素的耐药率为4.9%,显著高于其他年龄组。 本研究中应用了pbp指纹图谱对肺炎链球菌菌株进行分型比较,发现大部分耐药株在基因组水平上无明显同源性,其耐药性主要通过点突变的累积和基因重组而获得,但有5株阿莫西林耐药株高度同源,可能为院内克隆传播。与点突变的累积效应类似,肺炎链球菌的重组突变是一个逐步完成的过程,通过多次基因重组,抗生素对该克隆的MIC超过一定折点值,便形成了耐药株。耐药克隆在地区间的播散更是全球PRSP流行的重要基础,ANSORP来自亚洲11个国家14家研究中心的数据显示,西班牙23F和台湾19F耐药克隆株在亚洲地区的多个国家存在,说明全球流行的耐药克隆株也在亚洲地区国家进行广泛的传播和繁殖[13]。目前,本地区尚未出现大规模耐药克隆株的传播,但有待进一步进行分子流行病学监测。 抗生素耐药菌株的传播和新疫苗的开发都需要肺炎链球菌的分子流行病学研究,分子生物学分型能提高分辨水平并提供整个基因组更详细的信息,在追查耐药菌株传播方面起着不可替代的作用。本研究中应用的pbp指纹图谱操作简单,对仪器要求不高,能够应用于普通临床微生物室的流行病学监测。除此之外,常用的肺炎链球菌分子分型方法还有脉冲场凝胶电泳[14](PFGE)和多位点序列分型[15-17](MLST),其中最为精确的是MLST,该法是通过7种看守基因的内部片段序列进行鉴别比较的,其优点在于查询方便,标准统一,分辨水平很高,有利于世界范围内肺炎链球菌的检测和流行病学调查。 [1]Nichol K A,Zhanel G G,Hoban D J.Penicillin-binding protein 1A,2B and 2X alterations in Canadian isolates of penicillin-resistant Streptococcus pneumoniae[J].Antimicrob Agents Chemother,2002,46: 3261. [2]Smith A M,Charles F,Orietta M,et al.Altered PBP 2A and its role in the development of penicillin,cefotaxime,and ceftriaxone resistance in a clinical isolate of Streptococcus pneumoniae[J].Antimicrob Agents Chemother,005,49: 2002. [3]Smith A M,Klugman K P.Amino acid mutations essential to production of an altered PBP2x conferring high-level β-lactam resistance in a clinical isolate of Streptococcus pneumoniae[J].Antimicro Agents Chemother,2005,49: 4622. [4]Mcgee L,Mcdougal L,Zhou J,et al.Nomenclature of major antimicrobial-resistant clones of Streptococcus pneumoniae defined by the pneumococcal molecular epidemiology network[J].J Clin Microbiol,2001,39: 2565. [5]Hoenigl M,Fussi P,Feierl G,et al.Antimicrobial resistance of Streptococcus pneumoniae in Southeast Austria,1997-2008[J].Int J Antimicrob Agents,2010,36(1): 24. [6] Pérez-Trallero E,Martín-Herrero JE,Mazón A,et al.Antimicrobial resistance among respiratory pathogens in Spain:latest data and changes over 11 years (1996-1997 to 2006-2007)[J].Antimicrob Agents Chemother,2010,54(7): 2953. [7]Kempf M,Baraduc R,Bonnabau H,et al.Epidemiology and antimicrobial resistance of Streptococcus pneumoniae in France in 2007:Data from the pneumococcus surveillance network[J].Microb Drug Resist,2011,17(1): 31. [8]Porcheret H,Barraud D,Bingen M,et al.Community- and non-community-acquired bacteremia: correlation between empiric antimicrobial therapy and susceptibility of micro-organisms isolated during 2007 in the Ile-de-France microbiologists network[J].Pathol Biol,2010,58(2): e7. [9]刘又宁,陈民钧,赵铁梅,等.中国城市成人社区获得性肺炎665例病原学多中心调查[J].中华结核和呼吸杂志,2006,29: 3. [10]王辉,俞云松,刘勇,等.2002~2003年中国社区呼吸道感染常见病原菌的耐药性监测[J].中华结核和呼吸杂志,2004,27: 155. [11]Lynch J P,Martinez F J.Clinical relevance of macrolide resistant Streptococcus pneumoniae for community acquired pneumonia[J].Clin Infect Dis,2002,34(suppl 1): s27. [12]Ronald N J,Biedenbach D J,Beach M L.Influence of patient age on the susceptibility patterns of Streptococcus pneumoniae isolates in North America (2000-2001): report from the SENTRY antimicrobial surveillance program[J].Diagn Microbiol Infect Dis,2003,46: 77. [13]Kasahar K,Maeda K,Mikasa K,et al.Clonal dissemination of macrolide-resistant and penicillin-susceptible serotype 3 and penicillin-resistant Taiwan 19F-14 and 23F-15 Streptococcus pneumoniae isolates in Japan: a pilot surveillance study[J].J Clin Microbiol,2005,43(4): 1640. [14]Lucinda M C.Application of molecular typing to the epidemiology of Streptococcus pneumoniae[J].J Clin Pathol,1998,51: 270. [15]Mark C E,Brian G S.A multilocus sequence typing scheme for Streptococcus pneumoniae: identification of clones associated with serious invasive disease[J].Microbiol,1998,144: 3049. [16]钱婧,薛莲,谢贵林,等.171株儿童侵袭性肺炎链球菌血清分型和多位点序列分型研究[J].临床儿科杂志,2012,30(2): 187. [17]Yanga F,Xu X G,Yang M J,et al.Antimicrobial susceptibility and molecular epidemiology of Streptococcus pneumoniae isolated from Shanghai,China[J].Int J Antimicrob Agents,2008,32(5): 386.
2.3 分子生物学分型
3 讨 论

