新型2-苯甲酰基苯并呋喃类似物的合成*
毛泽伟,郭文恋,姜 圆,饶高雄
(云南中医学院 药学院,云南 昆明 650500)
·快递论文·
新型2-苯甲酰基苯并呋喃类似物的合成*
毛泽伟,郭文恋,姜 圆,饶高雄
(云南中医学院 药学院,云南 昆明 650500)
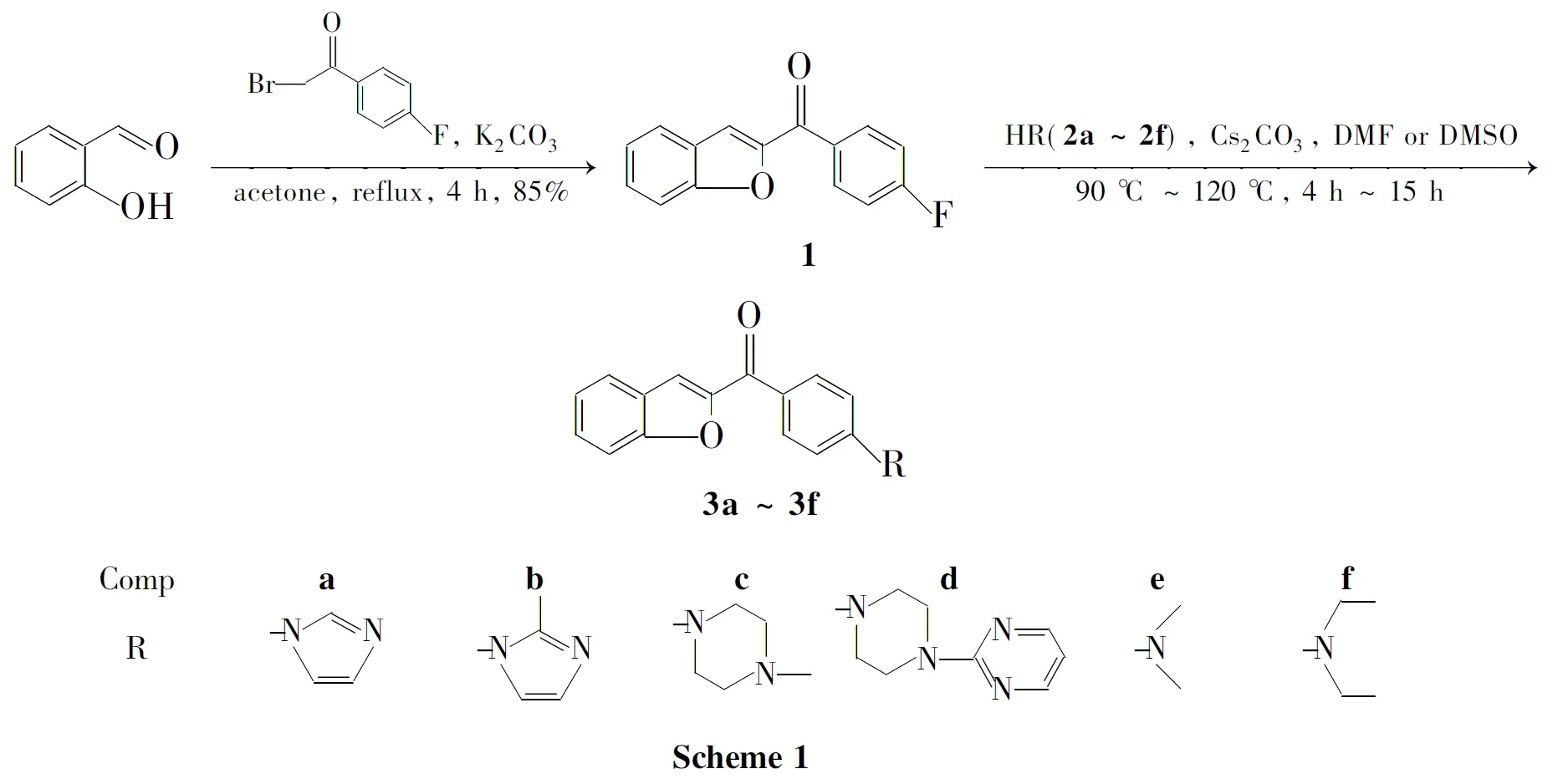
以水杨醛与2-溴-4′-氟苯乙酮为原料,经取代和分子内缩合反应合成了中间体2-苯甲酰基苯并呋喃(1);在碱性条件下,1分别与咪唑,N-甲基哌嗪和二乙胺等反应,合成了6个新型的2-苯甲酰基苯并呋喃含氮类似物,收率63%~82%,其结构经1H NMR,13C NMR,IR和HR-MS表征。
苯并呋喃;类似物;合成
苯并呋喃类化合物广泛存在于多种药用植物中,其良好的生理活性备受国内外学者关注。如Ailanthoidol具有抗肿瘤和抗病毒等活性[1],桑素A-H[2],Stemofurans A-K[3]和野茉莉醇[4]具有良好的抗菌和抗真菌等活性。目前,研究人员对苯并呋喃类化合物的合成及活性进行了大量研究[5-7]。
咪唑和哌嗪类化合物是非常重要的医药中间体,具有良好的抗菌和抗真菌活性,将该片段与苯并呋喃通过优势结构重组,可能得到具有更优药理活性的新化合物。
根据活性叠加原理,本文以水杨醛与2-溴-4′-氟苯乙酮为原料,经取代和分子内缩合反应合成了中间体2-苯甲酰基苯并呋喃(1);在碱性条件下,1分别与亲核试剂[HR(2a~2f)]反应,合成了6个新的2-苯甲酰基苯并呋喃含氮类似物(3a~3f,Scheme 1),收率63%~82%,其结构经1H NMR,13C NMR,IR和HR-MS表征,并对反应条件进行了优化。
1 实验部分
1.1 仪器与试剂
YANACO型熔点仪(温度未校正);Bruker AM-300型核磁共振仪(CDCl3为溶剂,TMS为内标);Bio-Rad FTS-135型红外光谱仪(KBr压片);AutoSpec-Premier-P776型质谱仪。
柱色谱硅胶和薄层色谱硅胶板,青岛海洋化工厂;其余所用试剂均为分析纯,使用前按标准程序纯化。
1.2 合成
(1)1的合成[8]
向圆底烧瓶中依次加入水杨醛2.44g(20mmol),K2CO35.52g(40mmol)及丙酮60mL,搅拌下于室温分批加入2-溴-4′-氟苯乙酮4.34g(20mmol),加毕,回流反应4h(TLC检测)。冷却至室温,真空浓缩,残余物加水80mL,搅拌20min。抽滤,滤饼依次用10%KOH溶液(20mL)和水(3×20mL)洗涤,干燥得黄褐色固体14.08g,收率85%,m.p.188.4℃~190.6℃;1H NMRδ:8.10~8.15(dd,J=5.7Hz,5.4Hz,2H),7.74(d,J=7.8Hz,1H),7.65(d,J=8.7Hz,1H),7.55(s,1H),7.51(d,J=7.8Hz,1H),7.32~7.37(dd,J=7.8Hz,7.2Hz,1H),7.19~7.26(dd,J=5.1Hz,8.7Hz,1H);13C NMRδ:182.75,164.00,155.97,152.14,133.37,132.25,132.13,128.49,126.92,124.10,123.35,116.40,115.93,115.64,112.56。
(2)3a~3f的合成(以3a为例)
向圆底烧瓶中依次加入11.20g(5mmol),Cs2CO33.26g(10mmol)及无水DMF 20mL,搅拌使其溶解;加入咪唑681g(10mmol),于110℃反应15h。冷却至室温,倒入50mL水中,搅拌20min。抽滤,滤饼用水(3×20mL)洗涤,干燥后经硅胶柱层析[洗脱剂:V(二氯甲烷)∶V(甲醇)=30∶1]纯化得黄色固体3a。
用类似的方法合成3b~3d。
3a,收率82%,m.p.181.4℃~183.8℃;1H NMRδ:8.26(d,J=8.4Hz,2H),8.01(s,1H),7.78(d,J=7.8Hz,1H),7.54~7.68(m,5H),7.36~7.41(m,2H),7.28(d,J=3.6Hz,1H);13C NMRδ:182.61,156.05,152.14,140.64,135.75,135.43,131.63,131.21,128.69,126.90,124.21,123.42,120.75,117.78,116.58,112.58;IRν: 3437,3101,1647,1606,1516,1473,1298,1114,1055,964,756cm-1;HR-MSm/z:Calcd for C18H13N2O2{[M+H]+} 289.3080,found 289.3067。
3b:淡黄色固体,收率78%,m.p.182.7℃~185.0℃;1H NMRδ:8.21(d,J=8.7Hz,2H),7.71(d,J=7.8Hz,1H),7.60~7.68(m,3H),7.47~7.57(m,2H),7.35~7.43(m,2H),7.22(d,J=4.8Hz,1H),2.31(s,3H);13C NMRδ:182.43,155.85,152.23,140.54,135.66,135.03,132.03,131.51,127.87,126.48,124.79,122.49,120.34,117.65,116.52,111.89,24.76。
3c:淡黄色固体,收率71%,m.p.166.7℃~168.6℃;1H NMRδ:8.11(d,J=8.7Hz,2H),7.73(d,J=7.8Hz,1H),7.65(d,J=8.4Hz,1H),7.51(s,1H),7.47(d,J=7.8Hz,1H),7.27~7.34(dd,J=7.5Hz,8.1Hz,1H),3.43(t,J=4.8Hz,4H),2.58(t,J=4.8Hz,4H),2.37(s,3H);13C NMRδ:182.31,155.67,154.23,153.11,131.94,127.67,127.16,126.78,123.74,123.01,114.78,113.42,112.44,54.73,47.18,46.16;IRν: 3435,2927,2364,1650,1600,1548,1517,1450,1377,1296,1253,1174,964,744cm-1;HR-MSm/z:Calcd for C20H20N2O2[M+] 320.1525,found 320.1509。
3d:黄褐色固体,收率72%,m.p.203.6℃~205.3℃;1H NMRδ:8.36(d,J=4.8Hz,2H),8.13(d,J=8.7Hz,2H),7.73(d,J=7.8Hz,1H),7.64(d,J=8.4Hz,1H),7.51(s,1H),7.49(t,J=7.5Hz,1H),7.26~7.34(dd,J=7.5Hz,7.8Hz,1H),6.99(d,J=8.7Hz,2H),6.56(t,J=4.8Hz,1H),4.03(t,J=5.1Hz,4H),3.53( t,J=5.4Hz,4H);13C NMRδ:182.22,161.56,157.80,155.69,154.12,153.20,131.98,127.65,127.17,127.00,123.73,122.99,114.70,113.47,112.41,110.37,47.05,43.24;IRν: 3454,2854,1612,1587,1544,1498,1448,1392,1359,1313,1232,1172,968,740cm-1。
(2)3e和3f的合成
向圆底烧瓶中依次加入11.20g(5mmol),Cs2CO33.26g(10mmol)及无水DMSO 20mL,搅拌使其溶解;加入二甲胺(2e)水溶液5mL,于90℃~100℃密封反应4h~8h。冷却至室温,倒入50mL水中,搅拌20min。抽滤,滤饼用水(3×20mL)洗涤,干燥后经硅胶柱层析[洗脱剂:V(二氯甲烷)∶V(甲醇)=50∶1]纯化得淡红色黏稠物3e,收率63%;1H NMRδ:8.12(d,J=8.4Hz,2H),7.73(d,J=7.8Hz,1H),7.63(d,J=8.1Hz,1H),7.44(s,1H),7.40(d,J=7.5Hz,1H),7.30(d,J=5.4Hz,1H),6.75(d,J=9.0Hz,2H),3.43(s,6H);13C NMRδ:181.62,155.51,152.78,151.63,131.59,127.42,123.04,123.05,113.34,112.02,110.04,43.92。
以二乙胺(2mL)替代二甲胺水溶液,用类似的方法合成3f。
3f:红色黏稠物,收率76%;1H NMRδ:8.11(d,J=9.0Hz,2H),7.72(d,J=7.8Hz,1H),7.64(d,J=8.4Hz,1H),7.42~7.49(m,2H),7.26~7.33(dd,J=7.5Hz,5.4Hz,1H),6.72(d,J=9.0Hz,2H),3.49(q,J=7.2Hz,4H),1.25(t,J=7.2Hz,6H);13C NMRδ:181.72,155.55,153.60,151.44,132.51,127.29,123.59,122.85,113.98,112.35,110.33,44.62,12.55;IRν: 3427,2972,1629,1589,1527,1469,1440,1408,1352,1323,1274,1180,1153,1076,968,829,754cm-1;HR-MSm/z:Calcd for C19H19NO2[M+] 293.1416,found 293.1403。
2 结果与讨论
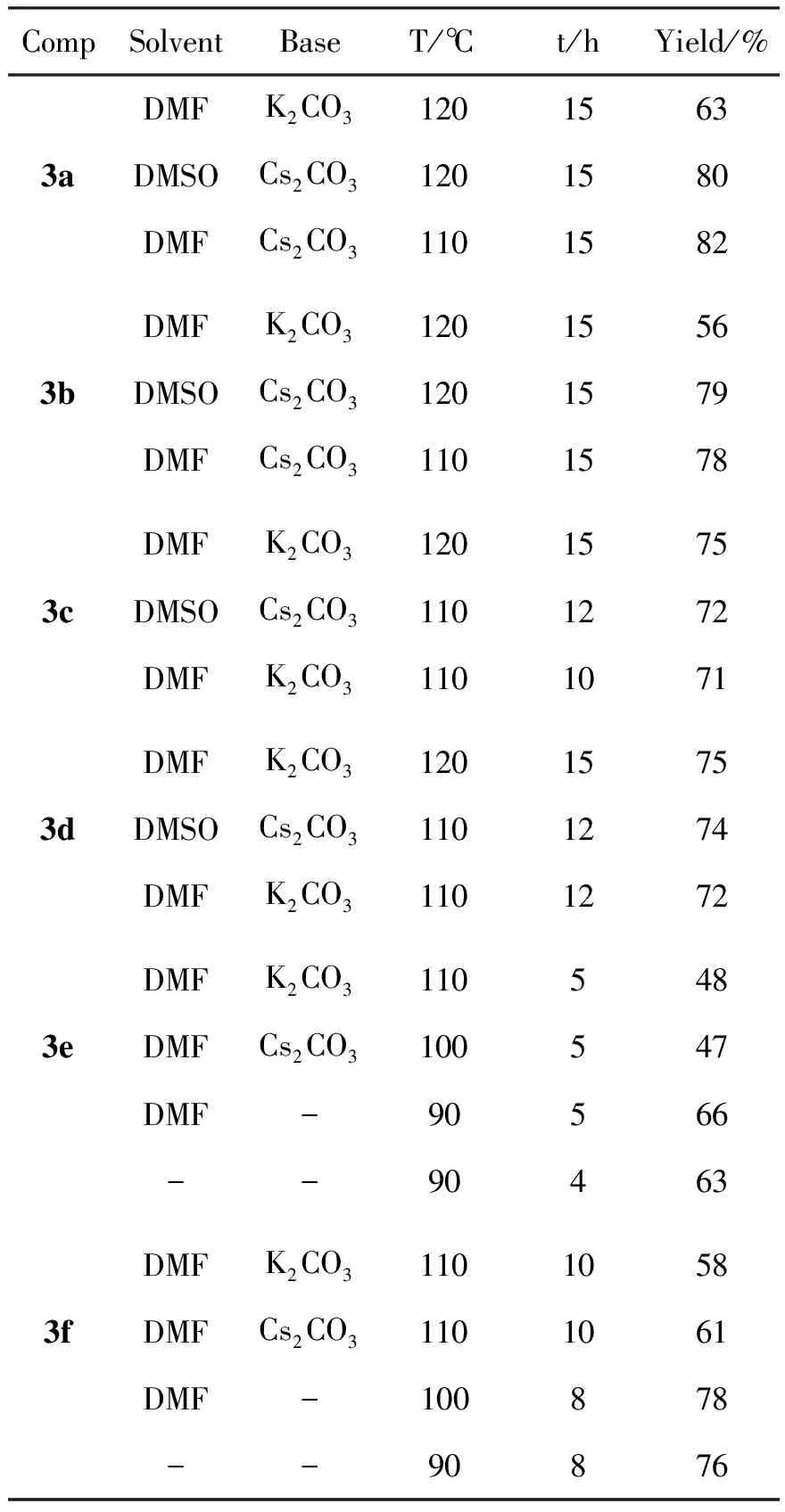
表 1 3a~3f合成条件优化Table 1 Process opimization of 3a~3f
为优化反应条件,考察了溶剂、碱及温度对3a~3f收率的影响,结果见表1。由表1可见,以DMF或DMSO作溶剂,收率变化不大;以Cs2CO3为碱时,3a和3b的收率明显高于K2CO3;3c和3d的收率受碱和温度的影响均较小。
在合成3e和3f时,由于二甲胺(2e)和二乙胺(2f)沸点较低,加热时易挥发,反应温度和时间对其收率影响较大,在无碱,90℃~100℃密封反应4h~8h产率较高。
3 结论
合成了6个新型的2-苯甲酰基苯并呋喃含氮类似物3a~3f,该方法操作简便,收率较高,产物易纯化。
含氮基团的引入可能会提高化合物的生物活性,为开展该类化合物的衍生化研究提供了一个新的思路。
[1] Sheen W S,Tsai I L,Teng C M,etal.Nor-neolignan and phenyl propanoid from zanthoxylum ailanthoides[J].Phytochemistry,1994,36:213-215
[2] Takasugi M,Nagao S,Masamune T,etal. Structure of moracin A and B,new phytoalexins from diseased mulberry[J].Tetrahedron Lett,1978,19:797-798
[3] Pacher T,Seger C,Engelmeier D,etal.Antifungal stilbenoids from stemona collinsae[J].J Nat Prod,2002,65:820-827
[4] Mendonca Pauletti P M,Araújo A R,Young M C,etal.Nor-lignans from the leaves of styrax ferrugineus (styracaceae)with antibacterial and antifungal activity[J].Phytochemistry,2000,55:597-601
[5] Pieter L,Dyck S V,Gao M,etal.Synthesis and biological evaluation of dihydrobenzofuran lignans and related compounds as potential antitumor agents that inhibit tubulin polymerization[J].J Med Chem,1999,42:5475-5481
[6] 王 宝,赖宜生,张奕华.苯并呋喃类化合物的生物活性及构效关系[J].药学进展,2008,32(8):351-356
[7] Romeo R,Pier G,Taradas S,etal.Synthesis and biological evaluation of 2-(3′,4′,5′-trimethoxybenzoyl)-3-N,N-dimethylaminobenzo[b]furan derivatives as inhibitors of tubulin polymerization[J].Bioorg Med Chem,2008,16:8419-8426.
[8] Gullapalli K,Mogilisetti P,Ragam R,etal.An expedient synthesis of enantioenriched substituted 2-benzofuryl arylcarbinols via tandem rap-stoermer and asymmetric transfer hydrogenation reactions[J].Tetrahedron,2010,66:9814-9818.
SynthesisofNovel2-benzoylBenzo[b]furanDerivatives
MAO Ze-wei,GUO Wen-lian,JIANG Yuan,RAO Gao-xiong
(School of Pharmacy,Yunnan University of Traditional Chinese Medicine,Kunming 650500,China)
2-Benzoyl benzo[b] furan(1)was prepared by the substitution and intra-molecular condensation reaction of salicylaldehyde with 2-bromo-4-fluoroacetophenone.Six novel 2-benzoyl benzo[b]furan derivatives,in yield of 63%~82%,were synthesized by the reaction of1with imidazole,N-methylpipe razine,secondary amines and so on,respectively.The structures were characterized by IR,1H NMR,13C NMR,IR and HR-MS.
benzo[b]furan;derivative;synthesis
2014-04-22
云南省应用基础研究计划项目(2013FZ088)
毛泽伟(1981-),男,汉族,湖北汉川人,讲师,主要从事药物化学的研究。E-mail:ydmason@163.com
饶高雄,教授,E-mail:rao13987124569@qq.com
O625.42;O622.6
A
1005-1511(2014)06-0785-04

