卵巢癌组织高迁移率族蛋白B1的表达及临床意义
智华 马海燕 曲瑞华
·论著·
卵巢癌组织高迁移率族蛋白B1的表达及临床意义
智华 马海燕 曲瑞华
目的观察卵巢癌组织高迁移率族蛋白B1(high mobility group box-1,HMGB1)的表达及临床意义。方法采用免疫组织化学SP法检测40例卵巢癌、60例卵巢良性肿瘤及30例正常卵巢组织HMGB1的表达水平。另选取卵巢癌SKOV3、A2780、3AO细胞系,采用免疫细胞化学检测HMGB1表达水平。结果与卵巢良性肿瘤及正常卵巢组织比较,卵巢癌组织HMGB1表达水平显著增高(P<0.05);且其表达与卵巢癌病理分级、临床分期、淋巴结转移状况有关(P<0.05),而与组织学类型无关。卵巢癌SKOV3、A2780、3AO细胞均表达HMGB1,表达水平差异无统计学意义(P>0.05)。结论HMGB1在卵巢癌组织表达上调,这可能参与了卵巢癌的发生发展、侵袭转移。
卵巢癌;高迁移率族蛋白B1;免疫组织化学
研究显示,卵巢癌的病死率位居妇科恶性肿瘤首位,具有易于播散、转移和复发率高的特点[1,2]。高迁移率族蛋白B1(high mobility group box-1,HMGB1)是一种广泛存在于真核细胞内、与染色体结合的非组蛋白。近来研究发现HMGB1作为一种肿瘤转移促进基因,在多种恶性肿瘤组织表达上调,参与肿瘤的发生发展、侵袭转移过程[3,4]。但目前有关卵巢癌组织HMGB1表达的报道尚不多见。本研究采用免疫组织化学SP法检测卵巢癌、卵巢良性肿瘤及正常卵巢组织HMGB1的表达状况,为阐明卵巢癌的发病机制及治疗提供科学依据。
1 资料与方法
1.1 一般资料 选取张家口市第五医院2011年4月至2012年10月期间手术切除的卵巢肿瘤组织标本100例,术后经病理确诊为卵巢癌40例(卵巢癌组),卵巢良性肿瘤60例(卵巢良性肿瘤组)。卵巢癌患者年龄30~72岁,平均年龄45.5岁。40例卵巢癌中,卵巢浆液性囊腺癌24例,黏液性囊腺癌11例,子宫内膜样腺癌5例;病理分级参照WHO标准,其中高分化14例,低分化16例,中分化10例;临床分期参照FIGO标准,其中Ⅰ期8例,Ⅱ期9例,Ⅲ期12例,Ⅳ期11例;有淋巴结转移者12例,无转移者28例。卵巢良性肿瘤患者年龄28~64岁,平均年龄32.5岁。所有患者均排除肝、肾、免疫系统疾病及其他部位肿瘤,术前均未接受放化疗和激素治疗,临床病理资料完整。同时选取张家口市第五医院同期30例正常卵巢组织作为对照组。3组年龄差异无统计学意义(P>0.05)。
1.2 主要试剂 兔抗人HMGB1单克隆抗体购自Santa Cruz公司。免疫组化SP试剂盒和羊抗兔IgG购自上海生工生物工程技术服务有限公司。RPMI-1640培养基、胰蛋白酶、小牛血清购自美国Promega公司。
1.3 实验方法
1.3.1 免疫组织化学:标本用10%甲醛固定,石蜡包埋,切成4 μm厚的石蜡切片,65℃烘烤,脱蜡,采用免疫组织化学染色 SP法测定HMGB1,参照试剂盒说明书进行操作,用已知阳性切片作为阳性对照,用PBS代替一抗作为阴性对照。HMGB1主要表达在细胞核,呈棕黄色颗粒。随机选取至少10个视野,计数200个细胞,阳性细胞数≥10%为阳性,<10%为阴性。
1.3.2 细胞培养:在含 5% CO2、37℃饱和湿度条件下,用含10%小牛血清的RPMI-1640培养基培养SKOV3、A2780、3AO细胞,每隔2~3 d用0.25%胰蛋白酶消化传代1次。

2 结果
2.1 HMGB1蛋白在卵巢癌、卵巢良性肿瘤及正常卵巢组织的表达 免疫组化结果显示,HMGB1蛋白主要表达在细胞核,呈棕黄色颗粒。在卵巢癌、卵巢良性肿瘤及正常卵巢组织中,HMGB1蛋白阳性表达率分别为77.5%(31/40)、23.3%(14/60)、10.0%(3/30),HMGB1蛋白在卵巢癌组织的阳性表达率显著高于卵巢良性肿瘤及正常卵巢组织,差异有统计学意义(P<0.05),而HMGB1在卵巢良性肿瘤和正常卵巢组织的表达无统计学意义(P>0.05)。见表1。
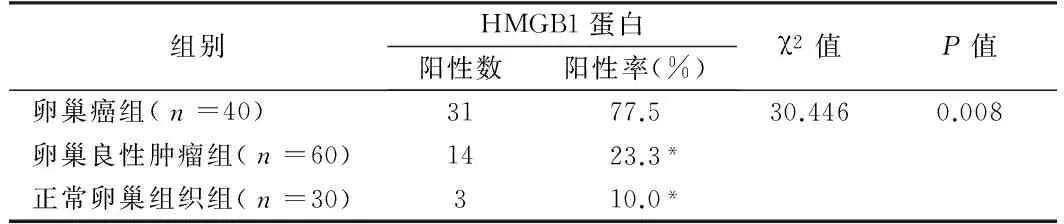
表1 不同卵巢组织HMGB1蛋白表达的比较
注:与卵巢癌组比较,*P<0.05
2.2 HMGB1蛋白表达与卵巢癌临床病理特征的关系 HMGB1的阳性表达与卵巢癌不同病理分级、临床分期及淋巴结转移情况密切相关,差异有统计学意义(P<0.05),而与组织学类型无关(P>0.05)。见表2。

表2 HMGB1表达与卵巢癌临床病理特征的关系 例(%)
2.3 HMGB1蛋白在卵巢癌SKOV3、A2780、3AO细胞系的表达 免疫细胞化学结果显示,HMGB1蛋白在SKOV3、A2780、3AO细胞中均呈阳性表达,HMGB1主要定位于细胞核,少量表达在细胞质中。
3 讨论
HMGB1是广泛存在于真核细胞内序列高度保守的DNA结合蛋白,与染色质非特异结合后参与DNA空间构象的构建、细胞复制与分化及基因转录调控等多种生理过程。近年来多项研究证实,HMGB1及其配基晚期糖基化终产物受体(receptor foradvanced glycation end products,RAGE)在胃癌、肝癌、结直肠癌、宫颈癌、子宫内膜癌等多种恶性肿瘤组织中表达上调,在肿瘤的发生发展、侵袭和转移过程中发挥重要作用[5,6]。
本实验结果发现,卵巢癌组织存在HMGB1蛋白的高表达,与卵巢良性肿瘤和正常卵巢组织比较,差异有统计学意义(P<0.05);进而我们检测了HMGB1在3种卵巢癌细胞系(SKOV3、A2780、3AO)中的表达水平,结果显示HMGB1在这3种高侵袭性卵巢癌细胞中均呈强阳性表达,提示HMGB1与卵巢癌的病理过程密切相关。研究显示,HMGB1过表达具有抑制细胞凋亡,促进细胞增殖和转移的作用;反之,张捷等[7]利用siRNA技术敲低HMGB1在卵巢癌S1,A1和HO8910PM细胞中的表达后细胞增殖被显著抑制。由此提示,HMGB1过表达与卵巢癌的侵袭转移过程高度相关,靶向HMGB1/RAGE基因表达的抑制剂有可能成为治疗卵巢癌的新措施。本研究结果显示,HMGB1在卵巢癌组织的高表达与卵巢癌病理分级、临床分期、淋巴结转移状况有关,这与刘晓燕等[3]研究结果一致。综合我们和他人研究结果可以看出,卵巢癌组织HMGB1高表达可能通过某种细胞内信号机制导致疾病的恶化。
HMGB1可由单核巨噬细胞和坏死的肿瘤细胞分泌,与细胞外基质相互作用并诱导新生血管形成,从而促进肿瘤细胞的侵袭转移。其可能机制如下:(1)HMGB1与RAGE等细胞膜分子结合,激活MAPK、P38、JNK及P42/P44等信号途径,直接造成纤维蛋白溶酶激活级联的下游靶点MMP-2和MMP-9的激活,促进细胞外基质的降解和肿瘤的侵袭转移[8];(2)HMGB1/RAGE通过上调VEGF的表达促进血管内皮细胞的迁移增殖、新生血管生成和淋巴转移[9];(3)HMGB1参与了类固醇激素等多个与恶性肿瘤相关基因的转录及转录后调控过程,这些基因的异常表达造成细胞表型的改变。这些可能是HMGB1促进卵巢癌侵袭转移的机制之一。
综上所述,HMGB1在卵巢癌组织高表达,这与肿瘤侵袭转移过程密切相关。采用抑制剂或siRNA技术阻断 HMGB1 的高表达可能直接抑制肿瘤的侵袭转移过程。总之,对HMGB1表达水平的监测不仅可作为卵巢癌预后评估的重要指标,更重要的是,深入研究HMGB1参与卵巢癌侵袭转移的信号机制可为卵巢癌的基因治疗提供潜在的治疗靶点,并有利于研发新的抗肿瘤药物。
1 Cho KR,Shih Ie M. Ovarian cancer.Annu Rev Pathol,2009,4: 287-313.
2 Bast RC,Hennessy B,Mills GB.The biology of ovarian cancer: new opportunities for translation.Nat Rev Cancer,2009,9:415-428.
3 刘晓燕,张捷,陈洁.高迁移率族蛋白 B1在卵巢癌组织及单克隆细胞亚系中的表达及其临床意义.山东大学学报,2011,49:123-131.
4 Diener KR,Al-Dasooqi N,Lousberg EL,et al.The multifunctional alarmin HMGB1 with roles in the pathophysiology of sepsis and cancer.Immunol Cell Biol,2013,31:1721-1726.
5 肖建彪,陈龙华,陈斌.HMGB1在多种人体恶性肿瘤组织、癌旁组织中的表达及意义.山东医药,2013,53:1-3.
6 曹清心,刘宇,凌昌全.HMGB1与肿瘤相关性的研究进展.临床肿瘤学杂志,2012,17:282-285.
7 张捷,赵跃然,陈洁.RNA干扰抑制高迁移率族蛋白B1(HMGB1)的表达对卵巢癌细胞增殖和侵袭的影响.现代妇产科进展,2012,21:241-245.
8 Liu PL,Tsai JR,Hwang JJ,et al. High-mobility group box 1-mediated matrix metalloproteinase-9 expression in non-small cell lung cancer contributes to tumor cell invasiveness. Am J Respir Cell Mol Biol,2010,43:530-538.
9 吴蔚,张雪玉,杨彩虹.HMGB1和VEGF-C在宫颈鳞癌中的表达及意义.宁夏医科大学学报,2012,34:699-708.
ExpressionandclinicalsignificanceofHMGB1inovariancarcinoma
ZHIHua*,MAHaiyan,QURuihua.*QiaoxiDistrictCenterforDiseaseControlandPrevention,Hebei,Zhangjiakou075000,China
ObjectiveTo investigate the expression and clinical significance of HMGB1 in ovarian carcinoma.MethodsThe expression levels of HMGB1 were detected by immunohistochemistry in 40 cases of ovarian carcinomas,60 cases of benign ovarian tumors and 30 cases of normal ovarian tissues,and the expression levels of HMGB1 were also detected in ovarian carcinoma cells (SKOV3,A2780 and 3AO) by immunohistochemistry.ResultsAs compared with those in benign ovarian tumors and normal ovarian tissues,the expression levels of HMGB1 in ovarian carcinoma tissues were significantly increased (P<0.05),moreover,which were closely related with pathological classification,clinical staging and lymph node metastasis of ovarian carcinoma (P<0.05),however,which were not correlated to histological type.The expression of HMGB1 was positive in SKOV3,A2780,3AO cells,but there were no significant differences in expression levels among them (P>0.05).ConclusionThe expression levels of HMGB1 in ovarian carcinoma are up-regulated,which may be involved in the pathogenesis,development and metastasis of ovarian carcinoma.
ovarian carcinoma; high mobility group box 1;immunohistochemistry
10.3969/j.issn.1002-7386.2014.10.007
075000 河北省张家口市桥西区疾病预防控制中心(智华);河北省张家口市第二医院骨五科(马海燕);河北省张家口市第五医院(曲瑞华)
R 737.31
A
1002-7386(2014)10-1461-03
2013-12-27)

