非小细胞肺癌患者外周血中多参数检测对诊断微转移的作用
郝 颖 付秀华 王立红 高俊珍
肺癌仍居全世界恶性肿瘤发病率和病死率的首位,手术切除仍是早期肺癌的首选方案[1]。随着外科手术技巧的大幅提升,手术风险和围手术期并发症的发生率得到了明显改善,但这并没有同等程度延长肺癌患者术后生存的时间。据报道,医院收治的可根治切除的Ⅰ期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者5年生存率约为60%~70%,但仍有部分患者死于肺癌的转移或复发,生存率不容乐观[2-3]。
NSCLC的高病死率归因于肿瘤的转移和复发,部分患者在诊断初期已经发生了微转移。微转移指恶性肿瘤细胞在发展过程中,播散并存活于淋巴道、外周血、骨髓及各种器官中尚未形成显性转移灶,转移部位也无任何临床表现,常规影像学和病理学等检查均难以检测发现的一种微量转移特征。研究已发现多种与肺癌的发生发展密切相关的分子肿瘤标记物,包括细胞角蛋白家族、癌胚抗原、黏蛋白-1(MUC1)、EGFR、肺组织特异性X蛋白等。部分因子在肿瘤生物学行为中扮演了重要角色,有可能作为早期预测NSCLC患者术后是否转移或复发的重要指标。本研究通过检测NSCLC患者外周血中CK19、LunX、KS1/4的表达,探讨其与NSCLC微转移的关系。
材料与方法
一、病例资料
收集2010年2月至2012年5月内蒙古医科大学附属医院心胸外科A、B病区行肺叶切除加淋巴结清扫术的非小细胞肺癌患者52例。术前均通过支气管镜或经皮肺穿刺、痰脱落细胞学等检查病理证实为NSCLC,术前术后未经放、化疗、靶向等抗肿瘤治疗。选择同期行局部支气管扩张肺叶切除术、肺结核切除术、肺部错构瘤切除手术的患者20例作为对照组。
二、实验分组
入选患者分别于术后3个月、6个月和9个月复查胸部增强CT、腹部增强CT, 头颅MRI、全身同位素骨扫描或PET-CT等检查判断是否发生转移或复发。经随访后将52例患者再分为两组,将发生肿瘤局部复发或远处转移的病例命名为转移组,未发现肿瘤转移或复发的病例命名为无转移组。转移组:共18例,其中男性13例,女性5例,平均年龄60.9±8.3岁;鳞癌9例,腺癌7例,黏液表皮样癌1例,肺泡细胞癌1例,Ⅱa~Ⅱb期10例,Ⅲa期8例。无转移组:共34例,其中男性28例,女性6例,平均年龄(59.1±8.3)岁;鳞癌14例,腺癌10例,支气管肺泡细胞癌4例,大细胞癌2例,混合型癌4例;Ⅰa~Ⅰb 期8例,Ⅱa~Ⅱb期10例,Ⅲa期16例。对照组:男性14例,女性6例,平均年龄(50.1±2.2)岁。
三、实验方法
1.标本的采集及提取总RNA:采集肘静脉新鲜外周血2 ml放入EDTA抗凝管中,迅速放入-80 ℃冰箱中保存备用。弃去开始的1 ml避免上皮细胞的污染。取抗凝血2 ml,以离心半径8 cm,12 000 r/min,离心5 min,弃上清,将4 ℃冰箱内预冷的红细胞裂解液以6︰1的比例加入到细胞沉淀中,吹打混匀后静置,以离心半径8 cm,1000 r/min,离心5 min,收集沉淀部分,生理盐水离心洗2次,收集沉淀,采用总RNA提取试剂盒提取总RNA(北京天根生化科技公司,离心柱型,DP419)。
2. 反转录合成第一链cDNA:采用大连TAKARA公司PrimeScript®RT reagent Kit With gDNA Eraser,按说明配制反应液体系1,冰上进行:5×g DNA Eraser Buffer 2 μl、gDNA Eraser 1 μl、Total RNA 1 μg、余下为RNaseFree dH2O至总体积10 μl,42 ℃ 2 min后放入4 ℃保存;配制反应液体系2: 5×PrimeScript®Buffer 2 4 μl、PrimeScript®RT Enzyme Mix I 1 μl、RT primer Mix 1 μl、体系1 反应液 10 μl、RNaseFree dH2O至体系20 μl,37 ℃ 15 min,85 ℃ 5 s,最后4 ℃,反应结束后,cDNA放置-20 ℃保存备用。
3.荧光定量PCR反应:委托TAKARA生物技术公司完成引物序列的设计及合成,见表1。应用荧光定量PCR分析仪(美国ABI 7500fast)完成。按SYBR®Premix Ex Tap TM II (Perfect Real Time)(TAKARA Code: DRR081A)说明书完成反应体系的配制。
冰上配制PCR反应液:SYBR®Premix Ex TapTM Ⅱ(2×) 25 μl、PCR Forward Primer (10 μM)2.0 μl、PCR Reverse Primer(10 μM) 2.0 μl、ROX Reference Dye II(50×)1.0 μl、cDNA 4.0 μl、d H2O 16.0 μl,95 ℃ 30 s灭活逆转录酶及预变性,95 ℃ 3 s,60 ℃ 30 s,40个循环,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。

表1 CK19、LunX、KS1/4和GAPDH引物序列及扩增长度
四、统计学方法
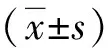
结 果
经过随访,52例患者中发生转移或复发共18例,转移复发率34.6%(18/52)。
一、总RNA抽提结果
通过紫外分光光度仪检测RNA纯度,转移组OD268/280值在1.612~1.98之间,RNA浓度在100~1370 μg/ml之间;未转移组OD268/280值在1.732~2.1之间,RNA浓度在140~1020 μg/ml之间;良性病变组OD268/280值在1.800~2.0之间,RNA浓度在500~1410 μg/ml之间。经琼脂糖胶电泳,紫外线灯下观察可见2条清晰可见亮条带,分别代表28 s和18 s,28 s亮度、宽度约为18 s条带的2倍。
二、荧光定量PCR结果
根据扩增曲线记录目标基因的平均CT值,即基因成指数扩增起始时所经历的循环数。本实验采用2-△△CT方法比较组织中各目标基因的表达差异,当扩增效率接近1时,可用2-△Ct表示目的基因在组织中的相对表达量(ΔCt=Ct目的基因-CtGAPDH),ΔCt值与基因的表达量呈反比关系,ΔCt越低,提示基因表达量越高。GAPDH的CT值在15~25之间,目的基因产物的CT值在15~35之间,见图1~8。
三、NSCLC转移组、无转移组与肺良性病变外周血标本中三种因子表达比较
外周血中CK19mRNA的ΔCt值在转移组、无转移组及对照组呈递增关系,说明其CK19mRNA的表达量呈递减趋势,转移组中CK19mRNA的表达量高于无转移组及对照组,差异有统计学意义(P=0.038);这种关系也同样体现在LunX mRNA上,转移组外周血中LunX mRNA的表达量高于无转移组及对照组,差异有统计学意义(P=0.034);KS1/4 mRNA的表达也同样是这种趋势,但P值并无统计学意义,见表2。
四、转移组患者外周血中不同因子的表达差异
我们分别对转移组外周血中三种因子的表达量做了比较,结果显示LunXmRNA表达量最高,KS1/4mRNA 其次,CK19mRNA表达最低,差异具有统计学意义(P=0.004),见表2。

表2 三组患者外周血标本三种因子ΔCt值表达比较
图1 GAPDH熔解曲线 图2 CK19熔解曲线 图3 LunX熔解曲线 图4 KS1/4熔解曲线

图5 GAPDH扩增曲线 图6 CK19扩增曲线 图7 LunX扩增曲线 图8 KS1/4扩增曲线
讨 论
肿瘤的发生发展是一个复杂的生物过程,微转移只是其中的一个阶段,多种分子生物共同参与其发生和发展。肿瘤细胞从原发病灶脱落后,随血运或淋巴管播散到新环境,但并非一定形成转移灶。动物实验表明经静脉注射癌细胞后而只有0.01%最终形成了转移灶,绝大部分进入血液循环的肿瘤细胞被机体免疫吞噬清除,循环内必须有大量肿瘤细胞播散后方有机会形成远处转移[4]。不可避免的是仍有部分早期癌症患者要遭受肿瘤细胞的脉管侵犯,导致肿瘤的远处转移。张静渊等[5]在研究中发现,肿瘤细胞的脉管内侵犯与肿瘤的胸膜浸润、淋巴结转移及远处转移密切相关(P<0.05),但与年龄、肿瘤大小、分化程度无关(P>0.05),提示肿瘤的脉管侵犯预示着远处转移的发生,较传统的TNM分期能更早一步准确评估预后,而肿瘤脉管侵犯常与外周血中CK19mRNA表达呈正相关。
CK19是被广泛研究并公认的肿瘤标记物之一,其在肺癌、胃癌、食管癌、宫颈癌、乳腺癌、喉癌中的研究最多[6-10]。上皮细胞的过表达是肿瘤生物活动的主要表现形式,CK19为上皮细胞家族中的敏感性最高的片段,被认为与肿瘤的发生密切相关,血清检测CK19片段诊断非小细胞肺癌的特异性达87%。Ge等[11]认为CK19 mRNA在NSCLC淋巴结中阳性表达可作为预测预后的独立指标,并可作为肺癌临床分期的补充。本研究的受试对象经术后随访发现肿瘤转移或复发发生率为34.6%(18/52)。发生转移组患者外周血中CK19mRNA的表达与未发生转移组的差异有统计学意义,转移组LunX mRNA在外周血的表达也明显高于无转移组,与CK19mRNA的表达基本一致,且两组中CK19mRNA、LunX mRNA的表达均明显高于对照组,差异有统计学意义。说明CK19和LunX与NSCLC转移关系密切,部分NSCLC患者其实在手术治疗前已经发生肿瘤细胞血液浸润,CK19和LunX能在一定程度上预测转移的发生。朱广迎等[12]通过6~16个月的短期随访发现LunX基因表达阳性组复发和转移率为52%,阴性组复发和转移率仅为18%。而Yu等[13]认为LunX基因不仅能辅助诊断非小细胞肺癌,且对病理分型有指向性意义。牛瑞等[14]认为患者的生存时间与LunX mRNA的表达有相关性,这与我们的研究结果一致。CK19、LunX阳性表达一定程度上提示肿瘤负荷增加,预示微转移的存在,术后发生转移或复发的风险增加,可以作为诊断NSCLC微转移的指标。
上皮癌相关基因(epithelial carcinoma-associated gene, KS1/4)是一种上皮细胞表面抗原,为超级免疫球蛋白家族中的黏着蛋白的一种[15-16],因能结合多种不同单克隆抗体而被识别。KS1/4横跨于细胞膜表面,在细胞增殖、成形过程中起粘连及细胞核信号传导作用[17-18]。 KS1/4最初发现表达于结肠癌、胃肠癌、胰腺癌等上皮细胞内,后来许多研究在肺癌、前列腺癌、肝癌细胞中也检测到KS1/4的阳性表达,故称其为上皮癌相关基因。目前,KS1/4已经被认为是一种癌相关蛋白因子,通过癌细胞的跨膜蛋白水解[17, 19]和在干细胞信号转导中发挥作用[20-22]。Mitas等[23]通过RT-PCR对NSCLC患者淋巴结LunX, KS1/4, CEA, CK19和MUC1做了检测,首次提出KS1/4为诊断NSCLC特异性最高的标记物。Wallace等[24]采用RT-PCR检测NSCLC患者淋巴结中LunX、MUCl。KS1/4, CEA, CK19 及 PSE的表达结果显示,KS1/4的阳性表达率为25%,被认为是发现肿瘤微转移最特异的基因。本实验检测外周血中KS1/4mRNA的表达发现,其在三组中的表达差异无统计学意义。我们推论KS1/4可能在肿瘤发生早期有一定生物学行为,尤其在淋巴结微转移中发挥了作用,其在外周血的检测诊断微转移意义需重新定位。KS1/4可能在外周血内表达量低或不表达,或受其他因素影响而表达量降低,如是否存在竞争抑制等等,导致外周血中检测阳性率低。
本研究还对转移组内因子间的表达差异对了对比,结果显示:转移组外周血中LunXmRNA的表达最高,KS1/4mRNA其次,CK19mRNA的表达最低,差异有统计学意义(P=0.004),提示LunX在外周血检测诊断微转移的特异性较KS1/4、CK19高。Mitas等[23]在实验中应用实时定量 PCR 技术检测 24 例Ⅰ~Ⅳ期NSCLC患者外周血LUNX,MUC1, KS1/4, CEA,CK19 及 PSE 的表达,其中LUNX 阳性表达率最高, 为 42%,认为其特异性表达与肺癌的发生关系密切。这与我们的实验结果符合,更进一步证实了我们的结论。
肿瘤细胞最终是否形成转移与癌细胞的自身生物学行为、机体免疫及营养状态、术式的选择、淋巴结清扫情况、局部微循环等多因素共同参与有关。目前临床应用TNM 分期为NSCLC患者做预后评价,微转移的存在为分子分期(TNMB)提供了有力的依据。综上所述,虽然本研究样本例数偏少,但还是得到了与国外关于NSCLC微转移的多项研究相似的结论,因此,我们认为CK19、LunX可以作为预测NSCLC转移或复发的指标,辅助诊断NSCLC微转移,其中LunX的敏感性略显优势。
参 考 文 献
1 钱桂生. 肺癌不同病理类型发病率的变化情况及原因[J/CD]. 中华肺部疾病杂志:电子版,2011,4(1):1-6.
2 Matsuoka K, Sumitomo S, Nakashima N, et al. Prognostic value of carcinoembryonic antigen and CYFRA21-1 in patients with pathological stage I non-small cell lung cancer[J]. Eur J Cardiothorac Surg, 2007, 32(3): 435-439.
3 Maruyama R, Sugio K, Mitsudomi T, et al. Relationship between early recurrence and micrometastases in the lymph nodes of patients with stage I non-small-cell lung cancer[J]. J Thorac Cardiovasc Surg, 1997, 114(4): 535-543.
4 Mitas M, Mikhitarian K, Walters C, et al. Quantitative real-time RT-PCR detection of breast cancer micrometastasis using a multigene marker panel[J]. Int J Cancer, 2001, 93(2): 162-171.
5 张静渊, 尹 荣, 徐新宇. 非小细胞肺癌的脉管内侵犯与微转移、微血管密度关系的研究[J]. 南京医科大学学报(自然科学版), 2013, (07): 887-891.
6 陈玉敏, 王金林, 师锁江, 等. 胃癌患者外周血中CK-19的表达及其临床意义[J]. 中国医药导报, 2013, 10(14): 4-6, 10.
7 吴 蔚, 胡国华, 康苧心, 等. CK19和EGFR mRNA在喉癌动物模型外周血中的表达及其与淋巴转移关系[J]. 临床耳鼻咽喉头颈外科杂志, 2011, 25(11): 501-505.
8 余 辉, 黄秀英, 王 欣, 等. 非小细胞肺癌患者外周血CK19 mRNA检测临床意义的探讨[J]. 中华肿瘤防治杂志, 2011, 18(13): 1024-1026.
9 孟庆翔, 谢景华, 高雄辉, 等. 喉癌患者治疗前后外周血CK19 mRNA、CK20 mRNA的表达及临床意义[J]. 中国癌症防治杂志, 2011, 18(4): 302-305.
10 张 俊, 曾照芳. CK-19 mRNA对乳腺癌的微转移诊断价值的Meta分析[J]. 激光杂志, 2012, (02): 77-78.
11 Ge MJ, Wu QC, Wang M, et al. Detection of disseminated lung cancer cells in regional lymph nodes by assay of CK19 reverse transcriptase polymerase chain reaction and its clinical significance[J]. J Cancer Res Clin Oncol, 2005, 131(10): 662-668.
12 朱广迎, 陈 杰. 肺癌患者三种微转移标志物临床意义的比较研究[J]. 中华放射肿瘤学杂志, 2003, 12 (3): 41-45.
13 Yu H, Huang X, Zhu Z, et al. Significance of combined detection of LunX mRNA and tumor markers in diagnosis of lung carcinoma[J]. CHINESE J CANCER RES, 2014, 26(1): 89-94.
14 牛 瑞, 刘 波, 邵明举, 等. 非小细胞肺癌区域淋巴结中肺组织特异性基因的表达与预后的关系[J]. 山东大学学报(医学版), 2007, 45 (9): 882-885.
15 Cavallaro U, Christofori G. Cell adhesion and signalling by cadherins and Ig-CAMs in cancer[J]. Nat Rev Cancer, 2004, 4(2): 118-132.
16 Litvinov SV, Bakker HA, Gourevitch MM, et al. Evidence for a role of the epithelial glycoprotein 40 (Ep-CAM) in epithelial cell-cell adhesion[J]. Cell Adhes Commun, 1994, 2(5): 417-428.
17 Maetzel D, Denzel S, Mack B, et al. Nuclear signalling by tumour-associated antigen EpCAM[J]. Nat Cell Biol, 2009, 11(2): 162-171.
18 Carpenter G, Red BM. EpCAM: another surface-to-nucleus missile[J]. Cancer Cell, 2009, 15(3): 165-166.
19 Trzpis M, Bremer E, McLaughlin PM, et al. EpCAM in morphogenesis[J]. Front Biosci, 2008, 13: 5050-5055.
20 Gonzalez B, Denzel S, Mack B, et al. EpCAM is involved in maintenance of the murine embryonic stem cell phenotype[J]. Stem Cells, 2009, 27(8): 1782-1791.
21 Ng VY, Ang SN, Chan JX, et al. Characterization of epithelial cell adhesion molecule as a surface marker on undifferentiated human embryonic stem cells[J]. Stem Cells, 2010, 28(1): 29-35.
22 Munz M, Baeuerle PA, Gires O. The emerging role of EpCAM in cancer and stem cell signaling[J]. Cancer Res, 2009, 69(14): 5627-5629.
23 Mitas M, Cole DJ, Hoover L, et al. Real-time reverse transcription-PCR detects KS1/4 mRNA in mediastinal lymph nodes from patients with non-small cell lung cancer[J]. Clin Chem, 2003, 49(2): 312-315.
24 Wallace MB, Block MI, Gillanders W, et al. Accurate molecular detection of non-small cell lung cancer metastases in mediastinal lymph nodes sampled by endoscopic ultrasound-guided needle aspiration[J]. Chest, 2005, 127(2): 430-437.

