影响非小细胞肺癌脑转移患者放射治疗后生存的临床相关因素分析
傅 华 许 瑜 田仲泽 岳养军
非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌发病率的80%左右,是目前发病率较高的恶性肿瘤之一,预后较差,5年生存率在15%左右[1],死亡原因多是由于发生远处器官转移所致,其中脑转移发生率约为30%,脑转移发生后患者多在1~3月内死亡[2-3]。放射治疗即普通全脑放疗(whole brain radiotherapy,WBRT)或立体定向放疗(stereotactic radiotherapy, SRT)是目前在临床应用较为广泛的治疗NSCLC脑转移的方法。本研究回顾103例经过放射治疗的NSCLC脑转移患者临床资料,分析其生存期及影响预后因素,参照美国放射治疗协作组(RTOG)推荐的分级预后指数(graded prognostic assessment, GPA)及体能状态评分(ECOG)进行预后分析[4-5],以期对临床治疗给予一些指导,从而有助于提高NSCLC脑转移患者的生存率、改善生存质量。
资料与方法
一、一般资料
选取2004年1月至2010年11月我院收治的NSCLC脑转移患者103 例。男性65例、女性38例,年龄37~83 岁,平均年龄57岁。
二、治疗方法
1.入组标准:随访资料完整、确诊为NSCLC脑转移的患者,并且进行了针对脑转移病灶的系统放射治疗。
2.治疗方法:全组患者给予针对脑转移病灶的放射治疗。WBRT采用6MV-X线两侧野对穿照射,放射剂量为:30~40 Gy/2~3 W,5F/W,单发转移病灶局部缩野,后期追加剂量为5~20 Gy,5F/W;其中35例患者给予SRT,周边剂量为3~8 Gy,平均5 Gy,总治疗次数为2~18次,平均10次,每周治疗3~5次。放射治疗同期配合激素和脱水等对症处理。
3.主要观察指标:性别、年龄、ECOG评分、吸烟史、分级预后评估指数(graded prognostic assessment, GPA)、病理类型、同步脑转移情况(确诊肺癌一月内发生脑转移为同步脑转移)、脑转移病灶的治疗方法、靶向药物治疗情况,见表1。以中位生存期、1年生存率及2年生存率评价远期疗效。
三、统计学方法
运用SPSS18.0统计软件进行统计学分析处理。生存分析采用Kaplan-Meier法,各个亚组间GPA比较采用Log-Rank分析,以风险比例模型(COX模型)进行多因素生存相关危险因素分析,P<0.05为差异有统计学意义。

表1 分级预后评估(GPA)
结 果
一、生存期
103例NSCLC脑转移患者全部随访,随访率为100%。总体生存期为1~68个月;中位生存期为10个月(95%CI:7.231~12.769个月),1年生存率为46.0% ,2年生存率为22.0%。全组患者生存曲线,见图1。
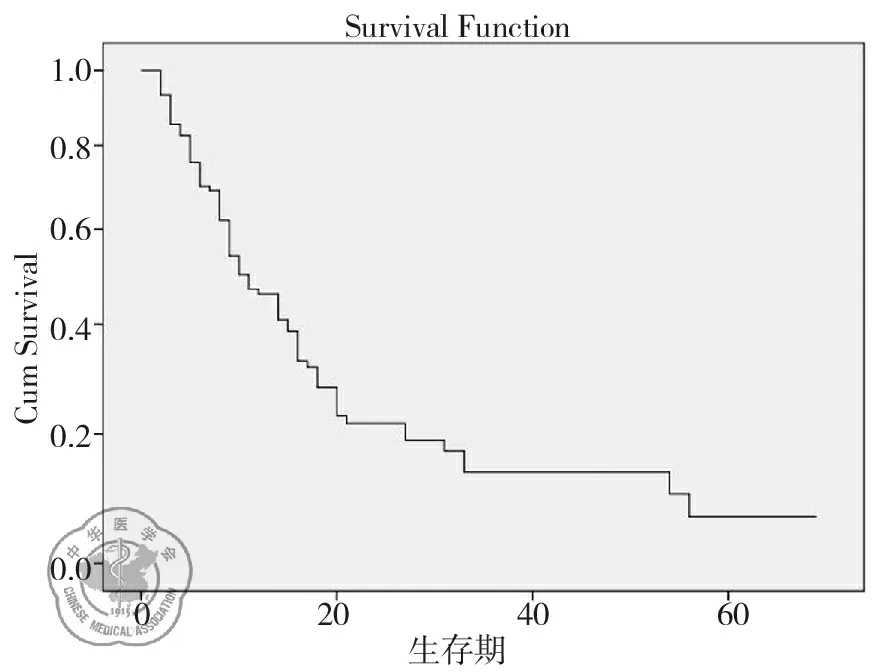
图1 全组患者生存曲线图
二、影响NSCLC脑转移患者放疗后预后的多因素分析
COX多因素分析提示:ECOG、GPA是影响患者生存率的独立预后因素(P<0.05)。而患者病理类型、同步脑转移情况、是否使用靶向药物治疗对于预后的影响无统计学意义。模型全卡方检测值:32.614,P=0.000,(P<0.05),模型有显著意义,见表2。
三、分级预后评估法(GPA)
按照GPA分值分四组,分析结果为:0~1分组中位生存期2个月(95%CI:1.219~2.781);1.5~2.5分组中位生存期5个月(95%CI:3.205~6.795);3分组中位生存期16个月(95%CI:12.528~19.472);3.5~4 分组中位生存期15个月(95%CI:6.489~23.511)。统计学处理结果显示4组间生存率有统计学差异(P=0.000),见图2。

图2 GPA分组分析后生存曲线
表2 103例NSCLC脑转移放疗后患者预后COX多因素分析

因素BSEWalddfSig.Exp(B)95.0% CI for Exp(B)LowerUpperECOG评分-0.5570.2485.06010.0240.5730.3530.931是否同步脑转移-0.2760.1842.24010.1340.7590.5291.089病理类型0.2900.2121.87910.1701.3370.8832.024靶向治疗0.1840.2060.79810.3721.2020.8031.801GPA0.5240.14712.76510.0001.6891.2672.253
讨 论
目前NSCLC脑转移患者的治疗仍以姑息性治疗为主,化疗、放射治疗以及分子靶向治疗为主要治疗方式。
一、化疗及靶向药物治疗
临床上,化疗是肺癌脑转移较为常用的治疗方法。传统的观点认为由于血脑屏障(blood brainbarrier)正常作用的发挥,使普通化疗药物难以透过血脑屏障到达病灶位置,杀灭肿瘤细胞,但是已有的相关动物实验结果表明微小的脑转移病灶就可以破坏血脑屏障的正常功能[6]。亚硝脲类如尼莫司汀(ACNU) 、司莫司汀(MeCCNU)、顺铂(DDP)、紫杉醇(PTX)、替尼泊苷(VM- 26)、拓扑替康(topotecan)和替莫唑胺(temozolomide)等[7-9]在治疗NSCLC脑转移中有一定效果。由于本研究为临床病例资料的回顾性分析,存在有化疗疗程、化疗方案、化疗时间等关乎于化疗疗效的重要资料记录不全的问题,故在本研究中未将化疗作为一项独立的观察因子列入生存因素分析。酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI) 如吉非替尼(gefitinib)、厄洛替尼(erlotinib)等在NSCLC脑转移的治疗中也取得了一些疗效,得到了越来越多的肯定[10-11]。有观点认为可以把TKI作为肺癌脑转移患者的一线用药[12],其具有疗效可靠、起效迅速、毒副反应相对较轻、患者的耐受性好等特点。文献报告NSCLC脑转移患者使用吉非替尼联合WBRT治疗对改善患者生活质量,提高患者生存期有重要作用[13-14]。但是在本研究结果中靶向药物治疗对患者远期生存的影响并没用表现出显著的优势,分析原因可能为使用靶向药物治疗的病例资料数量较少,其生存优势被较大样本量的非靶向治疗组所掩盖。
二、放射治疗
放射治疗作为NSCLC脑转移的传统治疗方式,其疗效已经为大多数学者所认可[15-16]。但是WBRT也存在诸多的并发症,如急性脑水肿、恶心、呕吐、视网膜病变、痴呆等。放射性脑水肿和周边正常脑组织的损伤致使放射剂量难以提高,对远期疗效缺乏有力影响[17]。立体定向放射外科(stereotactic radiosurgery, SRS)是利用立体定向技术对病变部位进行单次大剂量照射,分次照射治疗方案为SRT。SRS有定位精确,靶区内外剂量落差大,副作用小,并发症少等优点。临床上常将其称为γ刀(伽马刀)或者X线刀。一项对日本2390例脑转移瘤患者病例资料的分析研究认为,对脑转移病灶仅进行单一的伽玛刀治疗,可以减少对周围正常脑组织的损伤,维持脑神经基本正常功能[18]。Kepka等[19]认为WBRT是脑转移瘤常规治疗方法,可以与SRT联合治疗数量有限的脑转移瘤。Chao等[20]也认为对WBRT后复发的患者进行SRS治疗对改善局部控制率、提高生存率有积极影响。可见目前临床上对使用SRS治疗脑转移病灶的疗效也是肯定的。所以在临床工作中如何更好地为患者制定具体放疗计划对提高NSCLC脑转移患者治疗疗效显得尤为重要。
预防性全脑放射治疗(prophylactic cranial irradiation, PCI)在小细胞肺癌(small cell lung carcinoma, SCLC)的治疗中应用较为广泛,因为相对NSCLC来说,SCLC发生脑转移的几率更大。目前也有一些观点认为,在NSCLC患者中可以实施PCI,特别是对于那些发生脑转移可能性比较大的进展期非鳞癌患者,在原发病灶控制良好,尚未发现有远处转移之前,应该给予PCI治疗,对其预后将产生积极影响[19]。在局部晚期的NSCLC患者中实施PCI治疗,可降低脑转移发生的风险或者延长无脑转移发生的时间[21]。但是实施PCI治疗也会导致急性脑水肿、颅内压增高等近期不良反应发生率的相应增加[19]。
所以关于PCI能否作为NSCLC脑转移患者的常规治疗方案,目前尚缺乏大规模的临床研究资料支持,在我们的研究中也没有发现这样的病例资料,故无法就PCI是否对NSCLC脑转移患者预后产生影响做出判断。
三、其它方面
ECOG评分是对患者体能状态进行综合性评估的指标,它能够体现患者的肿瘤负荷情况及耐受抗肿瘤治疗的能力。作为NSCLC脑转移患者的独立预后因素,已经获得肯定,并在我们的研究中也有所体现。RTOG提出了两个预后指数:RPA (recursive partitioning analysis)[22]和GPA。RPA是根据患者的体能状态评分、年龄以及颅外原发肿瘤控制与否提出的分组模型,是目前临床上已经广泛应用的NSCLC脑转移患者预后分析指数。相关的回顾性分析研究证实了RPA分层分析的可行性,对指导预后有意义[19,23]。但是经过长期临床验证实践,普遍认为RPA在细致性方面还有所欠缺。RPA就颅内转移病灶的具体数目,原发病灶的控制与否,颅外转移的情况未进行独立评估,也没有详细划分患者的年龄、体能状态评分。故在此基础上RTOG依据9508号试验数据提出了一种新的预后指数GPA。GPA预后指数细化了预后组群(RPA分3组,GPA分4组),针对各项预后因素进行了独立评分,同时将脑转移灶数目作为一项独立的预后因子。GPA分组更为细致,对NSCLC脑转移患者的预后影响因素纳入的更为全面,对临床的指导意义更强。经过对1960例患者临床研究的总结,证实了GPA是一种良好的预后指数[24]。我们的研究同样显示GPA 分组:0~1 分、1.5~2.5 分、3 分、3.5~4分4个组别的生存曲线差异显著(P<0.001)。在曲线图后半段3分组与3.5~4 分组曲线有相交,是因为3分组有2例患者生存期达到了60个月以上,但这并未影响其统计学意义。就本研究而言,GPA分组3分以上组的患者1年生存率均超过半数以上,这提示对于GPA3分及3.5~4分的患者应该采取积极的治疗方案,以期获得更好的预后。
总之,ECOG评分和GPA评分为影响NSCLC脑转移患者生存的独立预后因素。做好治疗前评估,制定合理有效的治疗方案,对提高NSCLC脑转移患者的生存率有重要的意义。
参 考 文 献
1 Arrieta O, Saavedra-Perez D, Kuri R, et al. Brain metastasis development and poor survival associated with carcinoembryonic antigen (CEA) level in advanced non-small cell lung cancer: a prospective analysis [J]. BMC Cancer, 2009, 9: 119.
2 Chen AM, Jahan TM, Jablons DM, et al. Risk of cerebral metastases and neurological death after pathological complete response to neoadjuvant therapy for locally advanced nonsmall-cell lung cancer: clinical implications for the subsequent management of the brain [J]. Cancer, 2007, 109(8): 1668-1675.
3 Siker ML, Mehta MP. Resection versus radiosurgery for patients with brain metastases [J]. Future Oncol, 2007, 3(1): 95-102.
4 Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases:Phase Ⅲ results of the RTOG 9508 randomised trial [J]. Lancet, 2004, 363(9422): 1665-1672.
5 Topkan E, Yildirim BA, Selek U, et al. Cranial prophylactic irradiation inlocally advanced non-small cell lung carcinoma: current status and future perspectives[J]. Oncology, 2009, 76(3): 220-228.
6 Kim CH, Im YS, Nam DH, et al. Gamma knife radiosurgery for ten or more brain metastases [J]. J Korean Neurosurg Soc, 2008, 44(6): 358-363.
7 Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma [J]. N Engl J Med, 2005, 352(10): 987-996.
8 Lorusso V, Galetta D, Giotta F, et al. Topotecan in the treatment of brain metastases-A phase Ⅱ study of GOIM (Gruppo Oncologico dell'Italia Meridionale) [J]. Anticancer Res, 2006, 26(3B): 2259-2263.
9 Siena S, Crinò L, Danova M, et al. Dose-dense temozolomide regimen for the treatment of brain metastases from melanoma, breast cancer, or lung cancer not amenable to surgery or radiosurgery: a multicenter phase Ⅱ study [J]. Ann Oncol, 2010, 21(3): 655-661.
10 Kim JE, Lee DH, Choi Y, et al. Epidermal growth factor receptor tyrosine kinase inhibitors as a first-line therapy for never-smokers with adenocarcinoma of the lung having asymptomatic synchronous brain metastasis [J]. Lung Cancer, 2009, 65(3): 351-354.
11 吴 驰, 李龙芸, 王孟昭, 等. 吉非替尼治疗晚期非小细胞肺癌脑转移的疗效[J]. 中华肿瘤杂志, 2007, 29(12): 943-945.
12 Akerley W, Boucher KM, Bentz JS, et al. A phase II study of erlotinib as initial treatment for patients with stage ⅢB-Ⅳ non-small cell lung cancer[J]. J Thorac Oncol, 2009, 4(2): 214-219.
13 Ma S, Xu Y, Deng Q, et al. Treatment of brain metastasis from non-small cell lung cancer with whole brain radiotherapy and gefitinib in a Chinese population[J]. Lung Cancer, 2009, 65(2): 198-203.
14 蔡明伟, 杜 驰, 蒋吉飞, 等. 放射治疗非小细胞肺癌脑转移40例临床疗效分析[J]. 西部医学, 2012, 24(12): 2336-2338.
15 刘小军, 胡义德. 非小细胞肺癌脑转移综合治疗进展[J/CD]. 中华肺部疾病杂志: 电子版, 2012, 5(4): 371-375.
16 Ranjan T, Abrey LE. Current management of metastatic brain disease[J]. Neurotherapeutics, 2009, 6(3): 598 - 603.
17 Topkan E, Yildirim BA, Selek U, et al. Cranial prophylactic irradiation inlocally advanced non-small cell lung carcinoma: current status and future perspectives [J]. Oncology, 2009, 76(3): 220-228.
18 Serizawa T, Yamamoto M, Nagano O, et al. Gamma Knife surgery for metastatic brain tumors [J]. J Neurosurg, 2008, 109 (Suppl): 118-121.
19 Kepka L, Sprawka A, Casas F, et al. Radiochemotherapy in small-cell lung cancer [J]. Expert Rev Anticancer Ther, 2009, 9(10): 1379-1387.
20 Chao ST, Barnett GH, Vogelbaum MA, et al. Salvage stereotactic radiosurgery effectively treats recurrences from whole-brain radiation therapy [J]. Cancer, 2008, 113(8): 2198-2204.
21 Topkan E, Yildirim BA, Selek U, et al. Cranial prophylactic irradiation inlocally advanced non-small cell lung carcinoma: current status and future perspectives [J]. Oncology, 2009, 76(3): 220-228.
22 Cortes J, Rodrigue J, Aramendia J M, et al. Front-line paclitaxel/cisplation-based chemotherapy in brain metastases from non-small-cell lung cancer[J]. Oncology, 2003, 64(1): 28-35.
23 Chen AM, Tahan TM, Jablons DM, et al. Risk of cerebral metastases and neurological deat h after pat hological complete response to neoadjuvant t herapy for locally advanced non-small cell lung cancer: clinical implications for the subsequent management of t he brain[J] . Cancer, 2007, 109 (8): 1668-1675.
24 Siena S, Crinò L, Danova M, et al. Dose-dense temozolomide regimen for the treatment of brain metastases from melanoma, breast cancer, or lung cancer not amenable to surgery or radiosurgery: a multicenter phase Ⅱ study [J]. Ann Oncol, 2010, 21(3): 655-661.

