重组鼠IL-5可溶性受体α蛋白对哮喘小鼠肺组织嗜酸性粒细胞凋亡及Bax蛋白表达的影响
谭国超 边 静 郭亚玲 成家军 张方琪 李志奎
支气管哮喘(哮喘)是由多种细胞和细胞组分共同参与并相互作用而导致的复杂的气道慢性炎症性疾病。发病机制诸多,目前认为Th2占优势的Th1/Th2失衡是造成哮喘的发病基础。Th2型细胞因子如IL-4、IL-5、IL-13等在哮喘病理特征性细胞嗜酸性粒细胞(eosinophils,EOS)的聚集、活化和脱颗粒中起重要的作用,其中IL-5尤为重要。而EOS在气道的浸润程度与哮喘病情的严重程度密切相关,减少肺内EOS的浸润及促进其凋亡明显有助于缓解哮喘气道炎症水平[1-3]。IL-5是通过与IL-5R受体复合物作用于EOS。IL-5R复合物包括α和β两种亚基。α亚基有膜结合型和可溶型两种不同的转录体,可溶性受体亚基可与膜结合型受体亚基竞争性结合配体从而达到对下游信号转导的负性调节,进而抑制EOS在气道炎症部位聚集,影响哮喘的发病过程。因此,本实验应用重组鼠IL-5可溶性受体α(sIL-5Rα)蛋白对哮喘小鼠进行干预,观察其对嗜酸性粒细胞趋化因子(eotaxin)水平、 EOS凋亡率以及对凋亡蛋白Bax的影响。
材料与方法
一、材料与试剂
1. 实验动物:健康、雌性BALB/c小鼠(20±3 g),由第四军医大学实验动物中心供给,以无卵蛋白饲料喂养,饲养环境温度为16±5 ℃,湿度61.5±10%。
2. 主要试剂和仪器:OVA (美国Sigma公司),氢氧化铝凝胶(新乡华兰生物公司),IL-5可溶性受体α(sIL-5Rα)(本课题组表达及纯化[4]),ELISA试剂盒(上海西唐生物科技有限公司),POD-TUNEL试剂盒(德国Roche公司),Bax免疫组化试剂盒(武汉博士德生物工程有限公司);超声波雾化器(江苏鱼跃医疗设备有限公司),高速低温离心机(美国Backman公司),BSA-CW电子天平(德国赛多利斯集团),全自动酶联免疫分析仪(美国Thermo公司),光学显微镜(日本Olympus公司)。
二、实验方法
1. 实验动物分组:实验小鼠随机分为3组,每组12只,分别为正常对照组、哮喘组、sIL-5Rα治疗组。
2. 模型制备与干预:哮喘组和sIL-5Rα治疗组分别于致敏过程的第0、7、14 天腹腔注射给予20 μg OVA和 20 mg Al(OH)3凝胶0.9%氯化钠混合液总共200 μl进行致敏,正常对照组小鼠腹腔注射相同体积0.9%氯化钠溶液。致敏过程的第21至27天将小鼠(正常对照组除外)置于封闭容器中,超声波雾化吸入5% OVA生理盐水诱发哮喘,每次雾化30 min,每天一次;其中sIL-5Rα治疗组小鼠于诱发前30 min腹腔注射给予重组sIL-5Rα蛋白100 μg。正常对照组和哮喘组激发前30 min腹腔注射相同体积0.9%氯化钠溶液;正常对照组用0.9%氯化钠溶液代替卵蛋白进行激发。
3. 取支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞计数:各组小鼠末次给药24 h后眼球取血处死,暴露气管行气管插管,0.8 ml预冷的磷酸盐缓冲溶液(phosphate buffered solution,PBS)灌洗双肺,停留并按摩肺部片刻后回收灌洗液(回收率大于80%),重复进行三次。BALF在低温下1500 r/min离心10 min后,回收BALF上清保存于-20 ℃,待细胞因子检测。0.2 ml PBS液重悬细胞沉淀,取10 μl重悬液注入计数板,由细胞计数仪计数白细胞总数(WBC);另取20 μl重悬液涂片,经瑞氏染色后总共计数200个白细胞,计算EOS百分比。
4. 肺组织标本处理:支气管肺泡灌洗操作完毕后,无菌操作下切取一侧肺组织,4%多聚甲醛固定24 h,常规石蜡包埋、切片,分别进行HE染色观察肺组织病理改变、TUNEL法测定肺组织EOS原位凋亡和免疫组化法(SP法)检测肺组织Bax蛋白的表达情况。
5. BALF中细胞因子检测:采用双抗体夹心酶联免疫吸附(ELISA)法,检测BALF中IL-5、Eotaxin水平,操作严格按照说明书进行。
6. 肺组织EOS凋亡检测:采用末端脱氧核苷酸转移酶介导的d-UTP切口末端标记 (TdT-mediated dUTP Nick-End Labeling,TUNEL)法检测肺组织EOS凋亡情况,具体操作严格按照TUNEL试剂盒说明书进行,以细胞核有明显棕黄色为阳性细胞。肺组织石蜡包块行2 μm连续切片,分别行常规HE染色和TUNEL染色检测原位凋亡细胞[5];选取连续切片的3个相同视野,通过结合对比计数连续切片同一面积下EOS数目和TUNEL阳性EOS数目,取平均值计算EOS凋亡率。
7. 免疫组织化学(SP法)观察肺组织Bax蛋白的表达:免疫组化具体实验步骤严格参照试剂盒提供的说明书进行操作。结果以胞浆内Bax蛋白呈黄染或棕黄色为阳性细胞;由同一观察者高倍镜下随机选取3个视野,计算肺组织Bax阳性面积的百分比,取平均值代表Bax蛋白的表达情况。
三、统计学方法

结 果
一、 各组小鼠激发时行为的改变
哮喘组小鼠经激发后行为改变明显,主要表现为烦躁不安、抓鼻等面部及躯干瘙痒症状,同时有点头呼吸、呼吸急促,二便失禁等。而sIL-5Rα治疗组上述症状在频率和程度上较哮喘组明显减轻;正常组未见上述症状。
二、 各组小鼠肺组织的病理改变
正常对照组小鼠支气管和肺泡结构清晰,周围基本无炎性细胞浸润。哮喘组小鼠可见支气管及肺泡间隔周围有大量炎性细胞浸润,气道有损伤、裂痕、且有气道基膜增厚、形态不规则等现象。与哮喘组相比,sIL-5Rα治疗组小鼠炎症细胞浸润明显减少、病理损害明显减轻,见图1。
三、 BALF中白细胞总数及EOS数目百分比
与正常组对照小鼠相比,哮喘组小鼠BALF中WBC总数、EOS比例显著提高,差异有统计学意义(P<0.01)。与哮喘组小鼠比较,sIL-5Rα治疗组小鼠上述指标均显著下降,差异有统计学意义(P<0.01),见表1。

表1 各组小鼠BALF中白细胞总数、EOS比例的比较
四、 BALF中细胞因子IL-5、Eotaxin水平
与正常对照组小鼠比较,哮喘组BALF中细胞因子IL-5、Eotaxin的水平明显增高,差异有统计学意义(P<0.01)。与哮喘组小鼠相比,sIL-5Rα治疗组BALF中,IL-5、Eotaxin水平显著下降,差异有统计学意义(P<0.01),见表2。
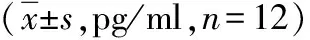
表2 各组小鼠BALF中IL-5及Eotaxin水平的比较

注:A:正常对照组;B:哮喘组;C:sIL-5Rα治疗组
五、 肺组织EOS的凋亡和Bax蛋白的表达
与正常组小鼠相比,哮喘组小鼠肺组织EOS凋亡比例以及Bax蛋白阳性面积显著下降,差异有统计学意义(P<0.01)。与哮喘组小鼠比较,sIL-5Rα治疗组EOS凋亡率和Bax阳性面积均显著提高,差异有统计学意义(P<0.01),见表3。

表3 各组小鼠肺组织EOS凋亡率及Bax蛋白表达量的比较
讨 论
支气管哮喘是以可逆性气流受限为特征的慢性炎症性疾病,常伴随气道高反应性、黏液高分泌、气道重塑等症状。目前学界普遍认为EOS是引起哮喘气道炎症的关键效应细胞,EOS在肺组织的凋亡延迟或凋亡抑制是导致哮喘气道炎症发展和持续的重要因素,IL-5和Eotaxin是导致EOS在肺部积累并延迟凋亡的重要原因[6-8]。EOS是碱性蛋白、半胱氨酰、白三烯等、以及一系列的细胞因子和趋化因子的丰富来源,这些细胞产物通过相互作用参与哮喘各个发病环节,引起气道上皮损伤、支气管收缩、微血管渗漏、炎症细胞聚集,气道重塑等[9]。因此,减少EOS在肺部的聚集以及促进其在肺部的凋亡是缓解支气管哮喘气道炎症的重要方式。细胞的凋亡是多方面调控机制的共同结果,其中若干基因以及细胞因子有着重要的调控作用。Bax基因位于19q13.3-13.4,由6个外显子组成,是重要的促凋亡基因,当Bax大量表达时,细胞凋亡增多。EOS的凋亡是由Bax解聚并从胞核或胞质中移至线粒体,线粒体随后释放细胞色素(cytochrome)C,扰乱线粒体膜电位,从而激活半胱天冬酶(caspase),导致EOS凋亡,而此过程可被IL-5所阻断[10]。而在EOS体外培养中,剥夺IL-5等细胞因子后,可迅速发生凋亡[11]。同时,抗IL-5单克隆抗体(mepolizumab) 的体内应用也能够显著减轻肺部EOS的浸润,改善哮喘的临床症状[12]。
因此,本实验通过应用sIL-5Rα对IL-5的进行靶向拮抗。实验表明sIL-5Rα能够明显减少EOS向肺部的聚集,下调IL-5、Eotaxin水平,促进EOS凋亡及上调Bax表达;促进了哮喘气道炎症的缓解。相比于抗IL-5单克隆抗体,sIL-5Rα具有更低的免疫原性,对机体刺激小,有望为哮喘的临床治疗提供一条新的途径。
参 考 文 献
1 Fulkerson PC,Rothenberg ME. Targeting eosinophils in allergy,inflammation and beyond[J]. Nat Rev Drug Discov,2013,12(2): 117-129.
2 张方琪,杨雪敏,唐元元,等. 嗜酸性粒细胞在哮喘发病机制中的研究进展[J/CD]. 中华肺部疾病杂志:电子版,2013,6(2):162-165.
3 李志伟,马千里,王长征. 支气管哮喘的炎症表型及其临床意义[J/CD]. 中华肺部疾病杂志: 电子版,2013,6(4): 341-345.
4 张悦鸣,姚慧娟,李志奎,等. 小鼠可溶性IL-5α受体在Bac-to-Bac系统中的表达及其鉴定[J]. 中国生物制品学杂志,2013,26(5): 611-615.
5 Kodama T,Matsuyama T,Miyata S,et al. Kinetics of apoptosis in the lung of mice with allergic airway inflammation[J]. Clin Exp Allergy,1998,28: 1435-1443.
6 Xu J,Jiang F,Nayeri F,et al. Apoptotic eosinophils in sputum from asthmatic patients correlate negatively with levels of IL-5 and eotaxin[J]. Resp Med,2007,101(7): 1447-1454.
7 Losol P,Kim SH,Shin YS,et al. A genetic effect of IL-5 receptor α polymorphism in patients with aspirin-exacerbated respiratory disease[J]. Exp Mol Med,2013,45(3): e14.
8 唐元元,张方琪,王 娟,等. 白介素-5嗜酸性粒细胞和支气管哮喘[J/CD]. 中华肺部疾病杂志: 电子版,2013,6(5): 457-460.
9 Snijders D,Agostini S,Bertuola F,et al. Markers of eosinophilic and neutrophilic inflammation in bronchoalveolar lavage of asthmatic and atopic children[J]. Allergy,2010,65(8): 978-985.
10 Dewson G,Cohen GM,Wardlaw AJ. Interleukin-5 inhibits translocation of Bax to the mitochondria,cytochrome c release,and activation of caspases in human eosinophils[J]. Blood,2001,98(7): 2239-2247.
11 Lee JJ,Rosenberg HF. Eosinophils in health and disease[M]. Access Online via Elsevier,2012.
12 Robinson D S. Mepolizumab treatment for asthma[J]. Expert Opin Biol Ther,2013,13(2): 295-302.

