水介质中糖基对甲苯磺酰肼/L-丙氨酸对aldol反应的选择性催化*
康新平,安 哲,周 天
(广东石油化工学院 化学工程学院,广东 茂名 525000)
·研究论文·
水介质中糖基对甲苯磺酰肼/L-丙氨酸对aldol反应的选择性催化*
康新平,安 哲,周 天
(广东石油化工学院 化学工程学院,广东 茂名 525000)
以氨基酸为催化剂,糖基对甲苯磺酰肼(Ⅰ)为助催化剂,研究了芳香醛(1)与酮在水溶液中的aldol反应。以对硝基苯甲醛(1a)和环己酮合成2-[羟基-(4-硝基苯基)]甲基环己酮(2a)为模型反应,考察了L-proline和Ⅰ的用量及底物用量[r=n(1a)∶n(环己酮)]对模型反应的影响。在最佳反应条件[以20mol%L-proline为催化剂,20mol%Ⅰ为助催化剂,水为溶剂,1a0.1mmol,r=1∶5,于室温反应72h]下,2a收率92%,syn/anti=10/90。在最佳反应条件下,对催化剂和反应底物进行扩展,结果表明:大多数天然氨基酸在添加多羟基胺类化合物后都可以在纯水溶液中催化环状酮与具有吸电子基的芳香醛之间的aldol反应。与水介质微乳中的L-丙氨酸催化体系相比反应底物明显拓宽,与水介质微乳中的线性氨基酸催化体系相比,选择性明显提高。
糖基对甲苯磺酰肼;氨基酸;aldol反应;合成;选择性催化
近年来,aldol不断被赋予新的研究方法。目前,aldol反应的催化剂主要包括羟醛酶催化[1-2]、Lewis酸催化[3-4]和碱催化(包括有机碱)[5-6]等。羟醛酶催化虽然具有高效性,但由于
较高的专一性,其催化的底物范围受到极大限制。多过渡金属和稀土金属所形成的Lewis酸不仅价格昂贵,还具有一定的毒性,广泛应用对环境有着潜在的破坏性。因此,当不含金属的有机小分子L-丙氨酸催化的直接的aldol反应被List等[7]报道后,立刻引起人们极大关注[8-9]。
通过研究L-丙氨酸催化aldol反应机理发现:L-丙氨酸的催化机理和Type I羟醛酶的催化机理相似[10]。L-丙氨酸的刚性五圆环结构一度被认为是氨基酸催化必备条件。Cordova等[11]报道了非环状氨基酸在DMSO溶液中催化的aldol反应,从而否定了刚性五圆环结构催化的必要性,开创了氨基酸催化的另一片天地。各种天然手性氨基酸因此成为催化aldol反应的重要工具。

虽然氨基酸催化被誉为‘最小的酶催化’[12],但是和酶催化相比,氨基酸催化最大的不足是只能在DMSO等有机溶剂中得到高选择性的aldol反应产物。虽然在催化体系中有极少量的水存在时,可以增加反应速度提高反应的选择性,但是当大量水存在时,氨基酸通常会失去催化活性,或得到选择性较低、底物范围较窄的aldol反应产物。Peng等[13]在水溶液中用表面活性剂辅助L-丙氨酸催化了硝基苯甲醛与酮的反应,醛类底物仅限于硝基苯甲醛,得到适中选择性目标产物;Deng等[14]用表面活性剂辅助线性氨基酸在水溶液中催化了芳香醛和酮的反应,底物范围有了进一步提高,但是选择性总体来说还是比较低;Zhou等[15]以联萘酚为添加剂成功地在DMSO中提高了L-丙氨酸催化aldol反应的产率和ee值;Hanessian等[16]以胺类作为添加剂和L-丙氨酸联合使用,在氯仿中成功地催化了环状酮与硝基烷的反应。由此可见,使用添加剂可以提高或增加氨基酸的催化能力。
本文以L-丙氨酸为催化剂,糖基对甲苯磺酰肼(Ⅰ)为助催化剂,研究了芳香醛(1a~1h)与酮(环己酮,环戊酮和丙酮)在水溶液中的aldol反应(Scheme 1)。以对硝基苯甲醛(1a)和环己酮合成2-[羟基-(4-硝基苯基)]甲基环己酮(2a)为模型反应,考察了L-丙氨酸和Ⅰ的用量及底物用量[r=n(1a)∶n(环己酮)]对模型反应的影响。在最佳反应条件[以20mol%L-丙氨酸为催化剂,20mol%Ⅰ为助催化剂,水为溶剂,1a0.1mmol,r=1∶5,于室温反应72h]下,2a收率92%,syn/anti=10/90。
在最佳反应条件下,对催化剂和反应底物进行扩展,结果表明:大多数天然氨基酸在添加多羟基胺类化合物后都可以在纯水溶液中催化环状酮与具有吸电子基的芳香醛之间的aldol反应。与水介质微乳中的L-丙氨酸催化体系相比反应底物明显拓宽,与水介质微乳中的线性氨基酸催化体系相比,选择性明显提高。
1 实验部分
1.1 仪器与试剂
Varian INOVA-300NB型超导核磁共振仪(CDCl3为溶剂,TMS为内标);Shimadzu LCMS-2010A型质谱仪。
1a~1h,环己酮,环戊酮,丙酮和氨基酸,中国医药集团上海化学试剂厂;其余所用试剂均为分析纯。
1.2 2~4的合成
在圆底烧瓶中依次加入水1mL,20mol%Ⅰ和20mol%氨基酸,搅拌下加入10.1mmol和酮0.5mmol,于室温反应72h(TLC检测)。用乙酸乙酯(3×10mL)萃取,合并有机相,用饱和盐水洗涤,无水硫酸镁干燥,旋蒸除溶后经硅胶柱色谱[洗脱剂:V(乙酸乙酯)∶V(石油醚)=1∶5]纯化得白色固体2a~2h,3a,3b和4a。
2-[羟基-(4-硝基苯基)]甲基环己酮(2a):收率95%,syn/anti=4/96;1H NMRδ:8.17(d,J=9.5Hz,2H,ArH),7.46(d,J=9.5Hz,2H,ArH),5.48(syn,d,J=2.5Hz,0.04H,6-H),4.89(anti,d,J=7.1Hz,0.96H,6-H),2.64~1.36(m,9H,1~5-H);ESI-MSm/z:272{[M+Na]+}。
2-[羟基-(3-硝基苯基)]甲基环己酮(2b):收率85%,syn/anti=6/94;1H NMRδ:8.22~7.52(m,4H,ArH),5.41(syn,d,J=2.0Hz,0.06H,6-H),4.89(anti,d,J=7.0Hz,0.94H,6-H),2.62~1.35(m,9H,1~5-H);ESI-MSm/z:272{[M+Na]+}。
2-[羟基-(2-硝基苯基)]甲基环己酮(2c):收率69%,syn/anti=3/97;1H NMRδ:7.86~7.40(m,4H,ArH),5.93(syn,d,J=3.1Hz,0.03H,6-H),4.89(anti,d,J=7.1Hz,0.97H,6-H),4.22(br,1H,OH),2.76~1.64(m,9H,1~5-H);ESI-MSm/z:281{[M+K]+}。
2-[羟基-(4-溴-苯基)]甲基环己酮(2d):收率78%,syn/anti=10/90;1H NMRδ:7.96~7.18(m,4H,ArH),5.93(syn,d,J=2.7Hz,0.10H,6-H),4.89(anti,d,J=6.9Hz,0.97H,6-H),2.63~1.26(m,9H,1~5-H);ESI-MSm/z:322{[M+K]+}。
2-[羟基-(4-氯-苯基)]甲基环己酮(2e):收率65%,syn/anti=8/92;1H NMRδ:7.98~7.15(m,4H,ArH),5.92(syn,d,J=2.9Hz,0.08H,6-H),4.87(anti,d,J=6.8Hz,0.92H,6-H),2.60~1.32(m,9H,1~5-H);ESI-MSm/z:261{[M+Na]+}。
2-(羟基-苯基)甲基环己酮(2f):收率56%,syn/anti=9/91;1H NMRδ:7.82~7.12(m,4H,ArH),5.45(syn,d,J=3.2Hz,0.09H,6-H),4.87(anti,d,J=6.8Hz,0.91H,6-H),2.59~1.34(m,9H,1~5-H);ESI-MSm/z:227{[M+Na]+}。
2-[羟基-(4-三氟甲基-苯基)]甲基环己酮(2g):收率87%,syn/anti=9/91;1H NMRδ:8.22~7.41(m,4H,ArH),5.44(syn,d,J=3.0Hz,0.09H,6-H),4.83(anti,d,J=6.9Hz,0.91H,6-H),2.62~1.34(m,9H,1~5-H);ESI-MSm/z:295{[M+Na]+}。
2-[羟基-(4-羧基-苯基)]甲基环己酮(2h):收率89%,syn/anti=17/83;1H NMRδ:8.07(d,J=7.8Hz,2H,ArH),7.43(d,J=7.8Hz,2H,ArH),5.47(syn,d,J=2.9Hz,0.17H,6-H),4.83(anti,d,J=6.9Hz,0.83H,6-H),2.67~1.26(m,9H,1~5-H);ESI-MSm/z:287{[M+K]+}。
2-[羟基-(4-硝基苯基)]甲基环戊酮(3a):收率96%,syn/anti=30/70;1H NMRδ:8.19(d,J=8.7Hz,2H,ArH),7.52(d,J=8.7Hz,2H,ArH),5.41(syn,d,J=2.4Hz,0.30H,6-H),4.83(anti,d,J=7.4Hz,0.70H,6-H),2.52~1.72(m,7H,1~5-H);ESI-MSm/z:258{[M+Na]+}。
2-[羟基-(3-硝基苯基)]甲基环戊酮(3b):收率83%,syn/anti=29/71;1H NMRδ:8.19~7.52(m,4H,ArH),5.42(syn,d,J=2.3Hz,0.29H,6-H),4.82(anti,d,J=7.2Hz,0.71H,6-H),2.53~1.74(m,7H,1~5-H);ESI-MSm/z:258{[M+Na]+}。
4-羟基-4-(4-硝基苯基)-2-丁酮(4a):收率52%;1H NMRδ:8.19~7.52(m,4H,ArH),5.24(t,J=5.2Hz,1H,6-H),2.86(d,J=5.2Hz,2H,CH2),2.22(s,3H,CH3);ESI-MSm/z:232{[M+Na]+}。
2 结果与讨论
2.1 反应条件优化
以1a和环己酮合成2a为模型反应,L-丙氨酸为催化剂,考察诸因素对模型反应的影响,对反应条件进行优化。
(1)助催化剂
以L-丙氨酸(20mol%)为催化剂,1a20mg(0.1mmol),环己酮50mg(0.5mmol),于室温反应72h,其余反应条件同1.2,考察助催化剂对模型反应的影响,结果见表1。由表1可见,糖基添加剂对反应有明显的辅助催化作用,其中Ⅰ的辅助催化效果最好,2a收率最高(92%,syn/anti=10/90)。无添加剂时,L-丙氨酸基本不能催化模型反应,仅有少量产物生成;以表面活性剂SDS作添加剂时,也仅得少量2a,与文献[18]结论一致。由此可见,Ⅰ是模型反应最理想的添加剂。

表1 助催化剂对模型反应的影响*Table1 Effect of cocatalyst on model reaction
*L-丙氨酸(20mol%),1a20mg(0.1mmol),环己酮50mg(0.5mmol),于室温反应72h,其余反应条件同1.2;a分离产率;b由1H NMR测试
(2)催化剂和助催化剂用量
以L-丙氨酸为催化剂,Ⅰ为助催化剂,其余反应条件同2.1(1),考察其用量对模型反应的影响,结果见表2。
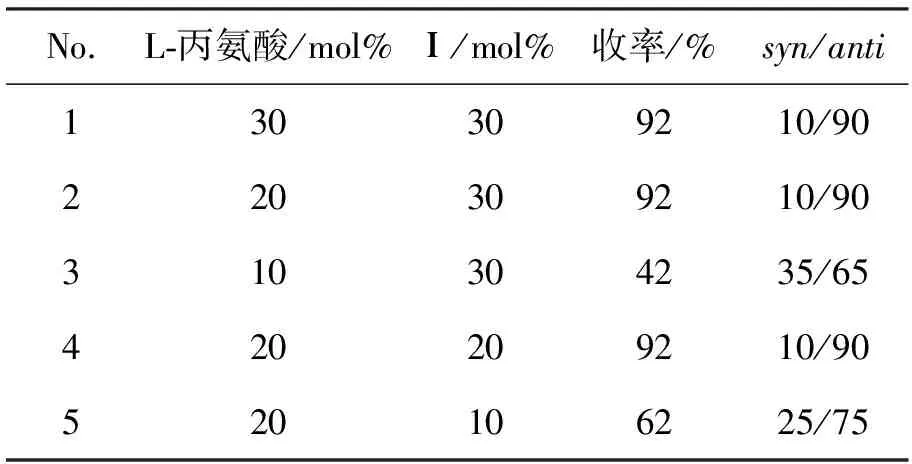
表2 催化剂和助催化剂用量对模型反应的影响*Table2 Effect of catalyst and cocatalyst amount on model reaction
*L-丙氨酸为催化剂,Ⅰ为助催化剂,其余同表1
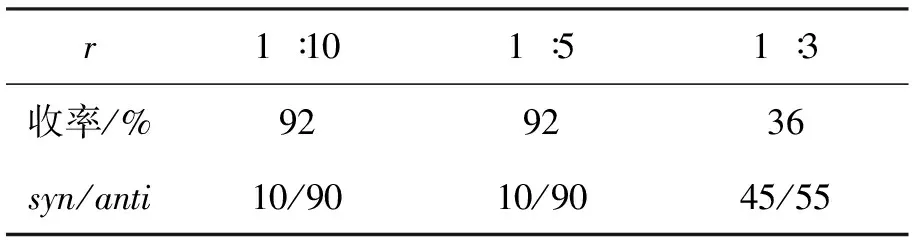
表3 r对模型反应的影响*Table3 Effect of r on model reaction
*r=n(1a)∶n(环己酮);20mol%L-丙氨酸,20mol%Ⅰ;其余同表1
氨基酸催化反应时用量一般为30mol%。实验中,首先30mol%L-丙氨酸和30mol%Ⅰ进行aldol反应,得到较好的收率(93%)和选择性(syn/anti=10/90)(No.1)。助催化剂用量不变,降低L-丙氨酸用量至20mol%,得到同样的反应结果(No.2);但L-丙氨酸用量降至10mol%时,则反应的收率和选择性都有很大的降低(No.3)。
L-丙氨酸用量20mol%,改变助催化剂用量为20mol%时,同样可以得到理想的反应结果(No.4);但当其用量降至10mol%,收率和选择性都有所下降(No.5)。由此可见:L-丙氨酸和Ⅰ.的最佳用量均为20mol%。
(3)底物用量[r=n(1a)∶n(环己酮)]
L-丙氨酸(20mol%)和Ⅰ.(20mol%)为联合催化剂,其余反应条件同2.1(1),考察r对模型反应的影响,结果见表3。从表3可见,r=1∶5与r=1∶10的反应结果相似;r=1∶3时,2a的收率和选择性均快速下降。最佳r=1∶5。
综上所述,合成2a的最佳反应条件为:以20mol%L-丙氨酸为催化剂,20mol%Ⅰ为助催化剂,水为溶剂,1a0.1mmol,r=n(1a)∶n(环己酮)=1∶5,于室温反应72h,2a收率92%,syn/anti=10/90。
2.2 催化剂和底物扩展
(1)催化剂
在最佳反应条件[20mol%Ⅰ为添加剂,水为溶剂,1a0.1mmol,r=n(1a)∶n(环己酮)=1∶5,于室温反应72h]下,考察催化剂(不同氨基酸)对模型反应的影响,结果见表4。由表4可见,大部分天然氨基酸在Ⅰ的辅助下都能较好的催化水溶液中的aldol反应,其中L-isolecine的产率和选择性最好,L-alanine,L-valine,L-leucine和L-serine等也有较好的催化效果。L-proline在Ⅰ的辅助下,也能够有效地催化aldol反应(No.8)。然而,同样带有氨基和羧酸基团的氨基磺酸对反应催化效果相对较差。因此选定L-isolecine和Ⅰ为理想的催化剂组合。
(2)底物扩展
在最佳反应条件[20%L-isolecine为催化剂,20mol%Ⅰ为助催化剂,水为溶剂,1a0.1mmol,r=n(1a)∶n(环己酮)=1∶5,于室温反应72h]下研究了底物的适用范围,结果见Scheme 1。由Scheme 1和各产物的收率可知,底物醛一般局限于具有吸电子基的芳香醛,并且吸电子性越强反应效果越好。实验中也尝试用具有给电子基的芳香醛作为底物,但是没有得到相应的aldol反应产物。环戊酮作为酮底物选择性明显要比环己酮的差,可能和二者的空间结构有关。底物酮也不只限于环状酮,丙酮也能作为酮底物参与反应,但收率不是很理想(4a)。
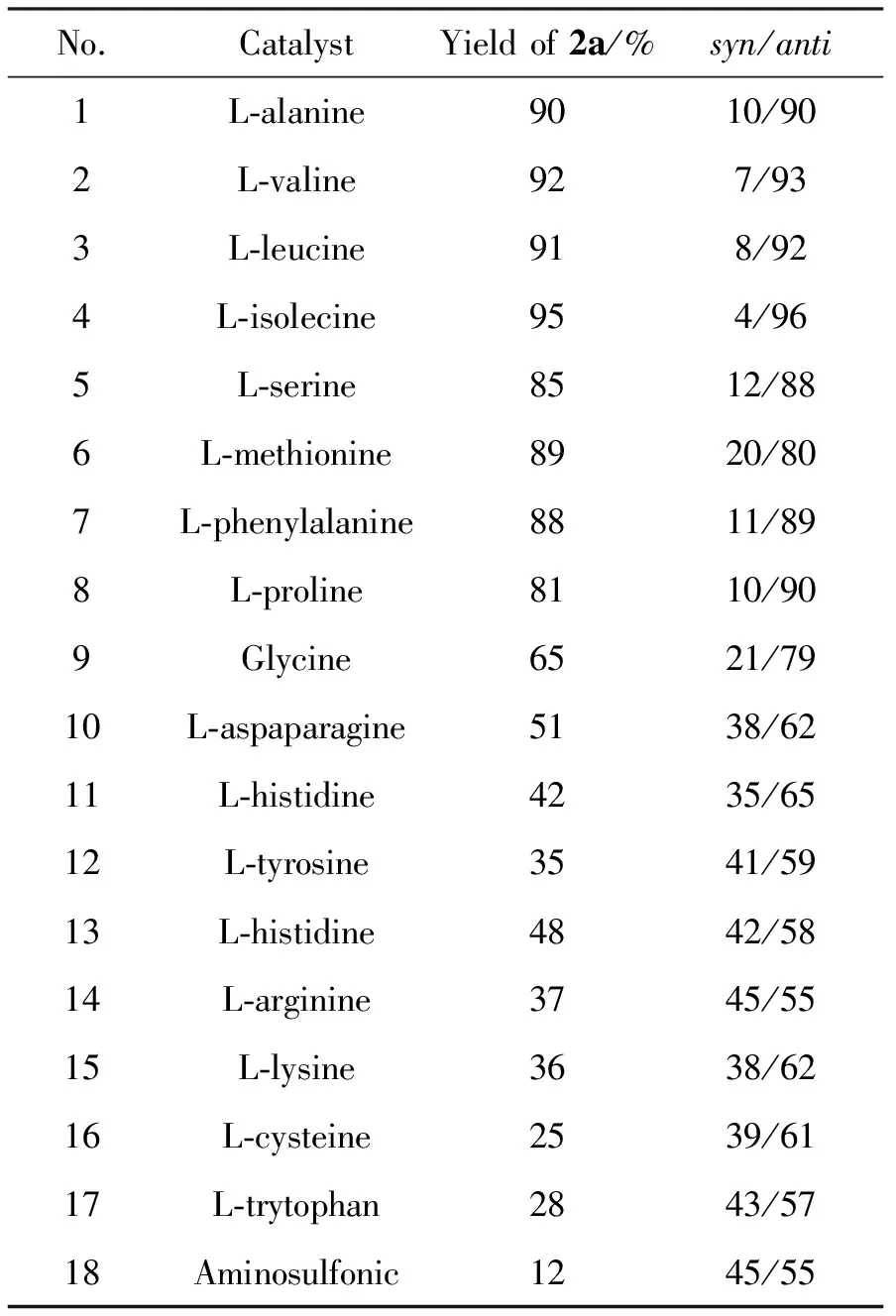
表4 催化剂对模型反应的影响*Table4 Effect of catalyst on model reaction
*20mol%氨基酸,20mol%Ⅰ,r=1∶5,其余同表1
3 结论
糖基苯甲酰肼作为一种高效的辅助催化剂,辅助氨基酸催化了水介质中aldol反应。氨基酸催化的范围进一步拓宽,反应的底物有所增加。反应在常温常压水介质中进行,为进一步深入研究氨基酸催化aldol反应的“绿色化”奠定了基础。
[1] Gijsen H J,Qiao L,Fitz W,etal.Recent advance in the chemoenzymatic synthesis of carbohydrates and carbohydrate mimetics[J].Chem Rev,1996,96:443-474.
[2] Machajewski T D,Wong C H.The catalytic asymmetric aldol reaction[J].Angew Chem Int Ed,2000,39:1352-1374.
[3] Kobayashi S,Nagayama S,Busujima T.Lewis acid catalysts stable in water.Correlation between catalytic activity in water and hydrolysis constants and exchange rate constants for cubstitution of inner-sphere water ligands[J].J Am Chem Soc,1998,120:8287-8288.
[4] Yamshita Y,Ishitani H,Shimizu H,etal.Highly anti-selective asymmetric aldol reactions using chiral zirconium catalysts.Improvement of activities,structure of the novel zirconium complexs,and effect of a small amount of water for the preparation of the catalysts[J].J Am Chem Soc,2002,124:3292-3293.
[5] Mase N,Nakai Y,Ohara N,etal.Organocatalytic direct asymmetric aldol reactions in water[J].J Am Chem Soc,2006,128:734-735.
[6] Cordova A,Notz W,Barbas Iii C F.Direct organocatalytic aldol reactions in buffered aqueous media[J].Chem Commun,2002:3024-3025.
[7] List B,Lemer R,Barbas Iii C F.Proline-catalyzed direct asymmetric aldol reactions[J].J Am Chem Soc,2000,122:2395-2396.
[8] Notz W,Tanka F,Barbas III C F.Enanmine-based organocatalysis with proline and diamines:The development of direct catalytic asymmetric aldol,mannich-type,Michael,and Diels-alder reactions[J].Acc Chem Res,2004,37:580-591.
[9] Cordova A,Notz W,Barbas III C F.Proline-catalyzed one-step asymmetric synthesis of 5-hydroxy-(2E)-hexenal from acetaldehyde[J].J Org Chem,2002,67:301-303.
[10] Hoang L,Bahmanyar S,Houk K N,etal.Kinetic and stereochemical evidence for the involvement of only one proline molecule in the transition states of proline-catalyzed intra- and intermolecular aldol reactions[J].J Am Chem Soc,2003,125:16-17.
[11] Cordova A,Zou W B,Ibrahem I,etal.Acyclic amino acid-catalyzed direct asymmetric aldol reactions:Alanine,the simplest stereoselective organocatalyst[J].Chem Commun,2005:3586-3588.
[12] Movassaghi M,Jacobsen E N.Chemistry:the simplest enzyme[J].Science,2002,298:1904-1905.
[13] Peng Y Y,Ding Q P,Li Z C,etal.Proline catalyzed aldol reactions in aqueous micelles:An environmentally friendly reaction system[J].Tetrahedron Lett,2003,44:3871-3875.
[14] Deng D S,Cai J.Stereoselective aldol reactions catalyzed by acyclic aminoacids in aqueous micelles[J].Helv Chim Acta,2007,90:114-119.
[15] Zhou Y,Shan Z.(R)- or (S)-Bi-naphthol assisted,L-proline catalyzed direct aldol reaction[J].Tetrahedron:Asymmetry,2006,17:1671-1677.
[16] Hanessian S,Pham V.Catalytic asymmetric conjugate addition of nitroalkanes to cycloalkenones[J].Org Lett,2000,2:2975-2978.
SelectiveCatalysisofGlycosyl-tolysulfonyhydraine/L-ProlineCatalyzedaldolReactioninWater
KANG Xin-ping,AN Zhe,ZHOU Tian
(College of Chemical Engineering,Guangdong University of Petrochemical Technology,Maoming 525000,China)
Aldol reaction of aromatic aldehydes with ketone were investigated using amino acid as the catalyst and glycosyl-tolysulfonyhydraine(Ⅰ)as the cocatalyst in water.Effect of L-proline and Ⅰ amount,substrates[r=n(1a)∶n(cyclohexanone)] amount on aldol reaction were discussed by the reaction of 4-nitrobenzaldehyde with cyclohexanone to 2-[hydroxy-(4-nitrophenyl)]methylcyclohexanone(2a).The yield of2awas 92% andsyn/antiwas 10/90under optimum reaction conditions[L-proline was 20mol%,Ⅰ was 20mol%,rwas 1∶5,at room temperature for 72h].Most natural amino acids can catalyze aldol reaction in water assisted by Ⅰ.In comparison with surfactants assisted aldol reaction in water,the scope of substrates and the diastereoselectivity were improved effectively.
glycosyl-tolysulfonyhydraine;amino acid;aldol reaction;synthesis;selective catalysis
2014-03-13;
2014-05-20
广东石油化工学院人才引进基金资助项目(2010r-3)
康新平(1971-),女,汉族,安徽合肥人,博士,副教授,主要从事应用化学的研究。E-mail:kxp330@163.com
周天,教授,E-mail:zhoutian6688@126.com
O622.4
A
1005-1511(2014)04-0475-05

