(2β,3α,5α,16α,17β)-2-(4-吗啉基)-16-(1-吡咯烷基)-3,17-二羟基-雄甾烷的合成工艺改进*
金 灿,梁德帅,金炜华,苏为科
(1.浙江工业大学 药学院 绿色制药技术与装备教育部重点实验室,浙江 杭州 310014;2.台州仙琚药业有限公司,浙江 临海 317024)
·制药技术·
(2β,3α,5α,16α,17β)-2-(4-吗啉基)-16-(1-吡咯烷基)-3,17-二羟基-雄甾烷的合成工艺改进*
金 灿1,梁德帅1,金炜华2,苏为科1
(1.浙江工业大学 药学院 绿色制药技术与装备教育部重点实验室,浙江 杭州 310014;2.台州仙琚药业有限公司,浙江 临海 317024)
以2α,3α,16α,17α-双环氧-5α-17β-乙酰氧基-雄甾烷为原料,三氟甲磺酸镱为催化剂,经两次环氧开环反应合成了罗库溴铵的关键中间体——(2β,3α,5α,16α,17β)-2-(4-吗啉基)-16-(1-吡咯烷基)-3,17-二羟基-雄甾烷,总收率64%,其结构经1H NMR,13C NMR和ESI-MS确证。
罗库溴铵;三氟甲磺酸镱;(2β,3α,5α,16α,17β)-2-(4-吗啉基)-16-(1-吡咯烷基)-3,17-二羟基-雄甾烷;药物合成;工艺改进
罗库溴铵(Ⅰ)是荷兰欧加农公司开发的非去极化型骨骼肌松弛药,临床上做作为麻醉辅助用药,主要用于麻醉时的气管插管和手术中的肌肉松弛[1-2]。和同类药物相比,Ⅰ具有起效快、副作用小等优点[3-4],是一个具有良好市场前景的药物。
(2β,3α,5α,16α,17β)-2-(4-吗啉基)-16-(1-吡咯烷基)-3,17-二羟基-雄甾烷(1)是合成Ⅰ的关键中间体,其合成方法主要有两种:(1)以表雄酮为原料,经消除、溴代、环氧化、吡咯烷取代、吗啉取代、还原等六步反应制得1[5-7]。该路线冗长,且试剂对环境不友好;(2)以2α,3α,16α,17α-双环氧-5α-17β-乙酰氧基-雄甾烷(2)为原料,经羧酸酯的水解、吡咯烷的环氧开环、羰基的还原和吗啉的环氧开环等四步反应制得1,总收率36.8%[8]。该路线简单,已进行工业化生产,但存在收率低、吡咯烷和吗啉用量大、吗啉的环氧开环反应时间长等缺点。

Scheme 1
本文对路线(2)进行工艺改进。以2为原料,三氟甲磺酸镱为催化剂[9-11],经两次环氧开环反应合成了1(Scheme 1),总收率64%,其结构经1H NMR,13C NMR和ESI-MS确证。并对工艺进行了优化。
改进工艺的总产率由36.8%[8]提高至64%,吡咯烷用量由6eq.减少至3eq.,吗啉用量由13eq.减少至6eq.,吗啉开环反应时间由72h减少至12h。
改进工艺具有总产率高、试剂用量少、适于工业化生产等优点。
1 实验部分
1.1 仪器与试剂
WRS-1A型数字熔点仪(温度未校正);Varian-400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Trace DSQ FINNIGSN型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1)4的合成
在三口瓶中加入23.46g(10mmol)和甲醇35mL,于室温搅拌使其呈乳白色悬浊液。加入NaOH 0.60g(15mmol)与水3mL,回流反应30min。冷却至35℃,加入Yb(OTf)3186mg(0.3mmol),于40min内滴加吡咯烷2.13g(30mmol),滴毕,继续反应50min。反应液转移至烧杯,加冷水150mL,析出白色固体,过滤,滤饼用正己烷重结晶得白色固体42.49g,产率约71%,m.p.168℃~169℃;1H NMRδ:0.70(t,J=11.0Hz,1H),0.78(s,3H),1.91(s,3H),1.00~1.64(m,12H),1.79(s,6H),1.91(dd,J=15.1Hz,5.9Hz,2H),2.03~2.17(m,1H),2.59(d,J=6.0Hz,2H),2.74(t,J=10.7Hz,2H),2.86~2.96(m,1H),3.12(dd,J=13.8Hz,8.4Hz,2H);13C NMRδ:13.06,14.08,20.19,23.39,26.95,28.21,29.11,30.80,32.12,34.64,36.38,38.30,47.08,50.83,51.93,52.27,54.06,69.11,76.68,77.00,77.32;ESI-MSm/z:358.3{[M+H]+}。
(2)1的合成
在三口瓶中加入43.57g(10mmol),甲醇30mL和NaBH4950mg(25mmol),搅拌下于10℃反应2h。反应液转移至烧杯,加水100mL,析出白色固体,过滤,滤饼用CH2Cl220mL溶解,水(3×10mL)洗涤,无水硫酸钠干燥,减压蒸除溶剂得白色固体5。
在反应瓶中加入5,Yb(OTf)3186mg(3mol%),吗啉5.22g(60mmol)和水2mL,搅拌下回流反应12h。减压蒸除溶剂,残余物用丙酮重结晶得淡黄色固体14.01g,产率90%,m.p.213℃~220℃;1H NMRδ:0.70(s,3H),0.72~0.83(m,3H),0.87(s,4H),1.05~1.18(m,2H),1.31~1.54(m,12H),1.68~1.92(m,6H),2.43(s,2H),2.52~2.60(m,4H),2.74(s,2H),2.92(q,J=8.7Hz,2H),3.37(d,J=8.0Hz,2H),3.68(s,3H),3.86(s,1H);13C NMRδ:13.05,16.79,21.11,23.44,28.31,29.42,31.86,32.75,34.44,34.77,36.02,38.53,38.65,43.64,48.53,49.15,53.01,56.07,63.32,63.82,65.19,67.46,76.67,76.99,77.31,79.08;ESI-MSm/z:447.6{[M+H]+}。
2 结果与讨论
2.1 合成4的反应条件优化
(1)催化剂种类及其用量对4产率的影响
仅改变催化剂和用量,其余反应条件同1.2(1),考察催化剂及其用量对4产率的影响,结果见表1。从表1可看出,使用传统Lewis酸做催化剂时,产率还略有下降,可能是催化剂与反应液中的水反应而失活;在使用三氟甲磺酸盐时,产率有了明显提高,其中5mol%的Yb(OTf)3的催化效果最好;Yb(OTf)3用量为3mol%时,产率基本相同。最佳催化剂为Yb(OTf)3,用量为3mol%。

表1 催化剂及其用量对4产率的影响*Table1 Effects of catalysts and amount on the yield of 4
*反应条件同1.2(1)
(2)吡咯烷用量和滴加速度对4产率的影响
以Yb(OTf)3(3mol%)为催化剂,其余反应条件同1.2(1),考察吡咯烷用量和滴加速度对4产率的影响,结果见表2。从表2可见,吡咯烷用量过小,反应不完全;用量过大,使另一个环氧也开环,产生副产物,致使产率下降;3.0eq.的吡咯烷用量是较优条件。
从表2还可见,滴加速度快慢决定了反应中吡咯烷的即时浓度的大小,滴加时间为40min时,产率最高(70%)。

表2 吡咯烷用量和滴加速度对4产率的影响*Table2 Effects of pyrrolidine amount and titration rapid on yield of 4
*Yb(OTf)3(3mol%)为催化剂,其余反应条件同1.2(1)
(3)反应温度和时间对4产率的影响
Yb(OTf)3(3mol%)为催化剂,吡咯烷3.0eq.,滴加时间40min,其余反应条件同1.2(1),考察反应温度和时间对4产率的影响,结果见表3。从表3可看出,在相同反应条件下,于35℃反应50min为较佳反应条件,4的产率最高(71%)。

表3 反应温度和时间对4产率的影响*Table3 Effects of temperature and time on yield of 4
*Yb(OTf)3(3mol%)为催化剂,吡咯烷3.0eq.,滴加时间40min,其余反应条件同1.2(1)
2.2 合成1的反应条件优化
(1)Yb(OTf)3和吗啉用量对1收率的影响
反应条件同1.2(2),考察Yb(OTf)3和吗啉用量对1产率的影响,结果见表4。从表4可看出,Yb(OTf)3用量为3mol%,吗啉用量为6eq.时,产率较理想(90%);继续增加其用量,很难进一步提高产率。

表4 Yb(OTf)3和吗啉用量对1产率的影响*Table4 Effects of amount of Yb(OTf)3and morpholine on yield of 1
*反应条件同1.2(2)
(2)反应时间对1产率的影响
Yb(OTf)33mol%,吗啉6eq.,其余反应时间同1.2(2),考察反应时间对1产率的影响,结果见表5。从表5可看出,反应12h时产率达最高(90%);继续延长反应时间并不能提高产率。
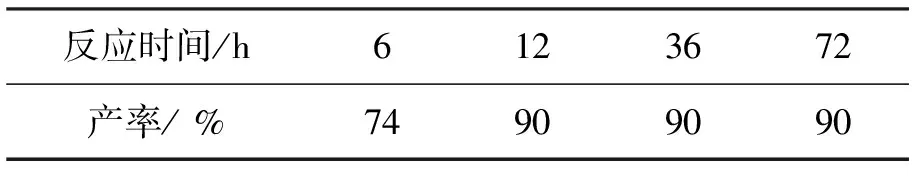
表5 反应时间对1产率的影响*Table5 Effects of reaction time on yields of 1
*Yb(OTf)33mol%,吗啉6eq.,其余反应条件同1.2(2)
综上所述,合成4的最佳反应条件为:以Yb(OTf)3(3mol%)为催化剂,吡咯烷3.0eq.,于35℃反应50min,4的产率71%。
合成1的最佳反应条件为:以Yb(OTf)3(3mol%)为催化剂,吗啉6.0eq.,回流反应12h,产率90%。
[1] Sparr H J,Beaufort T M,Fuchs-Buder T.Newer neuromuscular blocking agents-How do they compare with established agents[J].Drugs,2001,61(7):919-942.
[2] Karcioglu O,Arnold J.Succinyl-choline or rocuronium a meta-analysis of the effects on intubation conditions[J].International Journal of Clinical Practice,2006,60(12):1639-1646.
[3] McDonald P F,Sainsbury D A,Laing R J.Evaluation of the onset time and intubation conditions of rocuronium bromide in children[J].Anaesthesia and Intensive Care,1997,25(3):260-261.
[4] 龙跃,李准民,易礼清.新型肌松药-瑞库溴铵、罗库溴铵和顺式阿曲库铵的研究进展[J].河南医学研究,2006,15(3):267-271.
[5] Magni A.Process for preparing neuromuscular blocking agents and intermediates useful therefor[P].US 6090957,2000.
[6] 张龙涛,万升标,王诗玺,等.罗库溴铵的合成方法研究[J].中国海洋大学学报(自然科学版),2007,37(4):147-150.
[7] 张永明,郭佳,熊涛,等.罗库溴铵的合成研究[J].中国药物化学杂志,2008,18(6):434-438.
[8] Savage D S,Sleig T,Carlyle I G.Prepara-tion of 16-heterocyclyl-2β-morpholino-androstanes as neuromuscular blocking agents[P].EP 0287150,1988.
[9] Curini M,Epifano F,Marcotullio M C,etal.Ytterbium triflate promoted synthesis of 1,5-benzodiazepine derivatives[J].Tetrahedron Letters,2001,42(18):3193- 3195.
[10] Su WK,Jin C.Ytterbium triflate catalyzed friedel-crafts reaction:Facile synthesis of diaryl ketones[J].Synthetic Commu-nications,2004,34(23):4249-4256.
[11] Su W K,Jin C.First catalytic and green synthesis of aryl-(Z)-vinyl chlorides and its plausible addition-elimination mecha-nism[J].Organic Letters,2007,9(6):993-996.
ProcessImprovementontheSynthesisof(2β,3α,5α,16α,17β)-2-(4-morpholinyl)-16-(1-pyrrolidinyl)-androstan-3,17-diol
JIN Can1, LIANG De-shuai1, JIN Wei-hua2, SU Wei-ke1
(1.Key Laboratory for Green Pharmaceutical Technologies and Related Equipment of Ministry of Education,College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China;2.Taizhou Xianju Pharmaceutical Co.,Ltd.,Linhai 317024,China)
A key intermediate of Rocuronium bromide,(2β,3α,5α,16α,17β)-2-(4-morpholinyl)-16-(1-pyrrolidinyl)-androstan-3,17-diol,was synthesized in total yield of 64% by two ring-opening reactions of epoxide using 2α,3α,16α,17α-di-epoxides-5α-17β-acetoxy-androstane as the raw material and ytterbium triflate as the catalyst.The structures were confirmed by1H NMR,13C NMR and ESI-MS.
Rocuronium bromide;ytterbium triflate;(2β,3α,5α,16α,17β)-2-(4-morpholinyl)-16-(1-pyrrolidinyl)-androstan-3,17-diol;drug synthesis;process improvement
2013-04-13;
2014-05-06
浙江省重点科技创新团队——绿色制药工艺科技创新团队资助项目(2010R50043)
金灿(1981-),男,汉族,浙江东阳人,副教授,硕士生导师,主要从事新药开发、药物合成工艺、绿色化学技术开发研究。Tel.0571-88871087,E-mail:jincan@zjut.edu.cn
苏为科,教授,博士生导师,Tel.0571-88320752,E-mail:pharmlab@zjut.edu.cn
O621.3;R914.5
A
1005-1511(2014)04-0565-04

