miR-196b、miR-25在儿童急性髓细胞白血病中的表达及临床意义
徐丽华, 胡绍燕, 岑建农, 杨乃超, 洪 丹
(1. 苏州大学附属儿童医院 血液肿瘤科, 江苏 苏州, 215003;2. 苏州大学附属第一医院,江苏省血液病研究所血液科, 江苏 苏州, 215006;3. 江苏省连云港市第一人民医院 儿科, 江苏 连云港, 222002)
儿童急性髓细胞白血病(AML)是儿童造血系统髓源细胞恶性增殖性疾病,作为一种高度异质性疾病,其发生和发展是一个多基因多步骤异常的过程[1]。尽管根据国际先进治疗组的报道,其5年生存率已上升到了55%~65%[2], 但AML患儿的治疗反应和预后受多种因素影响,诱导失败和复发仍时有发生。传统的用于判断预后的细胞遗传学存在一定的缺陷,探索新的分子遗传学改变对预后的意义日趋重要。
微小RNA(以下简称microRNA /miRNA/miR)是一种内源性的非编码小分子RNA(长约22nt), 在转录后水平参与着人类约1/3基因的调控,影响着细胞的增殖、分化、凋亡,发挥着“促癌“或“抑癌”作用[3]。先前的诸多研究[4]已经报道了miRNA表达失控与成人AML的关系,例如,miR-25的表达与成人AML的总体生存率(OS)显著相关(P<0.05)。但迄今为止,对于miRNA在儿童AML中作用的研究尚不多。基于生物信息学分析结果,作者选择了miR-196b、miR-25作为研究对象,利用荧光定量聚合酶链反应(qRT-PCR)法,检测了这三种miRNA在儿童初诊AML和非白血病对照组儿童之间的表达差异,并结合临床资料分析其意义,现报告如下。
1 资料与方法
1.1 一般资料
以本院2012年3月—2013年12月确诊为AML的20例初诊患儿作为研究对象,其中男5例,女15例,年龄12~157个月,中位年龄81.5个月。20例AML患儿诊断均经临床及血常规、骨髓象及免疫组织化学染色等实验室检查确诊,部分患儿行染色体核型分析、29种融合基因筛查、AML突变组套检测、FISH检测,符合急性髓细胞白血病MIC (形态学细胞化学、免疫学、细胞遗传学) 分型诊断依据。根据国际通用的FAB分类法进行亚型分类,20例AML患儿中M2、M3、M4、M5、M6分别为4例、1例、6例、8例和1例。所有初诊AML患儿均采用2006年全国儿童AML化疗方案[5]。同期纳入20例非白血病儿童作为对照组。根据儿童急性髓细胞白血病诊疗建议[5], 进行危险度分组,低、中、高危组分别为5例、4例、11例。
1.2 方法
1.2.1 主要实验设备与试剂: 人淋巴细胞分离液(Ficoll)(上海华精高科技生物有限公司); TaqMan MicroRNA Reverse Transcription Kit (美国ABI公司); TaqMan 2×Universal PCR Master Mix, 5 mL(美国ABI公司); TaqMan MicroRNA Assays(20×)(美国 ABI 公司)(探针引物序列由ABI公司设计合成,编号分别为: hsa-miR-196b: 002215-PN4427975; hsa-miR-25: 002442-PN4427975; U6snRNA: 001973-PN4427975); Thermo3.2全波长酶标仪; ABI 9700 PCR反应仪; ABI 7500荧光定量PCR仪等。
1.2.2 标本采集: 抽取初诊时化疗前实验组与对照组儿童的骨髓2 mL, 肝素抗凝,标本采集后立即用Ficoll法分离骨髓单个核细胞,加Trizole充分裂解后,冻存于-80 ℃冰箱保存备用。
1.2.3 总RNA抽提、浓度测定及调整: Trizole法统一提取总RNA, 酶标仪测定RNA浓度并用DEPC水调整至4 ng/μL浓度,置于冰盒准备反转录。
1.2.4 miRNA反转录反应:按照美国ABI公司提供的TaqMan MicroRNA Reverse Transcription Kit说明书操作步骤,应用ABI 9700PCR反应仪反转录分别合成2种miRNA的cDNA。逆转录参数条件设置: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min, 4 ℃ forever, 共1个循环。
1.2.5 qRT-PCR分析:上述反转录产物先用管家基因ABL进行荧光定量PCR反应(设定标准曲线),以验证RNA抽提及反转录产品质量,ABL定量结果显示均在104拷贝数以上,提示标本及产品质量良好;然后进行miR-196b、miR-25, 和内参U6的茎环qRT-PCR检测。设置反应条件:50 ℃ 2 min灭活UNG酶, 95 ℃10 min预变性, 95 ℃ 15 s, 60 ℃ 60 s, 共40个循环。每个标本采用三复孔。
1.3 统计学分析
实验中每个标本设三个复孔,结果分析时,要求同一标本复孔Ct值相差≤0.5,内参U6的Ct值≤25, 否则弃去;扩增曲线结果分析设定手动Ct阈值为0.08; 以U6 snRNA为内参基因, miR-196b、miR-25的相对表达量以公式2-△△Ct表示(计算△△Ct时,对照组△Ct取其中位数)。得到的基因表达数据经统计学检验为非正态分布的定量资料,故采用SPSS 18.0软件进行非参数检验统计处理,两独立样本秩和检验用于两组独立样本之间差异的比较,多重独立样本之间的比较采用K个独立样本秩和检验,双变量相关分析用于比较两组定量资料之间的相关性。结果分别以秩均值或中位数表示,同时采用GraphPad Prism 5软件进行绘图。以P<0.05 判定为差异有统计学意义。
2 结 果
2.1 miRNA表达水平在AML患儿和对照组间的比较
在骨髓单个核细胞中,2种miRNA的表达水平见表1。miR-196b的相对表达量在患者和对照组间有显著差异(P=0.017),AML患儿的miR-196b表达水平高于对照组,差异具有统计学意义(P<0.05), miR-25似乎在患者组降低,但差异无统计学意义(P=0.245)。见图1。
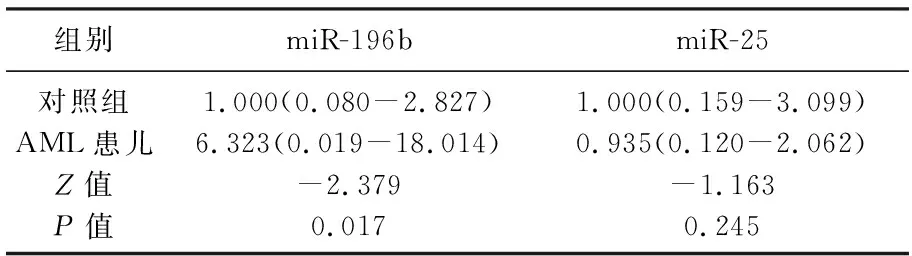
表1 AML患儿与对照组儿童两种miRNA的表达水平比较(中位数M)
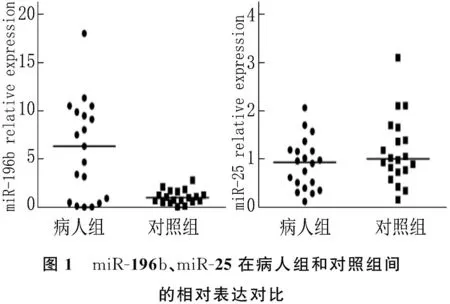
图1 miR-196b、miR-25在病人组和对照组间的相对表达对比
2.2 miRNA表达水平与临床资料之间的关系
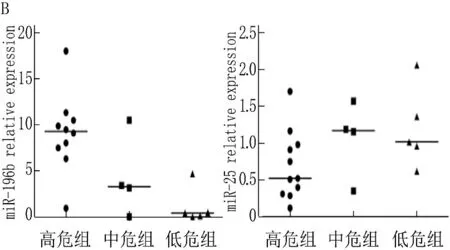
2.2.1 miRNA表达水平与危险度分组的关系: 在危险度分组的两两比较中, miR-196b在高危组、中危组和低危组之间的秩均值分别为13.40、8.25、4.60, 表达水平有显著差异(χ2=8.642,P=0.013), 高危组miR-196b表达水平最高,低危组最低。miR-25在不同危险度分组之间无显著差异(P=0.129)。见图2。
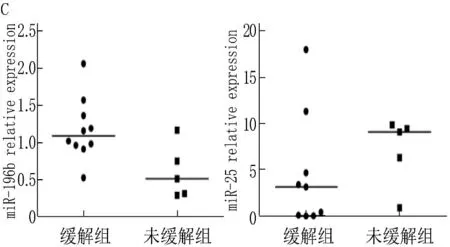
2.2.2 miRNA表达水平与治疗反应(一疗程是否缓解)的关系:以d26骨髓幼稚细胞比例<5%为一疗程缓解组,≥5%为一疗程未缓解组, miR-25表达水平的秩均值分别为9.80和4.40,两组间有显著差异(Z=-2.205,P=0.027),在一疗程缓解组miR-25的表达水平显著增高。而miR-196b的表达水平在2组间无显著差异(P=0.205)。
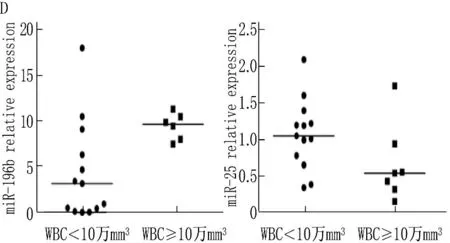
2.2.3 miRNA表达水平与初诊白细胞分组的关系:在WBC<10万/mm3和WBC≥10万/mm3两组间, miR-196b表达水平的秩均值分别为8.00和14.33, 2组间有显著差异(Z=-2.280,P=0.023), 在WBC≥10万/mm3组miR-196b的表达水平较高。而miR-25的表达水平在2组间无显著差异(P=0.101)。
2.2.4 miRNA表达水平与初诊LDH的关系以及初诊白细胞计数之间的关系: miR-25相对表达量与初诊LDH数值之间呈负相关(r=-0.511,P=0.021), 随着LDH水平的增高, miR-25表达水平降低,差异有统计学意义(P<0.05)。而在miR-196b的表达水平与初诊时LDH数值无显著相关(P>0.05); 血清LDH浓度与初诊白细胞计数呈正相关(Spearman相关系数r=0.0.851,P<0.001)。两个miRNA的表达水平与初诊白细胞计数无明显相关性(P>0.05)。
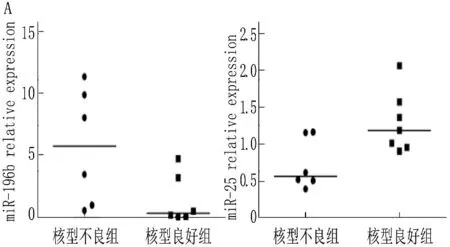
2.2.5 miRNA表达水平与细胞遗传学特点的关系:在染色体核型预后良好组和预后不良组间, miR-196b表达水平的秩均值分别为4.33和8.67, 具有显著差异(Z=-2.082,P=0.037), 提示预后不良组miR-196b表达水平增高;而miR-25表达水平的秩均值分别为9.14和4.50, 差异有统计学意义(Z=-2.143,P=0.032);在预后不良核型组呈低表达现象。
2.2.6 miRNA表达水平与AML患儿其他临床资料之间的关系:miR-196b、miR-25的表达水平在不同性别分组间无显著差异(P>0.05),与年龄、WBC计数、幼稚细胞、CRP、FAB分型等初诊时临床资料无明显相关性(P>0.05)。
3 讨 论
自1993年Lee等[6]首次发现miRNA以来,这种长度序列高度保守的小分子从此开启了生物学界研究的新领域。通过调控不同的下游靶基因[7], miRNA不仅参与白血病的形成,而且影响其治疗反应和预后。本研究中,作者利用qRT-PCR方法分析后发现,相对于对照组来说,初诊AML患儿的miR-196b具有明显高表达现象,而miR-25表达水平与对照组相比,差异无统计学意义。
miR-196b定位于HOX基因簇,在儿童ALL中与HOX基因表达量呈正相关性[8], 其功能主要是提高造血祖细胞的存活和增殖能力[9], 在MLL重排和NPM1突变阳性的儿童AML中,miR-196b表达增加[10]。高表达的miR-196b与成人AML不良预后相关[4]。本研究结果显示,在不同的危险度分组之间,miR-196b的表达水平具有显著差异,尤其在高危组和低危组之间差异明显(P=0.013), 与上述报道相符。在比较染色体核型不良组和核型良好组以及WBC<10万/mm3和WBC≥10万/mm3组之间的表达水平后发现,miR-196b在核型不良组和WBC≥10万/mm3组表达水平明显增高,差异具有统计学意义(P=0.037和0.023)。众所周知,细胞遗传学异常是一个经典的预后相关因素,而初诊时WBC≥10万/ mm3是评估AML患儿危险度的高危因素之一。由此可见,miR-196b是一种与危险度和预后密切相关的小分子RNA。至于miR-196b在儿童AML的生物学进程中是如何发挥作用的,作者尚不清楚。近期两个有关AML的体外研究已经证实了miR-196b的外源性高表达可以导致髓系分化部分受阻和髓系造血祖细胞增殖上调[11-12]。
迄今为止,关于miR-25的研究相对较少,现有的研究大多集中于实体瘤方面。例如在结直肠癌中,miR-25是一个特异敏感的预后标记物[13],而在胃癌患者的血浆中miR-25明显增高,是早期胃癌诊断的一种非侵入性标记物[14]。本研究中,与对照组相比, miR-25在AML患儿中未发现明显差异表达,但结合临床资料分析后发现,miR-25表达水平在诱导一疗程缓解组和未缓解组之间以及染色体核型良好组和不良组之间具有显著差异(P=0.027, 0.032)[15]。目前,AML患儿早期治疗反应备受重视,诱导一疗程缓解情况,已被公认能够预测病人的预后和转归,miR-25在一疗程缓解组和染色体核型良好组的高表达现象提示miR-25与AML患儿的预后相关[16],高表达miR-25的患儿对诱导治疗敏感,可能与良好预后相关;在对20例AML患儿的临床资料进行回顾性分析后,作者还发现,初诊血清LDH浓度与初诊白细胞计数呈正相关(r=0.851,P<0.001), 而初诊miR-25表达水平与初诊LDH呈负相关(r=0.511,P=0.021)[17]。众所周知,初诊时高白细胞的患儿预后较差,而LDH在一定程度上代表着体内肿瘤负荷,这也提示miR-25与预后的相关性,在儿童AML的生物学进程中,miR-25可能发挥着潜在的抑癌活性或协同抑癌作用,影响着治疗反应及预后,其机制有待于进一步的研究[18]。
总之,通过茎环qRT-PCR方法,我们初步研究了miR-196b、miR-25在儿童初诊AML中的表达及意义,证实了在儿童初诊AML中miR-196b的差异表达现象及其与预后的相关性,与成人AML的研究结果不尽相同,也许在儿童AML中miRNA有着不同的生物学特性,下一步作者将扩大样本量进一步深入研究。未来有必要在这些miRNAs参与儿童AML生物学进程的机制方面进行全方位的研究。不远的将来,这些表达失控的miRNAs不仅可能成为强有力的早期诊断和评估预后的生物学标记物,按照Garzon R等设想的思路[19],或许还将成为儿童AML治疗的新靶点新方向。
[1] Manola K N. Cytogenetics of pediatric acute myeloid leukemia[J]. Eur J Haematol, 2009, 83(5): 391.
[2] Harrison C J, H ills R K, Moorman A V, et al. Cytogenetics of Childhood Acute Myeloid Leukemia: United Kingdom Medical Research Council Treatment Trials AML 10 and 12[J]. J Clin Oncol, 2010, 28(16): 2674.
[3] Chen C Z. MicroRNAs as oncogenes and tumor suppressors[J]. N Engl J Med, 2005, 353(17): 1768.
[4] Wang Y, Li Z, He C, et al. MicroRNAs expression signatures are associated with lineage and survival in acute leukemias [J]. Blood Cells Mol Dis, 2010, 44(3): 191.
[5] 中华医学会儿科学分会血液学组, 《中华儿科杂志》编辑委员会. 儿童急性髓细胞白血病诊疗建议[J]. 中华儿科杂志, 2006, 44(11): 877.
[6] Lee R C, Feinbaum R L, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5): 843.
[7] Dong C, Ji M, Ji C. microRNAs and their potential target genes in leukemia pathogenesis[J]. Cancer Biol Ther, 2009, 8(3): 200.
[8] Schotte D, Lange-Turenhout E A, Stumpel D J, et al. Expression of miR-196b is not exclusively MLL-driven but is especially linked to activation of HOXA genes in pediatric acute lymphoblastic leukemia[J]. Haematologica, 2010, 95(10): 1675.
[9] Dixon-McIver A, East P, Mein C A, et al. Distinctive patterns of microRNA expression associated with karyotype in acute myeloid leukaemia[J]. PLoS ONE, 2008, 3(5): e2141.
[10] Danen-van Oorschot A.A, Kuipers J E, Arentsen-Peters S, et al. Differentially expressed miRNAs in cytogenetic and molecular subtypes of pediatric acute myeloid leukemia [J]. Pediatr Blood Cancer, 2012, 58(5): 715.
[11] Popovic R, Riesbeck L E, Velu C S, et al. Regulation of miR-196b by MLL and its overexpression by MLL fusions contributes to immortalization [J]. Blood, 2009, 113(14): 3314.
[12] Velu C S, Baktula A M, Grimes H L. Gfi1 regulates miR-21 and miR-196b to control myelopoiesis[J]. Blood, 2009, 113(19): 4720.
[13] Xiaojun L i, Chunyan Yang, Xiaoqiang Wang, et al. The expression of miR-25 is increased in colorectal cancer and is associated with patient prognosis[J]. Med Oncol, 2013, 30(1): 781.
[14] C Zhu, C Ren, J Han, et al. A five-microRNA panel in plasma was identified as potential biomarker for early detection of gastric cancer[J]. British Journal of Cancer, 2014, 110(9): 2291.
[15] 车琳,许云云,庞丽,等.核因子阳性儿童急性髓细胞性白血病临床特征及预后因素分析[J].中华实用儿科临床杂志,2014,29(3):207.
[16] 陈贵杰,钟东,唐文渊,等.急性髓细胞性白血病M2型(缓解期)合并小脑出血1例[J].第三军医大学学报,2013,35(16):1755.
[17] 宋军,朱红倩,郭鹏翔,等.胎盘多肽与rhG-CSF治疗急性髓细胞性白血病疗效观察[J].中华全科医学,2013,11(10):1569.
[18] 余杏,卢孝东,王永卿,等.急性白血病患者血清中LDH和HBDH水平检测的临床意义[J].吉林大学学报:医学版,2012,38(5):942.
[19] Garzon R, Marcucci G, Croce C M. Targeting microRNAs in cancer: rationale, strategies and challenges[J]. Nat Rev Drug Discov, 2010, 9(10): 775.

