胃癌组织高迁移率族蛋白A2与基质金属蛋白酶-9表达与肿瘤侵袭转移的关系及预后意义
吕柏楠 石晓明 吴胜春 唐雷 杨永宾
·论著·
胃癌组织高迁移率族蛋白A2与基质金属蛋白酶-9表达与肿瘤侵袭转移的关系及预后意义
吕柏楠 石晓明 吴胜春 唐雷 杨永宾
目的探讨胃癌组织中高迁移率族蛋白A2(HMGA2) 及基质金属蛋白酶-9(MMP-9)表达与肿瘤侵袭和转移能力的关系及预后意义。方法采用免疫组化法(SP法)检测93例胃癌组织、30例正常胃黏膜组织中HMGA2、MMP-9的表达;收集患者临床病历资料,并进行随访。结果HGMA2蛋白在胃癌组织中阳性表达率分别为明显高于正常胃黏膜(P<0.01);MMP-9蛋白在胃癌组织中阳性表达率明显高于正常胃黏膜(P<0.01)。HMGA2与MMP-9在胃癌组织中的蛋白阳性表达均与胃癌组织的肿瘤浸润深度、肿瘤分化程度、淋巴结转移、TNM分期有关(P<0.05);与患者的性别、年龄、肿瘤直径无关(P>0.05)。相关性分析发现,HMGA2与MMP-9在胃癌组织中的表达情况呈正相关(r=0.317,P<0.01)。经Kaplan-Meier生存分析显示,HMGA2、MMP-9蛋白表达阳性患者的生存率均低于表达阴性患者(P<0.01)。结论HMGA2、MMP-9与胃癌浸润和转移有关,两者表达具有相互协同作用,对胃癌的侵袭和转移起重要的促进作用。HMGA2、MMP-9是影响预后的危险因素,可能成为胃癌治疗的新靶点。
胃癌;高迁移率族蛋白A2;基质金属蛋白酶-9;侵袭,转移;预后
胃癌是最常见的消化系统恶性肿瘤之一,其具有较高的发病率及病死率,胃癌细胞的浸润和转移是影响胃癌患者预后的主要因素,并且是导致患者死亡的主要原因。研究发现,高迁移率族蛋白A2 (high mobility group protein A2,HMGA2)与肿瘤发生、浸润、转移有密切关系,并且随着肿瘤恶性程度和转移能力的增加,其肿瘤组织中的表达逐渐增加[1,2]。基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)是基质金属蛋白酶家族中主要成员之一,具有降解细胞外基质和基底膜的功能,从而破坏细胞膜的完整性,因此其与肿瘤的浸润、转移密切相关[3]。本文分析了HMGA 2 及MMP-9蛋白在胃癌组织中的表达与胃癌侵袭和转移的关系,分析其与临床病理参数和预后的关系,并检测了HMGA 2 及MMP-9的相关性,为胃癌的机制探讨和治疗提供依据。
1 材料与方法
1.1 标本来源 选择我院普外二科 2009至2012年手术切除并经病理确诊的93例胃癌患者,病理学分型均为腺癌,全部患者术前均未接受过化学治疗或放射治疗,其中男56例,女37例;年龄39~76岁,平均年龄(54±10)岁;T1~T2者33例,T3~T4者60例;高中分化腺癌53例,低未分化腺癌40例; 有淋巴结转移者55例,无淋巴结转移者38例。根据TNM分期标准进行临床分期结果如下:Ⅰ~Ⅱ期26例, Ⅲ~Ⅳ期67例。30例正常胃黏膜组织均取自十二指肠溃疡、胃溃疡患者胃组织周边正常胃黏膜组织,并排除重度不典型增生作为阴性对照。
1.2 主要试剂 兔/鼠抗人HMGA2、MMP-9多克隆抗体均购自美国SANTA CRUZ公司,SP免疫组化试剂盒、DAB显色试剂盒均购自北京中山生物公司。
1.3 实验方法 依免疫组化SP法染色试剂盒说明书进行操作。用已知阳性组织切片作为阳性对照以PBS液代替一抗为阴性对照。根据样本阳性细胞百分比和染色强度综合评分,10个随机高倍镜视野下无阳性细胞计0分,<25%计1分,25%~50%计2分,51%~75%计3分,>75%计4分。染色强度计分:未着色0分,淡黄色1分,棕黄色2分,棕褐色3分。根据样本阳性细胞百分比和染色强度计分之和的结果分为:0~3分为阴性或弱阳性,4分为阳性和强阳性。
1.4 统计学分析 应用SPSS 13.0统计软件,免疫组织化学各项指标间差别检验均应用χ2检验,组间相关性分析采用spearmann相关分析,生存资料的统计采用非参数统计的乘积-极限法(Kaplan-Meier),经Log-Rank检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 HMGA2与MMP-9蛋白在胃癌组织及正常胃组织中的表达 HMGA2蛋白阳性表达位于细胞胞浆内,为棕黄色颗粒。HMGA2蛋白在胃癌组织中阳性表达率为73.1%;在正常胃黏膜中阳性表达率为13.3%。胃癌组织中HMGA2蛋白阳性表达率明显高于正常胃组织,2组差异有统计学意义(P<0.01)。MMP-9蛋白阳性表达主要定位于细胞浆和细胞膜,为棕黄色颗粒。MMP-9蛋白在胃癌组织中阳性表达率为80.6%;在正常胃组织中阳性表达率为23.3%。胃癌组织中MMP-9蛋白阳性表达率明显高于正常胃黏膜,2组差异有统计学意义(P<0.01)。见表1。
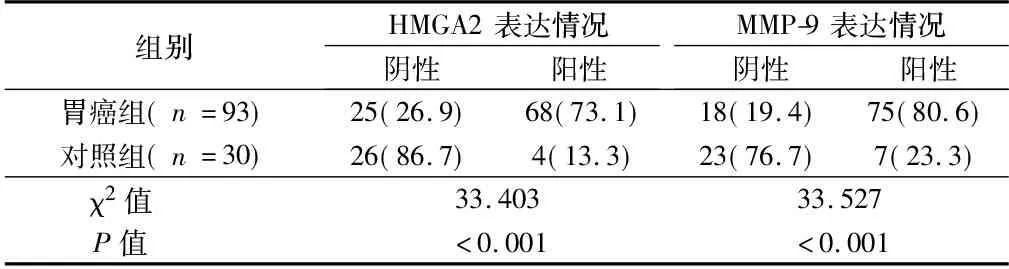
表1 HMGA2、MMP-9在胃癌及正常胃组织中的表达 例(%)
2.2 HMGA2与MMP-9蛋白表达与胃癌临床病理指标的关系 HMGA2与MMP-9在93例胃癌组织中的蛋白阳性表达率均与患者的性别、年龄、肿瘤直径无关(P>0.05),而均与胃癌组织的肿瘤浸润深度、肿瘤分化程度、淋巴结转移、TNM分期有关(P<0.05)。见表2、3。
2.3 HMGA2与MMP-9蛋白在胃癌组织中表达关系 在93例胃癌组织中,经Spearmann相关分析,HMGA2的蛋白表达与MMP-9的蛋白表达呈正相关(r=0.317,P<0.01)。
2.4 HMGA2与MMP-9蛋白表达与患者生存期关系的单因素分析 HMGA2在胃癌组织中阴性表达患者中位生存期为25个月,阳性表达患者仅为16个月, 表达阳性和阴性患者生存之间差异有统计学意义(P<0.01);MMP-9在胃癌组织中阴性表达患者中位生存期为24个月,阳性表达患者仅为18个月,表达阳性和阴性患者生存之间差异有统计学意义(P<0.01)。见图1。
3 讨论
胃癌是最常见的消化系统恶性肿瘤之一,发病率及病死率高,其侵袭和转移是影响胃癌患者预后的主要因素及死亡的重要原因。胃癌的侵袭和转移是多步骤,多因素参与的复杂过程,其主要因素与肿瘤细胞外基质降解,肿瘤细胞迁徙、黏附,肿瘤血管形成等诸多病理改变密切相关。高迁移率族蛋白(high mobility group proteins,HMGs)是一类染色质相关非组蛋白,HMG包括HMGA、HMGB和HMGN 3个家族,高迁移率族蛋白A2(HMGA2)其中重要的成员之一,其主要参与 DNA损伤修复、基因转录调控等,在胚胎时期常高表达与细胞生长、分化等过程相关,一般成体组织中基本低表达或不表达[4-6],研究发现,HMGA2在大肠癌、卵巢癌、甲状腺癌和非小细胞肺癌等肿瘤中都存在高表达[7,8]。运用 RNA干扰技术对肿瘤细胞HMGA2基因表达进行抑制,可以抑制肺癌等肿瘤的生长和转移[9],并且研究还发现,HMGA2在肿瘤血管生成的过程中起重要作用[10,11]。基质金属蛋白酶(MMPs)属于依赖锌离子的蛋白水解酶家族,包含20余种成员,参与炎性反应、组织重塑、细胞外基质降解、肿瘤侵袭与转移等生理病理过程[12,13],其中MMP-9是基质金属蛋白酶中分子量最大的酶,属于明胶酶,也称Ⅳ型胶原酶,可以使肿瘤细胞表面的细胞外基质中的Ⅳ型胶原降解,亦可使Ⅴ胶原和明胶降解。研究显示MMP9和在胃肠道癌、前列腺癌、乳腺癌等恶性肿瘤中过度表达,与其肿瘤细胞的浸润转移密切相关[14]。
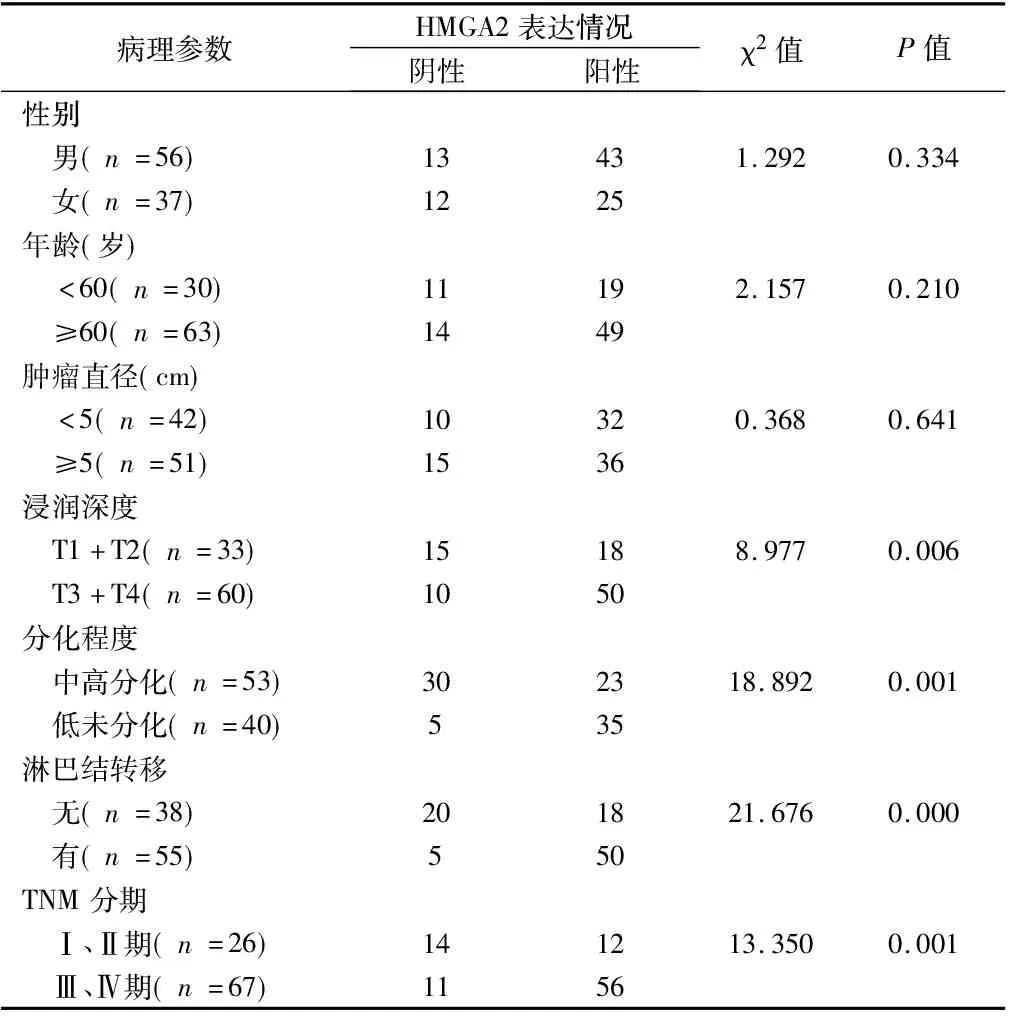
表2 HMGA2在胃癌中的表达及与病理因素的关系 例
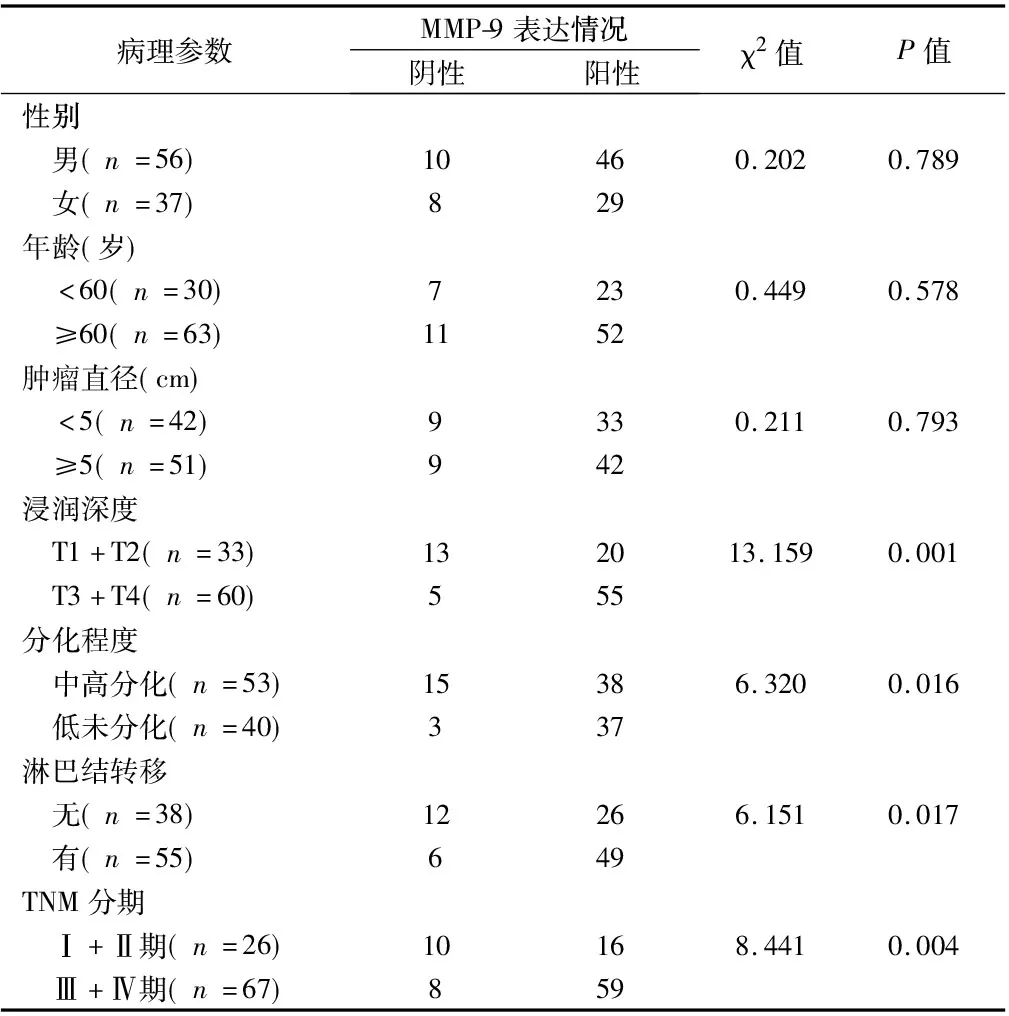
表3 MMP-9在胃癌中的表达及与病理因素的关系 例
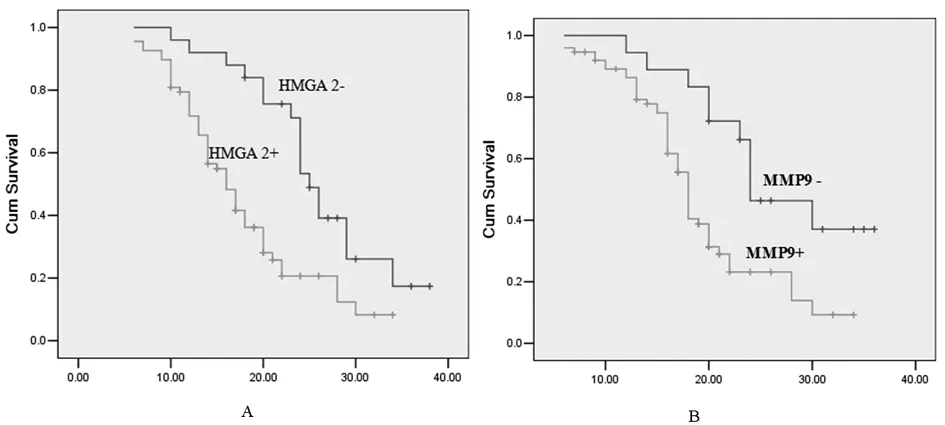
图1 HMGA2与MMP-9蛋白表达与胃癌预后的关系
本研究通过免疫组织化学结果显示,93例胃癌组织中HMGA2和MMP9蛋白的阳性表达率均明显高于胃正常组织,表明HMGA2和MMP9在胃癌组织中的过度表达可能与胃癌的发生、发展密切相关;通过胃癌组织中HMGA2和MMP9蛋白表达与临床病理特征之间的关系,随着肿瘤浸润深度和临床分期的增高,HMGA2和MMP9蛋白阳性表达率逐渐增加,胃癌患者有淋巴结转移中的阳性表达率明显高于无淋巴结转移者,随着肿瘤分化程度的降低HMGA2和MMP9蛋白阳性表达有逐渐升高的趋势,提示HMGA2和MMP9蛋白的高表达可能与胃癌发生侵袭及转移具有密切的相关性,组织类型分化差的胃癌细胞中HMGA2和MMP9蛋白含量越高,在局部浸润侵袭能力越强,更易向远处发生转移。通过相关性分析,胃癌组织中HMGA2的表达与MMP9的表达呈正相关(r=0.317,P<0.01),说明两者在胃癌的发生发展侵袭和转移中关系密切,存在相互协调、相互促进作用。经Kaplan-Meier生存分析结果显示,HMGA2、MMP-9蛋白表达阳性患者的生存率均低于表达阴性患者,表明二者可能是影响胃癌患者预后的因素,其在胃癌组织中高表达提示患者可能预后不良。
综上所述,HMGA2与MMP-9蛋白的高表达在胃癌的发生发展、侵袭和转移过程中其重要作用,二者可能在胃癌浸润、转移过程中起相互协调、促进作用,可能成为治疗胃癌的新靶点,抑制胃癌细胞生长及转移,提高胃癌患者的疗效及预后。
1 Wunderlich V,Bttger M.High mobility group proteins and cancer an emerging link.J Cancer Res Clin Oncol,1997,123:133-140.
2 Tallini G,Dal Cin P.HMGI(Y ) and HMGI-C dysregulation : a common occurrence in human tumors.Adv Anat Pathol,1999,6: 237-246.
3 Ra HJ,Parks WC.Control of matrix metalloproteinase catalytic activity.Matrix Biol,2007,26: 587-596.
4 Fusco A,Fedele M.Roles of HMGA proteins in cancer.Nat Rev Cancer,2007,7: 899-910.
5 Sgarra R,Zammitti S,Lo Sardo A,et al.HMGA molecular network: From transcriptional regulation to chromatin remodeling.Biochim Biophys Acta,2010,1799: 37-47.
6 Fedele M,Battista S,Kenyon L,et al.Over expression of the HMGA2 gene in transgenic mice leads to the onset of pituitary adenomas.Oncogene,2002,21: 3190-3198.
7 Fedele M,Palmieri D,Fusco A.HMGA2:Apituitary tumour subtype specific oncogene.Mol Cell Endocrinol,2010,326: 19-24.
8 杨国良,薄隽杰.高迁移率族蛋白A2与肿瘤.中国癌症杂志,2010,20: 156-160.
9 Park S,Minai Tehrani A,Xu CX,et al.Suppression of A549 lung cancer cell migration by precursor let-7 gmicroRNA.Mol Med Report,2010,3: 1007-1013.
10 Che N,Zhao XL,Sun T,et al.The role of Twist 1 in hepatocellular carcinoma angiogenesis:a clinical study.Hum Pathol,2011,42: 840-847.
11 吕颖慧,龚玉华,刁勇,等.高迁移率族蛋白A2 在肿瘤发生和血管形成中的双重作用.中国临床药理学与治疗学,2011,16: 975-980.
12 Peng B,Cao L,Ma X,et al.Meta analysis of association between matrix metalloproteinases 2,7 and 9 promoter polymorphisms and cancer risk.Mutagenesis,2010,25: 371-379.
13 Shim KN,Jung SA,Joo YH,et al.Clinical significance of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in gastric cancer.J Gastroenterol,2007,42: 120-128.
14 Turpeenniemi-Hujanen T.Gelatinases(MMP-2 and 9) and their natural inhibitors as prognostic indicators in solid cancers.Biochimie,2005,87:287-297.
Correlation between the expression of HMGA2,MMP-9 and invasion and metastasis of gastric cancer
LVBonan,SHIXiaoming,WUShengchun,etal.DepartmentofGeneralSurgery,HebeiProvincialPeople’sHospital,Shijiazhuang050051,China
ObjectiveTo investigate the expression of high mobility group protein A2 (HMGA 2),matrix metalloproteinase-9 (MMP-9) and their relationship with the invasion and metastasis of gastric cancer,and to explore their significance in patients’ prognosis.MethodsImmunohistochemistry was used to examine the expression of HMGA2,MMP-9 proteins in gastric carcinoma (n=93) and normal gastric mucosa tissue (n=30).Furthermore the clinical case history data were colleted and follow-up was carried out.ResultsThe positive expression rates of HMGA2 (73.1%) and MMP-9 expressions (80.6%) in gastric cancer tissues were significantly higher than those in normal gastric tissues (13.3% and 23.3%,respectively,P<0.01).The positive expressions of HMGA2 and MMP-9 in gastric cancer tissues were closely correlated to the infiltration degree,differentiation degree,lymphatic metastasis and TNM staging of gastric cancer (P<0.05),however,whcih were not correlated to patients’ sex,age and tumor’s diameter (P>0.05).The expression of HMGA2 was positively related with that of MMP-9 in gastric cancer tissue(r=0.317,P<0.01).The survival rates in patients with positive expression of HMGA2,MMP-9 were significantly lower than those in patients with negative expression (P<0.01).ConclusionHMGA2 and MMP-9 are correlated with infiltration and metastasis of gastric cancer,there is a synergistic reaction in the expression of two factors,which play an important role in promoting invasion and metastasis of gastric cancer.HMGA2 and MMP-9 are the risk factors of affecting prognosis,which may become new target in treatment of gastric cancer.
gastric cancer; high mobility group protein A2; matrix metalloproteinase-9; invasion,metastasis; prognosis
10.3969/j.issn.1002-7386.2014.06.005
050051 石家庄市,河北省人民医院普外二科
R 753.3
A
1002-7386(2014)06-0819-04
2013-10-17)

