参芎葡萄糖注射液联合依达拉奉对脑梗死患者血清HMGB1、ENA-78和S100β蛋白水平的影响
胡仁琳 李鸣 张弦
·论著·
参芎葡萄糖注射液联合依达拉奉对脑梗死患者血清HMGB1、ENA-78和S100β蛋白水平的影响
胡仁琳 李鸣 张弦
目的观察脑梗死患者血清高迁移率族蛋白-1(HMGB1)、中性粒细胞激活肽-78(ENA-78)和S100β水平的变化,并探讨参芎葡萄糖注射液联合依达拉奉对脑梗死的脑保护作用机制。方法采用随机、对照、单盲的前瞻性研究。将本院卒中单元中符合纳人标准的68例急性脑梗死患者按照随机数字法分为A组34例和B组34例,A组采用西医常规治疗方法加用参芎葡萄糖注射液200 ml静脉滴注,1次/d,B组在此基础上加用自由基清除剂依达拉奉治疗,2次/d,连续给药14 d。A组和B组均检测发病第1天(治疗前)、第3天、第7天、第14天血清HMGB1、ENA-78和S100β蛋白水平;治疗前、治疗后1周、2周和3周神经功能缺损评分采用斯堪的纳亚卒中量表(SSS)评分日常生活能力评分(ADL)和Barthel指数(BI)评定。结果发病后第1天,A组和B组患者血清HMGB1、ENA-78和S100β水平均达峰值,继之出现缓慢下降。在发病后第3天、第7天、第14天B组血清HMGB1、ENA-78和S100β含量均明显低于A组(P<0.01)。治疗后2周和3周,B组患者ADL、SSS评分均高于A组(P<0.01)。治疗前,脑梗死患者血清S-100β蛋白水平与SSS、ADL评分均呈负相关(r值分别为-0.590和-0.534,P<0.01),血清HMGB1水平与ENA-78水平呈正相关(r=0.883,P<0.01)。结论血清S-100β浓度可作为评估脑梗死后脑损伤严重程度的血清学指标,血清HMGB1和ENA-78可能参与了脑梗死后急性期炎性反应过程。依参芎葡萄糖注射液联合依达拉奉具有减轻脑梗死后继发炎性反应、保护脑细胞和提高患者神经功能的作用。
脑梗死;参芎葡萄糖注射液;依达拉奉;高迁移率族蛋白-1;中性粒细胞激活肽-78;S-100β蛋白
目前,脑血管病已成为我国城市和农村人口的第一位致残和死亡原因,且发病有逐年增多的趋势。流行病学研究表明,我国每年新发卒中病例150~200万例,校正年龄后的年脑卒中发病率为(116~219)/10万人口,年脑卒中病死率为(58~142)/10万人口[1]。目前现存脑血管病患者700余万人,其中约70%为脑梗死[1]。近年来研究表明,多种炎性介质及细胞因子参与了缺血、缺氧及再灌注的病理生理过程[2-4]。如何有效减轻神经功能缺损,如何有效减轻卒中后炎性反应已成为目前研究的热点和难题。在本研究中,我们将依达拉奉针剂和参芎葡萄糖注射液静滴相结合,采用前瞻性随机对照观察,探讨参芎葡萄糖注射液联合依达拉奉治疗脑梗死的疗效及血清炎性因子的影响。
1 资料与方法
1.1 一般资料 2011年6月至2013年3月期间我院神经内科的住院患者中,所有入组患者共68例,其中男38例,女30例;年龄60~84岁,平均年龄(71±5)岁,采用随机数字表法分为A组和B组,每组34例。2组患者一般资料具有可比性。正常对照组: 系同期我院健康体检者100例,各项体检均正常。其中男55例,女45例;平均年龄(55±14) 岁。所有研究对象用药均征得患者本人和家属同意,符合武汉市第五医院伦理委员会制定的伦理学标准,签署治疗同意书。
1.2 入选标准 经颅脑CT和(或)MRI确诊为前循环脑梗死,入院时行美国国立卫生院神经功能缺损(NIHSS)评分8~19分,均未行溶栓治疗,均符合缺血性卒中的诊断标准[5],且发病48 h之内,常规行颈部血管超声检查,参照中国缺血性卒中亚型(CISS分型)为大动脉粥样硬化型[6]。 排除标准:无症状性脑梗死,梗死后出血和脑出血,2型糖尿病、血液病、自身免疫疾病、甲状腺疾病、结核、恶性肿瘤、严重肝肾疾病,近2周严重感染,妊娠者。退出标准:(1)用药过程中出现严重不良反应;(2)出现心脑血管病复发事件;(3)患者突发意外病死。
1.3 方法
1.3.1 治疗方法:A组和B组患者均使用甘露醇、甘油果糖和速尿脱水、降颅内压、调控血压(施慧达)、抗血小板聚集(拜阿司匹林片)、调脂(阿托伐他汀钙片)和补液治疗,脱水剂使用一般不超过14 d;A组加用参芎葡萄糖注射液(由贵州益佰医药有限公司生产,200 ml静脉滴注,1次/d,连续滴注2周;B组在A组基础上加用依达拉奉注射液(其商品名为必存,每支10 mg针剂,南京先声药业生产)30 mg加入100 ml 0.9%氯化钠溶液,2次/d,疗程为14 d。A组使用等容积安慰剂0.9%氯化钠溶液。2组治疗期间均不再使用其他氧自由基清除剂及脑保护剂如尼莫地平等。
1.3.2 临床神经科评分:神经功能缺损评分采用1989年的美国国立卫生院卒中量表(NIHSS)、日常生活能力评分(ADL)标准采用Barthel指数(BI)和斯堪的纳维亚卒中量表(SSS)评定。均由卒中单元中经过培训的神经内科专职人员负责评分并录入。在患者入院治疗前、治疗后第1周、第2周和第3周分别评分1次。ADL和SSS评分越高,说明神经功能缺损程度越轻。
1.3.3 生化检测方法:正常对照组于体检日清晨抽取空腹静脉血3 ml。脑梗死患者入院后第1天(治疗前)、第3天、第7天和第14天晨起空腹,抽取静脉血5 ml,尽快分离血清,-70℃低温保存待测。检测前冻融,采用双抗体夹心ELISA法测定血清高迁移率族蛋白(HMGB1)、中性粒细胞激活肽-78(ENA-78)和S100β含量,试剂盒均由武汉博士德公司提供,仪器为意大利产AZXM11-Alisei全自动酶标仪。操作严格按说明书进行,结果由酶标分析仪分析所得。此外,A组和B组入院后第1天、第7天和第14天均抽血检测血常规、尿规及肝肾功能血脂心肌酶学等。
1.4 统计学分析 应用SPSS17.0统计软件,计量资料以表示,组间比较采用单因素方差分析、治疗前后指标比较采用配对t检验,计数资料比较采用χ2检验,相关性分析采用直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后2组患者血清HMGB1、ENA-78和S100β水平的比较 在发病后第1天,A组和B组患者血清HMGB1、ENA-78和S100β水平均明显升高(P<0.01),且达峰值,继之出现缓慢下降。在发病后第14天,A组和B组三项指标仍高于正常对照组(P<0.01),但在发病后第3天、第7天、第14天B组血清HMGB1、ENA-78和S100β含量均明显低于A组(P<0.01)。见表1~3。
表1 3组血清HMGB1比较

表1 3组血清HMGB1比较
注:与治疗前比较,*P<0.01;与正常对照组比较,#P<0.01;与A组比较,△P<0.05,☆P<0.01
表2 3组血清ENA-78比较

表2 3组血清ENA-78比较
注:与治疗前比较,*P<0.01;与正常对照组比较,#P<0.01;与A组比较,△P<0.05,☆P<0.01
表3 3组血清S100β比较

表3 3组血清S100β比较
注:与治疗前比较,*P<0.01;与正常对照组比较,#P<0.01;与A组比较,△P<0.05,☆P<0.01
2.2 治疗前后2组SSS和ADL评分的比较 治疗前,(A组和B奉组)患者SSS评分和ADL评分差异无统计学意义(P>0.05)。在治疗后第1周,2组患者SSS评分和ADL评分较入院时降低,但在治疗后第2周和第3周,A组和B组患者SSS评分和ADL评分逐渐上升。在治疗后第2周和第3周,B组患者SSS和ADL评分明显高于A组(P<0.01)。见表4~5。
表4 A组和B组SSS评分比较 n=34,分

表4 A组和B组SSS评分比较 n=34,分
注:与治疗前比较,*P<0.01;与A组比较,#P<0.01
表5 A组和B组ADL评分比较 n=34,分
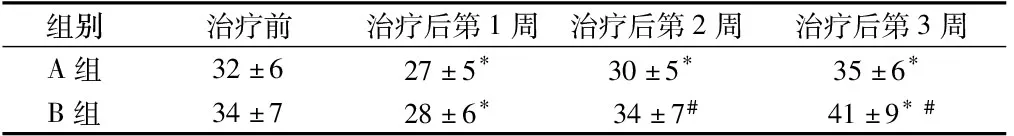
表5 A组和B组ADL评分比较 n=34,分
注:与治疗前比较,*P<0.01;与A组比较,#P<0.01
2.3 相关性分析 直线相关分析显示:治疗前,脑梗死患者(A组和B组)血清S-100β蛋白水平与SSS、ADL评分均呈负相关(r值分别为-0.590和0.534,P<0.01),血清HMGB1水平与ENA-78水平呈正相关(r=0.883,P<0.01)。
2.4 不良反应 所有患者治疗前后进行血、尿常规、肝肾功能、心电图检查,均未见明显的改变。有3例出现轻度胃肠道反应,恶心,无呕吐,可自行缓解。全部受试患者未见其他明显的不良反应。
3 讨论
随着社会经济的发展和人们日常生活水平的提高,脑梗死的发病率越来越高,其高致死率和高致残率给家庭和社会带来了巨大的负担。因此,如何采取有效的药物治疗,早期进行干预,减轻神经功能缺失程度,促进神经功能恢复显得尤为重要。药物治疗目的是尽快恢复脑缺血区的血流供应,最大程度上改善脑内微循环,有效地防治脑梗死进展加重。目前已有多项研究证实,多种炎性因子参与脑梗死后继发炎性反应过程。
S-100β蛋白是中枢神经系统的一种特异性酸性钙结合蛋白,主要由神经胶质细胞合成和分泌。在生理状态下,S100β蛋白以低浓度形式存在,它参与神经细胞的再生与修复,可促进神经生长,调节细胞内外能量代谢,并参与细胞内信号通路传导,具有神经营养作用;但在病理状态下,高浓度存在的S100β蛋白能够刺激神经胶质细胞产生大量致炎因子和一氧化氮,并通过一氧化氮依赖途径导致神经元功能障碍或神经元细胞程序性死亡,具有直接的神经毒性作用[7]。脑梗死后,神经胶质细胞大量坏死、部分细胞活化,S100β蛋白释放和合成增多,从而出现外周血或脑脊液中S100β蛋白浓度升高,而继之出现的脑水肿、血脑屏障破坏则进一步加重了神经组织损伤,最终诱导了细胞死亡或凋亡。在本研究中,治疗前,A组和B组患者血清S100β水平均明显高于正常对照组(P<0.05),且于发病第1天达高峰,继之出现缓慢下降。治疗前,脑梗死患者(A组和B组)血清S-100β蛋白水平与SSS、ADL评分均呈负相关(P<0.05),提示血清S-100β蛋白可作为判断急梗死神经功能缺损程度的有效血清学指标。
HMGB1是一种DNA结合蛋白,它广泛分布于多种组织器官细胞( 如淋巴组织、脑、肝、肺等) 的胞核和胞浆中,是判断某些细胞凋亡或坏死的一个关键信号,也是迄今为止所发现的惟一的能在细胞外诱导细胞因子分泌和活化炎性细胞的核内蛋白[8-10]。HMGB1作为一种重要的晚期炎性介质和致炎细胞因子[11],参与了组织损伤后修复及多种炎性疾病的病理生理过程[12,13],它作为启动和维持炎性瀑布式反应的中心分子,在致炎因子肿瘤坏死因子-α(TNF-α)或白介素-1(IL-1)等的刺激下,单核-巨噬细胞释放HMGB1,反过来HMGB1也可刺激单核-巨噬细胞分泌TNF-α、L-6,IL-8等炎性介质,这样就形成了一个正反馈环路[14]。此外,HMGB1还可以刺激中性粒细胞产生趋化现象,增加上皮细胞的通透性,从而加重局部渗出和水肿,它还可能参与炎症过程中免疫和内分泌反应的调节[15]。因而,HMGB1可作为损伤后炎性反应药物治疗作用的靶点[16]。
在本研究中,入院后第1天,A组和B组血清HMGB1水平均明显高于正常对照组(P<0.05),且达高峰,继之出现缓慢下降。分析其可能机制为脑梗死灶周边脑组织存在缺血和缺氧,导致细胞功能受损、坏死后,炎性细胞大量被激活,炎性介质释放入血,产生全身性的瀑布样炎性反应[17],继而诱发了星形胶质细胞或神经元细胞释放HMGB1,而后者可刺激星形胶质细胞或神经元细胞释放MMP-9、IL-1和TNF-α等多种炎性因子[18]。如此反复,形成一个正反馈环路,进而导致血清中HMGB-1可在短时间内迅速增加,随着炎性反应的逐渐减弱,血清HMGB-1水平缓慢下降。
ENA-78由78个氨基酸组成,同属于C-X-C亚族的趋化因子,在各种炎性介质如脂多糖(LPS)、IL-1、TNF-α等的诱导下均可表达,可由单核细胞、巨噬细胞、成纤维细胞、血管内皮细胞等合成和释放,但其主要来源为活化的巨噬细胞。ENA-78具有趋化和激活中性粒细胞作用,它既是炎性反应的重要介质,又是重要的血管增生因子。已有研究证实,ENA-78活性的增加与微血管通透性、炎性细胞侵入和水肿明显相关[19]。
在本研究中,发病后第1天,A组和B组血清ENA-78水平均明显高于正常对照组,且达高峰,继之出现缓慢下降。经直线相关分析提示,血清HMGB1水平与ENA-78水平呈显著正相关(P<0.05),分析其可能机制为脑梗死后周边脑组织缺血缺氧后导致细胞损伤、坏死,大量炎性细胞浸润,后者合成和释放ENA-78;与此同时,星形胶质细胞或神经元细胞释放HMGB1增加[20],HMGB1反过来刺激星形胶质细胞或神经元细胞释放多种炎性因子如TNF-α等,并可特征性的上调白细胞黏附分子(ICAM-1 和VCAM-1),分泌中性粒细胞和内皮细胞化学趋化素(IL-8和MCP-1)等,而TNF-α是关键的早期炎性介质,具有调节和放大炎性反应的作用[21],随着血清TNF-α水平的升高,炎性细胞浸润亦增加,炎性反应进一步增强。因而,ENA-78和HMGB1二者互为因果关系。本研究结果显示,血清ENA-78和HMGB1均可能参与了脑梗死急性期继发性炎性反应过程。
依达拉奉是一种相对分子质量小的自由基清除剂,具有亲脂基团,对血-脑屏障的通透率较高,静脉给药后可很容易地到达作用部位,清除脑内的毒性自由基,并且通过打断脂质过氧化反应链来抑制脑细胞(包括血管内皮细胞、神经元细胞、神经胶质细胞)膜的过氧化反应,保持了脑细胞膜结构和功能的完整性,从而有效地抑制了迟发性神经元死亡。参芎葡萄糖注射液是应用现代高科技生物学技术提取的中药丹参、川芎有效化学成分单体而成。其中丹参的有效成分为丹参素,具有抗凝血和抗血小板聚集及促进纤维蛋白(原)降解作用,亦具有扩张收缩状态的微小动脉,加快血液流速,消除血液瘀滞,改善微循环的作用。而川芎的有效成分为川芎嗪则具有抗氧化、抑制自由基的产生,减少神经元细胞凋亡的作用。在本研究中,治疗后第2周和第3周,B组患者SSS和ADL评分明显高于A组患者(P<0.05),提示参芎葡萄糖注射液联合依达拉奉治疗可更有效地改善脑卒中后神经功能障碍。而且,在发病后第3天、第7天和第14天,B组血清HMGB1、ENA-78和S100β含量均明显低A组(P<0.05),提示参芎葡萄糖注射液联合依达拉奉治疗可通过快速有效地降低脑梗死患者急性期血清HMGB1、ENA-78和S100β水平来减轻脑梗死后继发炎性反应。我们推测其可能作用机制为:参芎葡萄糖注射液联合依达拉奉治疗可能是通过清除自由基和抑制脂质过氧化,稳定神经元细胞膜,减少S-100β蛋白漏出,与此同时,由于脑细胞膜结构和功能的完整性得以保持,有效地抑制了迟发性神经元死亡,星形胶质细胞或神经元细胞释放HMGB1的含量降低,从而减轻了神经元死亡后继发的炎性反应,炎性反应介质如TNF-α等释放减少,从而减少了对ENA-78的诱导产生。当然,其具体作用机制十分复杂,后期研究中,我们将更深入一步进行探讨。
综上所述,在我们的研究中,血清S-100β浓度可作为评估脑梗死后脑损伤严重程度的血清学指标,血清HMGB1和ENA-78可能参与了脑梗死后继发炎性反应过程。参芎葡萄糖注射液联合依达拉奉治疗具有减轻脑梗死后炎性反应、保护脑细胞和提高患者神经功能的作用。由于脑梗死后继发炎性反应的病理生理机制相当复杂,因此在后期的研究中,我们将进一步推广和扩大样本量研究,并深入探讨参芎葡萄糖液联合依达拉奉对脑梗死的可能脑保护作用机制。
1 中华医学会神经病学分会脑血管病学组缺血性脑卒中二级预防指南撰写组.中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2010.中华神经科杂志,2010,43:154-159.
2 Guo MF,Yu JZ,Ma CG.Mechanisms related to neuron injury and death in cerebral hypoxic ischaemia.Folia Neuropathol,2011,49:78-87.
3 Wang Y,Huang J,Li Y,et al.Roles of chemokine CXCL12 and its receptors in ischemic stroke.Curr Drug Targets,2012,13:166-172.
4 Xia WJ,Huang YY,Chen YL,et al.Acute myocardial ischemia directly modulates the expression of brain natriuretic peptide at the transcriptional and translational levels via inflammatory cytokines.Eur J Pharmacol,2011,670:7-12.
5 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010.中华神经科杂志,2010,43:146-153.
6 Gao S,Wang YJ,Xu AD,et al.Chinese ischemic stroke subclassification.Front Neurol,2011,2:1-5.
7 Donato R,Cannon BR,Sorci G,et al.Functions of s100 proteins.Curr Mol Med,2013,13:24-57.
8 Harris HE,Andersson U,Pisetsky DS.HMGB1: a multifunctional alarmin driving autoimmune and inflammatory disease.Nat Rev Rheumatol,2012,8:195-202.
9 Huang W,Tang Y,Li L.HMGB1,a potent proinflammatory cytokine in sepsis.Cytokine,2010,51:119-126.
10 Huang W,Liu Y,Li L,et al.HMGB1 increases permeability of the endothelial cell monolayer via RAGE and Src family tyrosine kinase pathways.Inflammation,2012,35:350-362.
11 Hreggvidsdóttir HS,Lundberg AM,Aveberger AC,et al.High mobility group box protein 1 (HMGB1)-partner molecule complexes enhance cytokine production by signaling through the partner molecule receptor.Mol Med,2012,18:224-230.
12 Gao HM,Zhou H,Zhang F,et al.HMGB1 acts on microglia Mac1 to mediate chronic neuroinflammation that drives progressive neurodegeneration.J Neurosci,2011,31:1081-1092.
13 Hagiwara S,Iwasaka H,Shingu C,et al.The effect of experimental diabetes on high mobility group box 1 protein expression in endotoxin-induced acute lung injury.J Surg Res,2011,168:111-118.
14 Chen XL,Sun L,Guo F,et al.High-mobility group box-1 induces proinflammatory cytokines production of Kupffer cells through TLRs-dependent signaling pathway after burn injury.PLoS One,2012,7:1-9.
15 Hagiwara S,Iwasaka H,Hasegawa A,et al.Effects of hyperglycemia and insulin therapy on high mobility group box 1 in endotoxin-induced acute lung injury in a rat model.Crit Care Med,2008,36:2407-2413.
16 Zhu S,Li W,Ward MF,et al.High mobility group box 1 protein as a potential drug target for infection- and injury-elicited inflammation.Inflamm Allergy Drug Targets,2010,9:60-72.
17 El Gazzar M,Yoza BK,Chen X,et al.Chromatin-specific remodeling by HMGB1 and linker histone H1 silences proinflammatory genes during endotoxin tolerance.Mol Cell Biol,2009,29:1959-1971.
18 Qiu J,Nishimura M,Wang Y,et al.Early release of HMGB-1 from neurons after the onset of brain ischemia.J Cereb Blood Flow Metab,2008,28:927-938.
19 Antoniou KM,Tzanakis N,Tzortzaki EG,et al.Different angiogenic CXC chemokine levels in bronchoalveolar lavage fluid after interferon gamma-1b therapy in idiopathic pulmonary fibrosis patients.Pulm Pharmacol Ther,2008,21:840-844.
20 Murakami K,Koide M,Dumont TM,et al.Subarachnoid Hemorrhage Induces Gliosis and Increased Expression of the Pro-inflammatory Cytokine High Mobility Group Box 1 Protein.Transl Stroke Res,2011,2:72-79.
21 Hagiwara S,Iwasaka H,Togo K,et al.A neutrophil elastase inhibitor,sivelestat,reduces lung injury following endotoxin-induced shock in rats by inhibiting HMGB1.Inflammation,2008,31:227-234.
10.3969/j.issn.1002-7386.2014.06.008
430050 湖北省武汉市第五医院神经内科
R 743
A
1002-7386(2014)06-0828-04
2013-09-12)

