螺内酯对心肌梗死后心肌细胞凋亡和增殖的影响
徐占稳,李亚芹,王乾一,王至尊,赵兴洲
0 引言
广泛心肌梗死导致的充血性心力衰竭及心室重构(Ventricular remodeling),以心室扩大和心功能降低为特征。在缺氧、缺血再灌注等病理条件下,可以造成心肌细胞的凋亡。研究表明,急性心肌梗死后心肌细胞凋亡导致心肌细胞的持续性丢失,而且,细胞凋亡在心力衰竭的发生发展中起着重要作用。因此,改变细胞凋亡途径可以减少心肌的损伤。以往对醛固酮经典的认识是促进钠离子单向跨膜转运,进而调节血容量和血压。但近年来的临床和实验研究表明,心肌组织产生的醛固酮可能诱导了心肌细胞的凋亡,应用醛固酮拮抗剂如螺内酯、依普利酮,可以大大降低心力衰竭的发病率和死亡率[1-2]。
成年哺乳动物的心肌细胞具有增殖能力,心肌细胞增殖可作为心脏损伤后修复再生的基础[3-4]。最近研究证明,螺内酯可以抑制新生大鼠心肌细胞的增殖[5],而急性心肌梗死后螺内酯是否对心肌细胞增殖具有抑制作用尚未见相关报道。因此,本实验运用醛固酮拮抗剂螺内酯进行干预,探讨螺内酯对急性心肌梗死后心肌细胞凋亡和增殖的影响。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠45只,体质量250~ 300 g,河北大学医学部实验动物中心。SD大鼠随机分为3组:SHAM组、MI组和SPI组。模型制作:大鼠麻醉固定后,气管插管,连接小型动物呼吸机。于左侧第4肋间开胸,剪开心包暴露心脏,在左冠状动脉前降支起始段下2~3 mm处用5~0丝线结扎。以结扎线下方心肌色泽变暗,室壁活动减弱为梗死模型成功。假手术组仅穿线绕过前降支根部而不结扎。继续喂养到实验终点(第7天)[6]。建立SHAM组大鼠模型14只,MI组13只,SPI组13只,SPI组术后即给予螺内酯灌胃,100 mg/(kg·d)[2],SHAM组和MI组分别予等量生理盐水灌胃。处死大鼠前再次麻醉开胸,于左心室心尖部用5/0无损伤线做一直径约5 mm的荷包,中心部插入1.5 mm的带针芯监测管至左心室,拔出针芯后监测管接转换器于Maclab多功能生理仪,检测左心室舒张末期压(LVEDP)、收缩末期压(LVESP)、收缩期左心室最大收缩上升速率(+dp/dtmax)和舒张期左心室最大下降速率(-dp/dtmax),计算左心室压(LVDP),LVDP= LVESP-LVEDP。处死大鼠后,留取结扎线以下与房室沟平行的心肌组织,常规石蜡包埋,连续切片(4 μm厚),粘片,烘烤。
1.2 原位细胞死亡检测 罗氏凋亡检测试剂盒,采用TUNEL法标记凋亡细胞,DAB显色、苏木素复染、脱水、透明及封片观察。各标本在10×40倍光镜下随机采6~10个视野,应用计算机图像计数和分析,以心肌凋亡阳性细胞数占心肌细胞数的百分比作为心肌细胞凋亡阳性率。
1.3 PCNA免疫组化染色 PCNA试剂(sc-9707)购自北京中杉金桥,1·100;SP免疫组织化学方法染色检测,DAB显色、苏木素复染、脱水、透明及封片观察。在10×40倍光镜下采集标本图像,每一标本随机选取并采集6~10个视野,以细胞核染成棕褐色为PCNA表达阳性,进行计算机图像分析和计算阳性率。

2 结果
2.1 大鼠心肌梗死后病理组织学变化(HE染色) HE染色光镜下SHAM组心肌纤维排列整齐,横纹、闰盘及细胞核染色清晰;MI组可见心肌水肿,心肌纤维排列紊乱,部分心肌纤维断裂、溶解,胞浆染色不均匀,大量炎性细胞浸润,部分心肌呈灶状与片状坏死;SPI组可见心肌水肿,部分心肌纤维断裂,收缩带形成,较多炎性细胞浸润。
2.2 各组左心室功能比较 以LVDP及+dp/dtmax-dp/dtmax判断左心室功能。MI组心功能较SHAM组明显下降,SMI组较MI组显著改善。见表1。
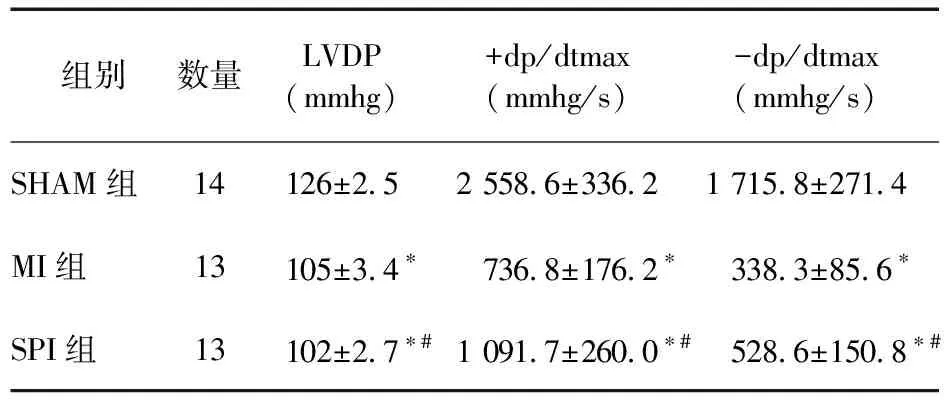
表1 各组LVDP和±dp/dtmax比较
2.3 TUNEL 凋亡阳性细胞核呈深棕色反应,胞浆不显色。SHAM组几乎无表达(图1A),MI组有大量表达(图1B),SPI组表达较少(图1C)。MI组表达明显高于SPI组(1.37%±0.08%vs 0.65%±0.05%,P<0.01,见表2),提示螺内酯干预心肌梗死大鼠能明显减少心肌细胞的凋亡。
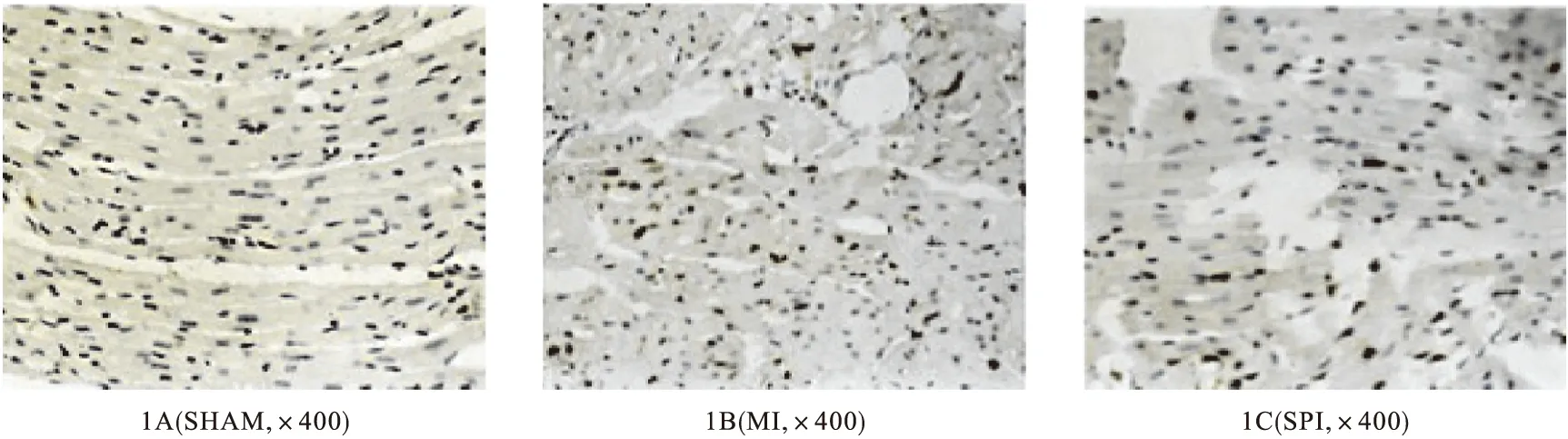
图1 TUNEL染色
2.4 PCNA PCNA显色定位于心肌细胞核,呈棕色,胞浆不显色。表达部位主要位于梗死周围区域。SHAM组几乎无表达(图2A),MI组(图2B)与SPI组(图2C)表达无明显差异(0.53%±0.04%vs 0.50%±0.04%,P>0.05,见表2)。

图2 PCNA免疫组化染色
表2各组凋亡指数、PCNA阳性率(%)

注:与SHAM组比较,*P<0.01;与MI组比较,#P<0.01
3 讨论
在临床中,醛固酮受体拮抗剂用于控制顽固性高血压和有症状的心力衰竭。在一项大规模、长期试验(RALES)中,使用小剂量醛固酮受体拮抗剂螺内酯(20 mg/d)治疗当前或近期有心功能Ⅳ级症状的心力衰竭患者可以降低死亡和住院的危险,因而奠定了醛固酮受体拮抗剂在慢性心力衰竭治疗中的地位。EPHESUS试验表明,在血管紧张素转换酶抑制剂和β受体阻滞剂治疗基础上,加用选择性醛固酮受体拮抗剂,能够使急性心肌梗死合并心力衰竭的患者进一步获益,猝死的危险性和总死亡率下降。醛固酮受体拮抗剂在临床中的获益使其在心力衰竭尤其是急性心肌梗死后的心力衰竭中的应用越来越受到重视。
目前研究表明,多种心脏疾病的心力衰竭演变过程中,心肌细胞、胶原网架和血管床发生了一系列形态结构的改变,即心室重构。其中心肌细胞凋亡起着重要作用,抑制凋亡可延缓心力衰竭的发展[7]。与心肌梗死相关的心肌细胞凋亡与很多因素有关,包括严重的缺血、细胞能量水平、机械应力以及神经内分泌的激活[8]。有研究发现,在人类急性心肌梗死(AMI)晚期的尸解中,心肌细胞凋亡仍然非常活跃,而且远离梗死区细胞凋亡指数(0.7%)远远低于梗死区(25.4%),表明细胞凋亡主要存在于梗死区及梗死边缘区。也有研究发现,早期MI患者远离梗死区凋亡细胞数量仍然可观。
心肌细胞凋亡与心室重构关系密切,抑制心肌细胞凋亡有利于改善心室功能。研究发现,急性心肌梗死后应用醛固酮拮抗剂螺内酯、依普利酮,可有效抑制左心室的扩张,降低室壁张力,改善心室重构,提高左室射血分数,减少舒张末期和收缩末期容量,从而减少心力衰竭患者的再住院率及住院时间[9-11]。其机制目前尚无统一认识,较早的研究认为,心力衰竭时肾素-血管紧张素系统激活,血管紧张素Ⅱ(ATⅡ)表达增加,促进心肌纤维化。而醛固酮有独立于ATⅡ和相加于ATⅡ的对心脏结构和功能的不良作用,醛固酮能够刺激成纤维细胞转变为胶原纤维,使胶原纤维增多,促进心肌间质纤维化,加重心室重构,从而促进心力衰竭的发展。心力衰竭患者短期应用血管紧张素转换酶抑制剂(ACEI),可降低血醛固酮水平,但长期应用,血醛固酮水平不能保持稳定,反而持续降低,即所谓“醛固酮逃逸现象”[12]。因此,心力衰竭患者在ACEI基础上加用醛固酮受体拮抗剂,能进一步抑制醛固酮的有害作用,可望有更大的益处。
近年来的研究表明,醛固酮受体拮抗剂能够抑制缺血心肌细胞凋亡,改善了心肌梗死后的心室重构,其可能存在盐皮质激素依赖途径和非依赖途径。Mitsuo等[6]研究发现,螺内酯通过抑制盐皮质激素受体和11β-羟类固醇脱氢酶2的表达,抑制心肌细胞凋亡进而改善心室重构。Thi等[12-13]发现螺内酯通过抑制抗凋亡蛋白ARC(Apoptosis repressor with caspase recruitment domain)的降解,调节细胞凋亡内源性途径的活性,促进凋亡诱导蛋白Acinus和ICAD(Inhibitor of caspase-activated DNase)的降解。本研究发现,心肌细胞凋亡主要出现于中心坏死区域和存活心肌之间的低灌注区。MI组心肌细胞凋亡率明显高于SPI组(1.37%±0.10%vs 0.65%± 0.06%,P<0.01),MI组LVDP、+dp/dtmax和-dp/dtmax明显低于SHAM组与SPI组,显示螺内酯抑制了心肌细胞凋亡,改善了心肌梗死后的心功能。细胞凋亡的多少决定缺血损伤的轻重,提示我们可以从细胞凋亡的角度对缺血后心功能的恢复及心肌保护进行研究。
以往认为哺乳动物成熟的心肌细胞属于终末分化细胞,因而成年心脏被看成终末分化器官,不存在心肌细胞增殖。然而近年来,一系列实验结果验证了在正常的或者由于缺血或非缺血而引起的急性或慢性心力衰竭的心脏中发现了固有心肌细胞的有丝分裂,证实存在心肌细胞增殖。心肌细胞增殖可作为心脏损伤后修复再生的基础[4-5,14-15]。为了明确增殖心肌细胞的类型,很多实验研究了心脏混合物分离过程中的心肌细胞特异性标记物和非心肌细胞的特异性标记物,以及增殖细胞的生物学标记,其中PCNA就是心肌细胞增殖的标记蛋白之一[16]。最近研究证明,螺内酯通过抑制心肌细胞增殖阻碍了新生大鼠心脏的发育,其机制可能是通过调节细胞分裂素活化蛋白激酶家族成员P38及P53的表达[5]。而急性心肌梗死后醛固酮拮抗剂是否对心肌细胞增殖具有抑制作用尚未见相关报道。我们应用PCNA定量心肌细胞增殖程度,结果表明,PCNA在SMI组和MI组之间表达无明显差异。
因此,本实验应用组织学方法初步验证了螺内酯对于心肌梗死后心功能的保护主要是通过抑制心肌细胞凋亡而非心肌细胞的增殖,进一步阐释了螺内酯对于心肌梗死后心室重构的影响,这对于螺内酯在改善心肌梗死后心室重构和心力衰竭的应用中又奠定了一定的理论基础。
参考文献:
[1] Dermot PP,Thavendiranathan PC,Thomas HM.Aldosterone antagonists improve ejection fraction and functional capacity independently of functional class:a meta-analysis of randomised controlled trials[J].Heart,2012,98:1693-1700.
[2] Sanjiv JS,John FH,Nancy KS,et al.Baseline characteristics of patients in the treatment of preserved cardiac function heart failure with an aldosterone antagonist trial[J].Circulation,Heart Failure,2013,6:184-192.
[3] Sandra Erbs,Robert Höllriegel,Axel Linke,et al.Exercise training in patients with advanced chronic heart failure(NYHA IIIb)promotes restoration of peripheral vasomotor function,induction of endogenous regeneration,and improvement of left ventricular function[J].Circ Heart Fail,2010,3:486-494.
[4] Bergmann O,Bhardwaj RD,Bernard S,et al.Evidence for cardiomyocyte renewal in humans[J].Science,2009,324(5923):98-102.
[5] Hyung JS,Kee HY,Gi YJ,et al.Aldosterone modulates cell proliferation and apoptosis in the neonatal rat heart[J].J Korean Med Sci,2010,25:1296-1304.
[6] Takeda M,Tatsumi T,Matsunaga S,et al.Spironolactone modulates expressions of cardiac mineralocorticoid receptor and 11β-hydroxysteroid dehydrogenase 2 and prevents ventricular remodeling in post-infarct rat[J].Hearts Hypertension Research,2007,30(5):427-437.
[7] Mani K.Programmed cell death in cardiac myocytes:strategies to maximize post-ischemic salvage[J].Heart Fail Rev,2008,13:193-209.
[8] Cynthia NP,Sangyoon Han,Stacey DC,et al.Oxidative-stress mediates apoptosis in a human model of danon disease and heart failure[J].Circ Res,2013,113:A025.
[9] Ivanes F,Susen S,Mouquet F,et al.Aldosterone,mortality,and acute ischaemic events in coronary artery disease patients outside the setting of acute myocardial infarction or heart failure[J].Eur Heart J,2012,33(2):191-202.
[10]Mihailidou AS.Aldosterone in heart disease[J].Curr Hypertens Rep,2012,14(2):125-129.
[11]Bradley AM,Jane AL.Aldosterone receptor antagonists:effective but often forgotten[J].Circulation,2010,121:934-939.
[12]Thi Yen,Loan Le,Mahidi Mardini,et al.Low-dose spironolactone prevents apoptosis repressor with caspase recruitment domain degradation during myocardial infarction[J].Hypertension,2012,59:1164-1169.
[13]Zannad F,Ketelslegers JM,Bramlage P.Role of biomarkers in guiding treatment with aldosterone-blocking agents[J].Eur Heart J,2011,13(S):B31-B35.
[14]Malliaras K,Zhang YQ,Seinfeld J,et al.Cardiomyocyte proliferation and progenitor cell recruitment underlie therapeutic regeneration after myocardial infarction in the adult mouse heart[J].Embo Mol Med,2013,5:191-209.
[15]Den Haan MC,Grauss RW,Simits AM,et al.Attenuation of ventricular remodeling and improvement of left ventricular systolic function by injection of human fetal cardiomyocyte progenitor cells after acute myocardial infarction[J].Circulation,2009,120:S1040.
[16]Matturri L,Ottaviani G,Lavezzi AM,et al.Expression of apoptosis and proliferating cell nuclear antigen(PCNA)in the cardiac conduction system of crib death(SIDS)[J].Adv Clin Path,2001,5(3):79-86.

