黄酮类化合物F01WB1695B对肝细胞脂肪变性的抑制作用及分子机制研究*
朱京童, 郑智慧, 任 晓, 路新华, 段宝玲, 孟雅娟
(华北制药集团新药研究开发有限责任公司,微生物药物国家工程中心,河北省工业微生物代谢工程技术研究中心,石家庄 050015)
非酒精性脂肪肝病(non-alcoholic fatty liver di-sease, NAFLD)是一种无过量饮酒史、以肝实质细胞脂肪变性和甘油三酯(triglyceride, TG)在肝细胞中的堆积为特征的临床病理综合征[1]。它与肥胖、胰岛素抵抗、高血压和高甘油三酯血症等多种代谢疾病紧密联系在一起,构成代谢综合症[2],是肝硬化和肝癌的重要病因,严重威胁着人类健康。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors, PPARs)属于核激素受体超家族的一员,是影响脂肪细胞分化和脂质代谢的主要核内转录受体。包括PPARα、PPARβ/δ和PPARγ 3个亚型[3],PPARα和PPARγ的受体激动剂已有药物在临床上应用于高血脂和糖尿病的治疗。
黄酮类化合物已被研究证实具有抗氧化、降血脂、清除自由基、保肝抗炎和抗癌等多种生物活性[4],有关黄酮类化合物的脂肪肝预防和治疗的疗效及分子作用机制报道较少,本研究通过油酸诱导建立肝细胞脂肪变性模型,初步研究了黄酮类化合物F01WB1695B对L-02肝细胞脂肪化的抑制作用和分子作用机制。
材 料 和 方 法
1 材料
1.1细胞株和质粒 L-02肝细胞株购自中国医学科学院;中国仓鼠卵巢细胞CHO-K1购自上海细胞生物学研究所;pGL3-GAL4、pGAL4-PPARα(LBD)、pGAL4-PPARγ(LBD)、3× PPRE-Luc、 pTarget-PPARα 和pTarget-PPARγ质粒均由本实验室构建[5-6]。
1.2主要试剂和仪器 RPMI-1640培养基、青霉素和链霉素由华北制药集团提供;新生牛血清和胎牛血清购自杭州四季青公司;油酸为国产分析纯;油红O及噻唑蓝(MTT) 购自Sigma;Trizol RNA 提取试剂盒、SuperscriptTMReverse Transcription和Lipofectamine 2000 Reagent购自Invitrogen;甘油三酯和总胆固醇检测试剂盒购自南京建成生物工程研究所;CO2培养箱为美国科峻仪器公司产品;Victor21420多标计数仪购自 PE;倒置荧光显微镜购自Leica;荧光定量PCR仪MX3000P购自安捷伦公司。
1.3化合物的来源和配制 F01WB1695B由华北制药集团新药研究开发有限责任公司提供,名称为5,7,3’,4’-tetrahydroxy-8-methoxyisoflavone。用DMSO溶解配制成2 g/L浓度,后3倍梯度稀释成0.9~2 000 mg/L共8个浓度组,-20 ℃保存备用。其结构式见图1。
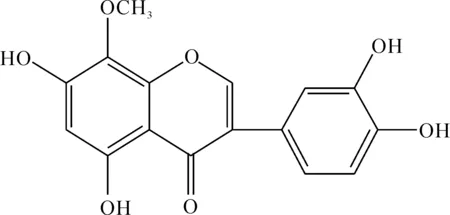
Figure 1. Chemical structure of F01WB1695B.
2 方法
2.1肝细胞培养 正常人胚肝细胞株L-02,用含10%新生牛血清、100 mg/L链霉素和1×105U/L 青霉素的RPMI-1640培养基培养,培养条件为37 ℃、5% CO2培养箱,细胞培养48 h,待细胞贴壁生长至汇合率约80%~90%,用胰蛋白酶消化收集细胞并传代。
2.2油酸浓度的确定 取对数生长期L-02细胞,以1×109/L接种于96孔板中。诱导组分别加入终浓度10、20、40和80 mg/L的油酸(DMSO溶解);对照组为细胞悬液;空白组用相应培养基代替。在37 ℃、5% CO2培养箱中培养48 h后,MTT比色法染色,在波长570 nm/630 nm下读取A值。选择对细胞活性影响小的浓度作为诱导细胞脂肪化的最佳浓度。
2.3F01WB1695B的细胞毒实验 将L-02细胞接种于96孔板(200 μL/well),37 ℃培养24 h,加入终浓度0.009、0.027、0.08、0.25、0.74、2.22、6.67和20 mg/L 8个不同浓度的F01WB1695B作用于L-02细胞24 h后,MTT法染色,在波长570 nm/630 nm下读取A值。选择对细胞毒性小的浓度作为诱导肝细胞脂肪化的最佳浓度。
2.4肝细胞脂肪变性模型的建立 将处于对数生长期的L-02细胞以1×109/L接种于96孔培养板中,20 mg/L油酸诱导肝细胞脂肪化,在37 ℃、5% CO2培养箱中培养48 h后,吸弃培养孔中的培养基,用PBS洗涤3遍,10%多聚甲醛固定细胞30 min,60%异丙醇洗涤3遍,油红O染液避光染色20 min,60%异丙醇洗涤2遍,蒸馏水洗涤3遍,将培养板放置于倒置荧光显微镜下, 普通光拍照。
2.5细胞内甘油三酯和总胆固醇含量测定 用2 mg/L和0.2 mg/L的F01WB1695B对经20 mg/L油酸诱导后发生脂肪化的L-02细胞处理24 h后,收集细胞。用冷PBS 1 000 r/min离心10 min,清洗细胞2次,收集细胞沉淀。用Triton X-100细胞裂解液裂解细胞30~40 min,按照试剂盒说明书检测细胞内甘油三酯和总胆固醇的含量[ 7]。
2.6瞬时转染和报告基因检测 具体方法参考文献[6]进行,将待转染细胞株以3×104cells/well 接种入96孔板中,37 ℃培养24 h,将培养液换成含10%胎牛血清的无双抗RPMI-1640培养液,用脂质体2000转染试剂将0.3 μg/well 报告质粒PPRE-Luc与0.1 μg/wellPPARα或PPARγ表达质粒pTarget-PPARα/γ共转染入细胞。37 ℃培养6 h,加入待测样品,DMSO 作为空白对照。24 h后裂解细胞,利用 Victor2多标计数仪检测相对发光数,计算萤光素酶的活性。药物对核受体激动活性用萤光素酶的表达诱导倍增数表示,为加药组萤光素酶的活性与空白对照(DMSO)组的比值。半数有效浓度 EC50为最大效应一半时的药物浓度。
2.7Real-time PCR检测脂代谢相关基因的表达 当L-02细胞在6孔板中密度达到 90% 时,加入F01WB1695B处理 24 h后,用Trizol法提取细胞总RNA,并反转录成cDNA。以GAPDH 为内参照,对SCD1、ACOX1和FASN的表达进行实时定量PCR分析。 根据 real-time PCR引物设计原则,用 Primer Premier 5.0 软件设计引物,所有引物见表 1。Real-time PCR 反应条件:(1)预变性:95 ℃ 1 min;(2)两步法 PCR反应:变性95 ℃ 5 s;退火延伸60 ℃ 34 s;共40 个循环。

表1 Real-time PCR的引物序列
3 统计学处理
实验数据均以均数±标准差(mean±SD)表示。组间均数比较采用方差分析,以P<0.05为差异有统计学意义。
结 果
1 油酸诱导浓度的确定
MTT法结果显示当油酸浓度在40 mg/L及以下时,油酸组和加等量DMSO对照组相比,差异无统计学意义,见表2。这说明油酸在40 mg/L及以下时对L-02细胞增殖活力无影响,本研究选用20 mg/L的油酸进行脂质诱导实验。

表2 MTT实验测定油酸对肝细胞生长的影响
2 F01WB1695B的浓度确定
MTT法结果显示,当F01WB1695B的浓度在20 mg/L及以下时,各浓度组F01WB1695B和加等量DMSO对照组相比,差异没有统计学意义,见图2。这说明F01WB1695B在20 mg/L及以下对L-02细胞增殖活力无影响,没有显示出明显的细胞毒作用。

Figure 2. The cytotoxic effect of F01WB1695B on L-02 hepatocytes. Mean±SD. n=3.
3 油红O染色法检测F01WB1695B对肝细胞脂肪化的抑制效应
为了考察F01WB1695B对肝细胞脂肪化的抑制作用,本实验采用油红O染色法测定终浓度0.009~20 mg/L 的F01WB1695B对L-02细胞的抑制作用。图3结果显示,正常对照组的细胞边缘清晰,细胞间结合紧密,胞内可见极少量橘红色脂滴;模型组的细胞轮廓模糊, 胞内可见大量橘红色脂滴,在胞膜内呈环状分布,并出现脂滴融合现象。在F01WB1695B为2 mg/L以上时能明显抑制细胞内脂质的形成,细胞内可见极少量橘红色脂滴;在F01WB1695B为0.2 mg/L以下时细胞边缘模糊,可见大量橘红色脂滴且呈环状分布,但较模型组少。
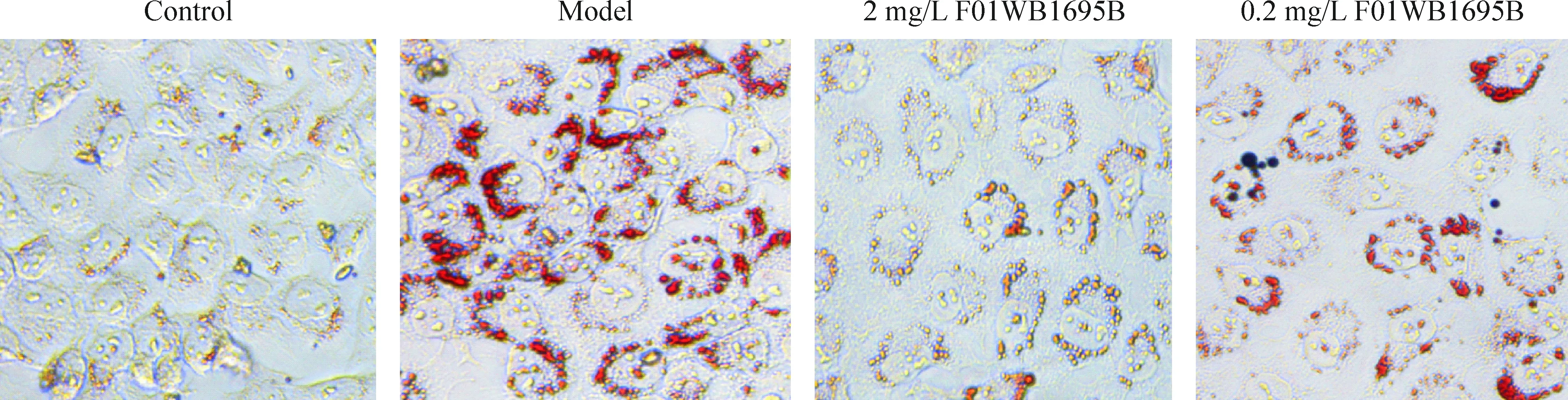
Figure 3. The inhibitory effect of F01WB1695B on the lipid droplet accumulation in the steatotic hepatocytes (×200).
4 F01WB1695B对脂肪化肝细胞内TG和TC的含量影响的定量分析
为了研究F01WB1695B对脂肪化肝细胞内TG和TC含量的影响,本实验将F01WB1695B作用于L-02细胞24 h后,收集细胞和上清,进一步测定了细胞内TG和TC含量。与正常组比较,模型组中TG含量明显增高(P<0.01);与模型组比较,F01WB1695B干预24 h后,在0.2 mg/L及以上时各组TG含量明显降低,差异显著(P<0.05)。与正常组比较,模型组中TC含量明显增高(P<0.01);与模型组比较,F01WB1695B干预24 h后,在0.2 mg/L及以上时各组TC含量明显降低,差异显著(P<0.05), 见图4。

Figure 4. Effects of F01WB1695B on lipogenesis in human hepatic cell line L-02.Mean±SD. n=3. **P<0.01 vs control; #P<0.05 vs model.
5 F01WB1695B对核受体PPAR的转录激动活性
5.1F01WB1695B对PPAR嵌合表达报告基因的转录诱导活性 将 pGL3-GAL4 报告质粒分别与 pGAL4-PPARα(LBD)或pGAL4-PPARγ(LBD)表达质粒共转染CHO-K1细胞6 h,加入0.01~10 mg/L浓度的F01WB1695B继续培养24 h后,进行报告基因萤光素酶活性的检测。结果如图5中可以看出F01WB1695B能诱导 PPARα和PPARγ调控的萤光素酶的表达且呈剂量依赖关系,其EC50分别为1.21 mg/L 和0.51 mg/L。
5.2F01WB1695B对PPRE-Luc 报告基因的转录诱导活性 为了证实F01WB1695B对 PPAR的转录激动活性,进一步利用3×PPRE-Luc报告基因方法检测F01WB1695B对PPAR 转录激动活性。将报告质粒3×PPRE-Luc和 PPARα或PPARγ全长的表达质粒pTarget-PPARα或pTarget-PPARγ共转染 CHO-K1细胞。结果如图5所示,F01WB1695B能诱导报告基因萤光素酶的表达且呈剂量依赖关系,其EC50分别为2.1和1.58 mg/L。此结果和嵌合表达受体报告基因方法的结果基本一致,进一步证实了F01WB1695B对PPAR的转录激动作用。

Figure 5. Transactivities of F01WB1695B on PPARα and PPARγ.A, B: chimeric receptor assay; C, D: PPRE-luc reporter assay. Mean±SD. n=3.
6 F01WB1695B对脂代谢相关基因表达影响
为了阐明F01WB1695B对肝细胞脂肪化抑制作用的的分子作用机制,本研究利用real-time PCR进一步检测了PPAR下游调控的与脂肪代谢密切相关基因的表达变化[8],SCD1和FASN是两个脂肪合成关键基因[9-10],ACOX1是脂肪分解代谢的关键基因[10]。用20 mg/L浓度的F01WB1695B处理L-02细胞24 h后,提取细胞总RNA,并反转录成cDNA。对SCD1、ACOX1和FASN mRNA的表达进行实时定量PCR分析。和正常对照组比,模型组细胞中SCD1和FASN mRNA水平的表达量被分别上调,ACOX1在 mRNA 水平的表达量下降;和模型组相比,F01WB1695B 细胞组中SCD1和FASN在mRNA 水平的表达量被分别下调,ACOX1在 mRNA 水平的表达量被上调,见图6。
讨 论
NAFLD是一种与遗传-环境-代谢-应激相关的肝脏疾病,其发病与肥胖、糖尿病、营养不良、药物中毒、感染和缺氧等因素有关。NAFLD的发病机制至今仍未完全阐明, 目前被广泛接受的观点是Day和James提出的二次打击学说。第一次打击指各种原因如肥胖、胰岛素抵抗造成肝脏摄入过多游离脂肪酸(free fatty acid, FFA)引起脂肪变性。第二次打击主要为氧化应激损伤、脂质过氧化损伤及其异常细胞因子的作用导致的脂肪性肝炎[11]。根据游离脂肪酸增多是NAFLD发病机制之一的学说,本研究中采用油酸诱导L-02细胞48 h发生脂肪化,通过油红O染色以及光镜观察证实细胞膜内有大量脂滴存在,模型组较对照组显著增高,证明通过油酸诱导能够建立肝细胞脂肪变性模型。经测定证明经油酸诱导L-02细胞后,能够增加细胞内TG和TC含量。加入F01WB1695B后可以减少油酸刺激的肝细胞内TG和TC的堆积。

Figure 6. The relative mRNA levels of SCD1, ACOX1 and FASN in L-02 cells responsed to F01WB1695B. Mean±SD. n= 3.*P<0.05,**P<0.01 vs control; ##P<0.01 vs model.
PPARs是一类由配体激活的核转录因子,在调控脂肪细胞分化与脂质代谢过程中发挥重要作用。其中PPARα对人体内脂质的调节结果为降低极低密度脂蛋白甘油三酯水平,上调参与促进胆固醇流出和胆固醇逆向转运的转运蛋白,增强脂肪酸的摄取氧化和抗炎,维持人体的动态平衡[12],减少非酒精性脂肪肝的发生。PPARγ参与调控脂类代谢相关基因的表达,它被激活后, 能够增量调节脂类代谢靶基因的表达, 降低血脂水平[13]。参与脂肪酸β氧化的基因启动子中都含有PPARα的顺式作用元件,都是受PPARα调节的靶基因。SCD1作为调节脂肪酸代谢的重要限速酶[14],在脂肪酸合成代谢中起着重要的调节作用[15]。SCD1-/-小鼠控制脂肪酸氧化基因上调的关键事件发生在PPARα蛋白活性调控环节,ACOX1是PPARα的目标基因之一,是脂肪酸在过氧化物酶体中进行β-氧化的限速酶,参与各类脂肪酸β-氧化的第一步反应,可促进脂肪酸在过氧化物酶体中的氧化[10]。FASN是脂肪酸合成过程中的转录调控关键酶,催化乙酰辅酶A和丙二酸单酰辅酶A合成长链脂肪酸。研究表明,PPARα 诱导小脂肪细胞的形成,调控乙酰辅酶A合成酶和FASN等多个酶的表达[16]。
本研究中多个报告基因检测方法证明F01WB1695B能有效激活PPAR的转录功能,是PPAR的激动剂。进一步的荧光定量PCR结果证明F01WB1695B能够抑制SCD1和FASN 信号通路的激活,使肝细胞内甘油三酯合成减少,减少细胞内脂质的蓄积。同时F01WB1695B上调ACOX1 mRNA的表达,促进了脂肪酸的分解代谢,进而降低肝细胞内甘油三酯水平。总之,本研究的结果证实了黄酮类化合物F01WB1695B对脂肪化肝细胞具有有效的抑制作用,推测该作用可能是由于F01WB1695B作为 PPAR 的激动剂,通过激活核受体PPAR的转录调控途径,从而诱导多个脂类代谢相关靶基因的表达,进而降低脂肪变性肝细胞内TG和TC的水平,发挥抗非酒精性脂肪肝病的作用。
[参 考 文 献]
[1] Cheung O, Sanyal AJ. Abnormalities of lipid metabolism in nonalcoholic fatty liver disease[J]. Semin Liver Dis, 2008, 28(4): 351-359.
[2] Krawczyk M, Bonfrate L, Portincasa P. Nonalcoholic fatty liver disease[J]. Best Pract Res Clin Gastroenterol, 2010, 24(5): 695-708.
[3] 贾蓉蓉,赵 严,邱 磊,等. PPARα与非酒精性脂肪肝的最新进展[J]. 胃肠病学和肝病学杂志,2013, 22 (3):210-213.
[4] 韩 敏. 黄酮类化合物降血脂作用研究进展[J]. 西安文理学院学报, 2013,16(4):11-15.
[5] Zheng ZH, Lu XH,Zhang H, et al. Impacts of different promoters on the mammalian one-hybrid assay for detecting nuclear receptor agonists[J]. Anal Bioanal Chem, 2010, 396(5):1721-1730.
[6] Zheng Z, Yang Y, Shao H, et al. Two Thiophenes compounds are partial peroxisome proliferator-activated receptor α/γ dual agonists[J]. Biol Pharm Bull, 2011, 34(10):1631-1634.
[7] Wan Y, Liu LY, Hong ZF, et al. Ethanol extract ofCir-siumjaponicumattenuates hepatic lipid accumulation via AMPK activation in human HepG2 cells[J]. Exp Ther Med, 2014, 8(1):79-84.
[8] Rogue A, Antherieu S, Vluggens A, et al. PPAR agonists reduce steatosis in oleic acid-overloaded HepaRG cells[J]. Toxicol Appl Pharmacol, 2014, 276(1):73-81.
[9] Riserus U, Tan GD, Fielding BA, et al. Rosiglitazone increases indexes of stearoyl-CoA desaturase activity in humans: link to insulin sensitization and the role of dominant-negative mutation in peroxisome proliferator-activated receptor-γ[J]. Diabetes, 2005, 54(5):1379-1384.
[10]韩 茜,赵素梅,黄 英,等.乌金猪与长白猪肝脏脂肪代谢相关基因mRNA表达水平的比较研究[J]. 云南农业大学学报, 2011, 26(3):317-322.
[11]陈 洁,陈东风. 非酒精性脂肪性肝病发病机制的部分进展[J]. 重庆医学, 2009, 38(15):1956-1958.
[12]Hiukka A, Maranghi M, Matikainen N, et al. PPARα:an emerging therapeutic target in diabetic microvascular da-mage[J]. Nat Rev Endocrinol, 2010, 6 (8):454-463.
[13]XU C, Wang LL, Liu HY, et al. A novel dual peroxisome proliferator-activated receptors alpha and gamma agonist with beneficial effects on insulin resistance and lipid metabolism[J]. Biotechnol Lett, 2006, 28(12):863- 868.
[14]Stryjecki C, Roke K, Clarke S, et al. Enzymatic activity and genetic variation in SCD1 modulate the relationship between fatty acids and inflammation[J]. Mol Genet Metab, 2012, 105(3):421-427.
[15]Liu X, Miyazaki M, Flowers MT, et al. Loss of stearoyl-CoA desaturase-1 attenuates adipocyte inflammation: effects of adipocyte-derived oleate[J]. Arterioscler Thromb Vasc Biol, 2010, 30(1):31-38.
[16]Motojima K, Passilly P, Peters JM, et al. Expression of putative fatty acid transporter genes are regulated by peroxisome proliferator-activated receptor alpha and gamma activators in a tissue- and inducer-specific manner[J]. J Biol Chem, 1998, 273(27):16710-16714.

