异甘草素对创伤性脑损伤大鼠损伤灶修复作用的实验研究
杨永明,荔志云
·论 著·
异甘草素对创伤性脑损伤大鼠损伤灶修复作用的实验研究
杨永明,荔志云
目的 观察异甘草素对创伤性脑损伤大鼠病理变化和血清白介素-1α(IL-1α)、IL-1β、IL-6、IL-10和肿瘤坏死因子-α(TNFα)的影响,探讨其在创伤性脑损伤(TBI)后促进脑损伤灶康复的作用机制。方法 运用改良Feeney法建立大鼠脑损伤模型,将动物随机分为假手术组、脑损伤组、异甘草素治疗组,共治疗5d,经平衡木行走试验观察神经行为学变化后处死,采用蛋白芯片法检测血清中的细胞因子,HE染色光镜下观察损伤灶的变化。结果 与脑外伤组相比异甘草素治疗组 IL-1α、IL-6、IL-10的血清含量明显增高,IL-1β和TNFα的含量显著降低(P<0.05),损伤灶病理学变化明显改善。结论 异甘草素可以促进创伤性脑损伤大鼠脑损伤灶康复,其机制可能与调节细胞因子有关。
脑损伤; 异甘草素; 大鼠
创伤性脑损伤(TBI)后的继发性脑损伤可以导致神经组织的进一步损害,延长和(或)引起神经功能缺失[1-2]。目前缺乏有效防止继发性脑损害的药物,异甘草素具有广泛的药理活性[3],具有减低脑损伤后氧化应激反应,增加脑供血量,改善脑组织能量代谢,抑制炎症反应,抑制细胞凋亡等作用。本实验通过异甘草素对脑损伤大鼠进行干预,用蛋白芯片检测血液的细胞因子IL-1α、IL-11β、IL-6、IL-10和TNFα的含量,病理学观察损伤灶的变化,探讨异甘草素对创伤性脑损伤的影响,为脑损伤的治疗提供实验依据。
材料与方法
1 实验动物及材料
清洁级Wistar雄性大鼠45只,由兰州军区兰州总医院动物实验科提供,鼠龄2~3个月,体重150~200g; 蛋白芯片由Ray biotechnology公司提供,异甘草素(纯度98%)由上海源叶生物科技公司提供,自制打击器。
2 TBI模型制作
采用改良Feeney法[4],自制打击器,打击棒重20g,下落高度30cm,打击直径3mm,打击深度为3mm。大鼠用10%水合氯醛(30mg/kg,腹腔注射)麻醉后,固定头部,消毒后于矢状正中线切开头皮,分离软组织及骨膜, 用小型电钻在左顶叶上方开直径约4mm的骨窗,并保持硬膜完整。打击棒沿金属套管从30cm高度打击大鼠头部致伤(冲击力为600g.cm)造成左侧大脑半球局部脑挫裂伤。充分止血后,予以碘伏消毒伤口并缝合头皮,假手术组仅开骨窗不打击。
3 动物分组及给药
随机分为A组(假手术组)、B组(脑损伤组)、C组(异甘草素治疗组)每组15只。用1%的吐温80生理盐水将异甘草素配置成悬液,浓度6mg/ml,术后2h C组给予异甘草素30mg/kg腹腔注射治疗1次/d; A组和B组等体积的1%吐温80生理腹腔注射1次/d,共治疗5d。
4 平衡木行走试验(beam-walkingtest)
各组任取10只大鼠做平衡木行走试验,测定运动整合及协调能力,按Feeney的记分标准评分,评分越高大鼠运动整合及协调能力越差,评分完毕后将所有大鼠放回原组。
Feeney评分标准: 0分: 穿过平衡木,不会跌倒; 1分: 穿过平衡木,跌倒机会<50%; 2分: 穿过平衡木,跌倒机会>50%; 3分: 能穿过平衡木,但受累的瘫痪侧后肢不能帮助向前移动; 4分: 不能穿过平衡木,但可坐在上面; 5分: 将大鼠放在平衡木上会掉下来。
5 细胞因子和脑含水量检测
各组任取10只断头取血分离血清用蛋白芯片法检测血清IL-1α、IL-1β、IL-6、IL-10和TNFα的含量。取大鼠损伤侧脑组织,去除凝血,用冰冷生理盐水冲洗脑组织表面血迹,滤纸吸去脑组织表面残余水分,用电子天平测其湿重,然后于75℃通风烘烤箱烘烤72h至恒重,取出称干重,计算含水量: 脑水含量=(湿重-干重)/湿重×100%。
6 病理学观察
各组取5只大鼠用甲醛做脑内固定后取大脑,甲醛外固定,常规石蜡包埋,脑组织切片(片厚3μm),HE染色,Olympus显微镜放大400倍,观察病理学改变。
结 果
1 细胞因子检测结果
与脑损伤组比较,异甘草素治疗组 IL-1α、IL-6、IL-10的血清含量明显增高,IL-1β和TNFα的含量显著降低,见表1。

表1 异甘草素对脑损伤大鼠血清细胞因子的影响±s,n=10,pg/ml)
B组与A组比较:P<0.05; C组与B组比较:P<0.05
2 平衡木行走试验Feeney评分结果
A组0.33±0.12,B组4.12±0.87,C组2.12±0.57。与B组(脑损伤组)比较,C组(异甘草素治疗组)Feeney评分明显减低(P<0.01)。
3 脑含水量检测结果
A组(71.1±1.92)%,B组(75.53±2.13)%,C组(73.20±1.54)%。与B组(脑损伤组)比较,C组(异甘草素治疗组)脑含水量减少(P<0.05)。
4 病理改变
4.1 大体观察 A组大脑外观良好,脑皮层结构完整,仅在左顶叶见开骨窗时的压痕; B组见左顶叶组织结构破坏,形成一较大创面; C组左顶叶见创面已经愈合遗留外伤后瘢痕灶(图1~3)。
4.2 损伤处皮层组织切片观察 A组脑皮层组织结构良好,细胞大小形态较一致,神经元细胞结构良好; B组脑皮层组织结构破坏,神经元细胞消失,可见大量红细胞,少量胶质细胞; C组脑皮层组织结构破坏,神经元细胞消失,可见红细胞大部分被清除残留少许红细胞,大量胶质细胞(图4~6)。
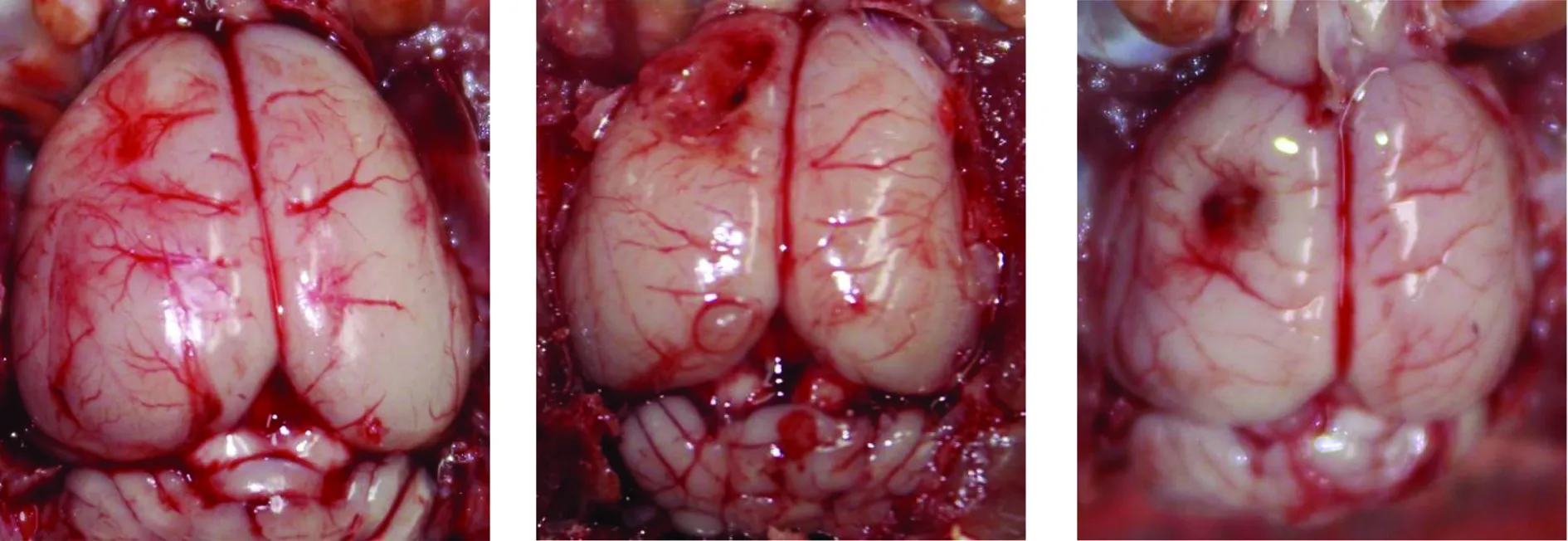
图1 A组 图2 B组 图3 C组
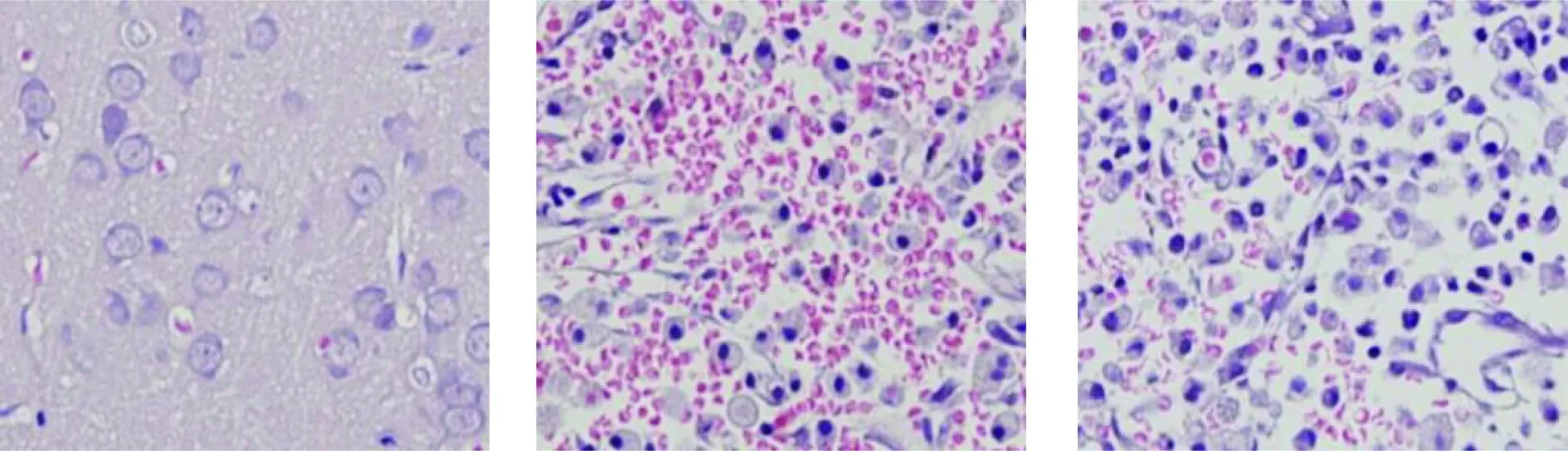
图4 A组(HE×400) 图5 B组(HE×400) 图6 C组(HE×400)
讨 论
创伤性脑损伤后,原发性和继发性脑损伤引起血脑屏障破坏,外周血细胞和脑组织内免疫细胞(神经元细胞和胶质细胞)释放大量细胞因子[5],白细胞介素等细胞因子是参与脑继发性炎症反应的重要信号转导分子[6],既可以加重脑损伤又可以减轻脑损伤。IL-1α在神经系统有重要作用,适度的IL-1α可以提高神经干细胞向多巴胺能神经元分化[7],过度的表达可引起神经退行性疾病[8],IL-1β过量表达可能通过多种途径在颅脑损伤中发挥作用,介导神经元坏死、缺失,引起继发性脑损害[9]。IL-6的水平和疾病的严重程度及预后有关[10-11],IL-6在重症脑损伤中是具有保护作用的细胞因子[12]。IL-10具有很强的抗炎作用,它可以抑制某些炎症因子,如IL-2、IL-1B、TNF-A等的合成及活性,有助于控制炎症,保持内环境的稳定[13]。TNFα可以直接作用于脑损伤区及其周围的血管内皮细胞,破坏它们之间的紧密联接[14]。异甘草素是一种黄酮类化合物,在中枢神经系统有广泛的药理作用,Zhan和Yang[15]研究发现异甘草素对小鼠的局灶性缺血可以提高Na+-K+-ATP酶活性保护脑组织,但目前国内外异甘草素治疗创伤性脑损伤的研究报道很少,在本实验中可以发现异甘草素可以提高IL-1α、IL-6、IL-10含量,减低TNFα和IL-1β的含量,异甘草素还可以促进胶质细胞增殖,增强吞噬细胞对病灶中红细胞的清除能力,降低脑组织水肿,改善大鼠的运动整合及协调能力,促进脑组织伤口愈合。甘草素调节细胞因子的作用与神经行为学和病理学改善同时出现,推测其对创伤性脑损伤大鼠损伤灶修复作用的机制可能与调节细胞因子降低组织炎症反应有关。
[1] Doberstein CE,Hovda DA,Becker DP,et al.Clinical considerations in the reduction of secondary brain injury[J].Ann Emerg Med,1993,22(6):993-997.
[2] Nida TY,Biros MH,Pheley AM,et al.Effect of hypoxiaor hyperbaric oxygen on cerebral edema following moderate fluid percussion or cortical impact injury in rat[J].Neurotrauma,1995,12(1):77-85.
[3] Haraguchi H,Ishikawa H,Mizutani K,et al.Antioxidative and superoxide scavenging activities of retrochalcones in Glycyrrhiza inflata[J].Bioorg Med Chem,1998,6(3):339-347.
[4] Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury: I. Methodology and local effects of contusions in the rat[J].Brain Res,1981,211(1):67-77.
[5] Lenzlinger PM,Morganti-Kossmann MC,Laurer HL,et al.The duality of the inflammatory response to traumatic brain injury[J].Mol Neurobiol,2001,24(1-3):169-181.
[6] Lentsch AB,Ward PA.Activation and regulation of NF-kappa B during acute inflammation[J].Clin Chem Lab Med,1999,37(3):205-208.
[7] Ling ZD,Potter ED,Lipton JW,et al.Differentation of mesencephalic progenitor cells into dopaminergic neurons by cytokines[J].Exp Neurol,1998,149(2):411-423.
[8] Griffin WS,Mrak RE.Interleukin-1 in the genesis and progression of and risk for development of neuronal degeneration in Alzheimer's disease[J].J Leukoc Biol,2002,72(2):233-238.
[9] Marini H,Altavilla D,Bellomo M,et al.Modulation of IL-1 beta gene expression by lipid peroxidation inhibition after kainic acid-induced rat brain injury[J].Exp Neurol,2004,188(1):178-180.
[10] Woiciechowsky C,Schoning B,Cobanov J,et al.Early IL-6 plasma concentrations correlate with severity of brain injury and pneumonia in brain injured patients[J].J Trauma,2002,52(2):339-345.
[11] Singhal A,Baker AJ,Hare GM,et al.Association between cerebrospinal fluid interleukin-6 concentrations and outcome after severe human traumatic brain injury[J].J Neurotrauma,2002,19(8):929-937.
[12] Winter CD,Pringle AK,Clough GF,et al.Raised parenchymal interleukin-6 levels correlate with improved outcome after traumatic brain injury[J].Brain,2004,127(Pt2):315-320.
[13] Knoblach SM,Faden AI.Interleukin-10 improves outcome and alters proinflammatory cytokine expression after experimental traumatic brain injury[J].Exp Neurol,1998,153(1):143-145.
[14] Zhang X,Li H,Hu S,et al.Brain edema after intracerebral hemorrhage in rats:the role of inflammation[J].Neurol India,2006,54(4):402-407.
[15] Zhan C,Yang J.Protective effects of isoliquiritigenin in transientmiddle cerebral artery occlusion- induced focal cerebral ischemia in rats[J].Pharmacol Res,2006,53(3):303-309.
(本文编辑: 贺 羽)
Repairing effects of isoliquiritigenin on traumatic brain injury in rats
YANGYong-ming,LIZhi-yun
(Department of Neurosurgery,Lanzhou General Hospital,Lanzhou Military Command,Lanzhou 730050,China)
Objective To observe the effect of isoliquiritigenin on pathological changes and serum IL-1α,IL-11β,IL-6,IL-10 and TNFα after traumatic brain injury in rats and to investigate its possible mechanism for brain rehabilitation. Methods Rats were randomly divided into 3 groups: sham-operated group,traumatic brain injury(TBI) group and isoliquiritigenin-treated group. TBI model was established with the modified Feeney’s method. After 5 days of treatment,the TBI rats were sacrificed to measure the serum cytokines by protein chip and to observe the pathology of the brain tissues under optical microscope through HE staining. Results Compared with the TBI group,IL-1β and TNFα were decreased,IL-1α,IL-6 and IL-10 were remarkably increased,the pathology of the brain tissues was notably alleviated. Conclusion Isoliquiritigenin can promote brain tissue rehabilitation of traumatic brain injury in rats. The underlying mechanism of this effect may be associated with the cytokines which can regulate brain tissue.
brain injury; isoliquiritigenin; rats
1009-4237(2014)02-0144-03
2012解放军总后勤科研项目(CLZ12J006)
730050 甘肃,兰州军区兰州总医院神经外科
荔志云,E-mail: Lizhiyun456@163.com
R 651
A
2013-10-16;
2013-11-18)

