经阴道B超监测下不同促排卵药物治疗多囊卵巢综合征伴不孕患者的临床疗效分析▲
刘俐伶 庞丽红 邓 丽 殷 艳
(广西医科大学第一附属医院妇产科,南宁市 530021)
经阴道B超监测下不同促排卵药物治疗多囊卵巢综合征伴不孕患者的临床疗效分析▲
刘俐伶 庞丽红*邓 丽 殷 艳
(广西医科大学第一附属医院妇产科,南宁市 530021)
目的探讨诱导排卵药物氯米芬(CC)、尿促性素(HMG)和绒促性素(HCG)治疗多囊性卵巢综合征(PCOS)伴不孕患者的临床疗效。方法选取43例患有多囊卵巢综合征而不孕的患者,根据使用促排卵药物组合的不同,分为CC/HCG、CC/HMG/HCG和HMG/HCG组。通过经阴道B超(TVS)测定并比较三组患者的HCG日子宫内膜厚度、多卵泡发生率、卵巢过度刺激综合征(OHSS)发病率、妊娠率和流产率。结果CC/HMG/HCG、HMG/HCG组HCG日平均子宫内膜厚度、多卵泡发生率和OHSS发生率明显高于CC/HCG组,差异具有统计学意义(P<0.05);CC/HMG/HCG与HMG/HCG组之间差异无统计学意义。3组之间妊娠率、流产率无统计学意义(P>0.05)。结论对PCOS不孕患者使用任意一种促排卵方案都是可行的。但对于CC抵抗的患者,则建议使用CC/HMG/HCG或者HMG/HCG促排卵治疗。
多囊卵巢综合征;不孕;促排卵药物;经阴道B超
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄妇女无法正常受孕的常见原因,其病因涉及中枢神经系统垂体卵巢轴、肾上腺、胰岛及遗传等方面。其典型的临床表现为月经异常、不孕、多毛、肥胖等,并随年龄的增长而出现胰岛素抵抗或高胰岛素血症和高脂血症[1]。大部分研究认为,促排卵药物治疗能显著提高患者的排卵率和临床妊娠率[2]。目前,诱导排卵的药物主要有氯米芬(CC)、尿促性素(HMG)和绒促性素(HCG)。各种促排卵药物都有其优缺点,在临床中,一般做法是首选CC,对于CC治疗无效的患者则采用CC/HMG/HCG和HMG/HCG等组合方案治疗。本研究使用经阴道B超的方法测定并对比CC/HCG、CC/HMG/HCG和HMG/HCG三种方案治疗PCOS不孕症的疗效,旨在探讨治疗PCOS的最优方法。
1 资料与方法
1.1 一般资料 选取我院2013年1月至2013年12月43例因患有PCOS无法受孕的患者,根据使用促排卵药物组合的不同,分为CC/HCG、CC/HMG/HCG和HMG/HCG 3组。其中CC/HCG组15例,年龄24~46岁,平均年龄(30.11±1.7)岁,不孕年限1~22年,平均(5.12±0.5)年;CC/HMG/HCG组11例,年龄22~44岁,平均年龄(29.17±1.3)岁,不孕年限1~23年,平均(4.49±1.2)年;HMG/HCG组17例,年龄21~43岁,平均年龄(31.44±1.2)岁,不孕年限1~21年,平均(5.67±0.4)年。所有不孕患者均诊断为PCOS,输卵管造影证实输卵管通畅,配偶精液检查正常。两组患者的年龄、病情等其他一般资料差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 PCOS诊断方法 符合以下两条,即可诊断为PCOS:①临床表现为月经不规则、经量少或闭经,伴有多毛和肥胖,婚后不孕等;②血性激素水平:FSH正常,LH增高,LH/FSH≥2;③B超检查:一侧或双侧卵巢可见小卵泡数(直径2~8 cm)超过10个,卵巢基质回声增强[4]。
1.2.2 促排卵方法
1.2.2.1 CC/HCG组 患者于自然月经周期或撤药性子宫出血的第5天开始,每天服CC 50 mg。第10天开始通过阴道B超监测(TVS)内膜发育、优势卵泡(dominant follicle,DF)的个数及大小,每天或间隔1~2天1次,直至卵泡直径≥16 mm,测定尿LH,每天1次,若尿LH峰出现,提示24 h内将排卵,立即肌注HCG 5 000~10 000 U。连续经阴道B超监测到HCG注射后96 h,若仍未排卵,则诊断为黄素化未破裂卵泡综合征(luteinized unruptured follicle syndrome,LUFS)。
1.2.2.2 CC/HMG/HCG组 于自然月经周期或撤药性子宫出血的第3~5天开始,每天服CC 50 mg,月经第8~10天开始肌注HMG 75 U,qd,同时进行TVS监测,根据卵泡发育情况可延长注射HMG的天数或剂量。卵泡监测、HCG注射方法同CC/HCG组。
1.2.2.3 HMG/HCG组 于自然月经周期或撤药性子宫出血的第3~5天开始,每天肌注HMG 75 U,月经第8天起通过TVS监测卵泡发育,若第11天 DF直 径≤14 mm,HMG可加量到150 U/d。卵泡监测、HCG注射方法同CC/HCG组。
1.2.2.4 治疗方案变更 针对治疗周期中多次TVS监测仍然无优势卵泡生长的患者,于下个周期改用其他方案。本次实验中,CC/HCG组有1例于下周期改用CC/HMG/HCG方案;CC/HMG/HCG组有2例于下周期改用HMG/HCG方案。
1.2.2.5 卵泡的监测及处理 对于在周期中发现直径≥14 mm的卵泡数多于10个的患者,当其卵巢内最大卵泡直径达18 mm时,经阴道穿刺抽吸掉多余卵泡。最多每侧各留一个直径达18 mm或以上的卵泡,并定期进行TVS监测,防止OHSS的发生及避免需要减胎术的多胎妊娠[5]。
1.2.2.6 其他 所有患者于监测卵巢内最大卵泡直径达18 mm时指导同房,隔日1次,直到排卵后3 d。
1.2.3 黄体酮注射 于证实排卵后开始,每天肌注黄体酮20 mg,14 d为1个疗程。
1.2.4 妊娠检测 治疗后定期进行B超检查,见宫腔内孕囊及原始心管搏动者判定为临床妊娠[6]。
1.3 统计学方法 应用SPSS 13.0软件分析,计量资料以均数±标准差(x±s)表示,比较用t检验,计数资料以率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床疗效 不同促排卵药物方案的临床疗效比较如表1所示。CC/HMG/HCG组和HMG/HCG组HCG日平均子宫内膜厚度明显高于CC/HCG组,差异有统计学意义(P=0.006 2,P=0.000 0);CC/HMG/HCG组与HMG/HCG组之间差异无统计学意义(P=0.162 5)。CC/HMG/HCG和HMG/HCG组与CC/HCG组相比多卵泡发生率明显升高,差异有统计学意义(P=0.007 8,P=0.001 2);CC/HMG/HCG和HMG/HCG组之间差异无统计学意义(P=0.077 8)。CC/HMG/HCG和HMG/HCG组与第1组相比OHSS发生率明显升高,差异有统计学意义(P=0.036 1,P=0.024 8);CC/HMG/HCG和HMG/HCG组之间差异无统计学意义(P=0.175 3)。
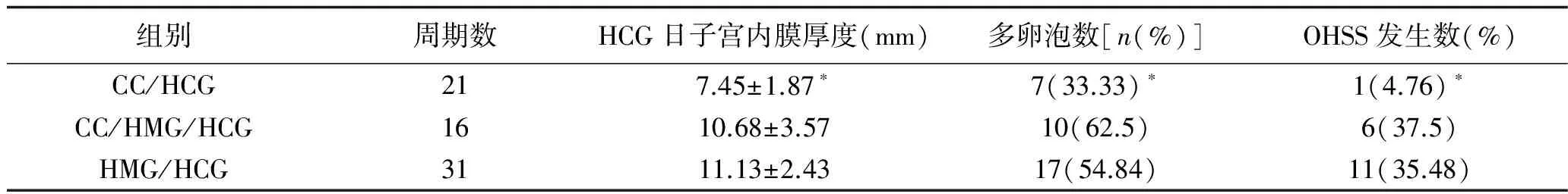
表1 3种促排卵方案对PCOS不孕症患者的临床疗效
2.2 妊娠结果 不同促排卵药物方案的妊娠结果如表2所示,3组之间妊娠率、流产率、多胎妊娠率无统计学意义(P>0.05),见表2。
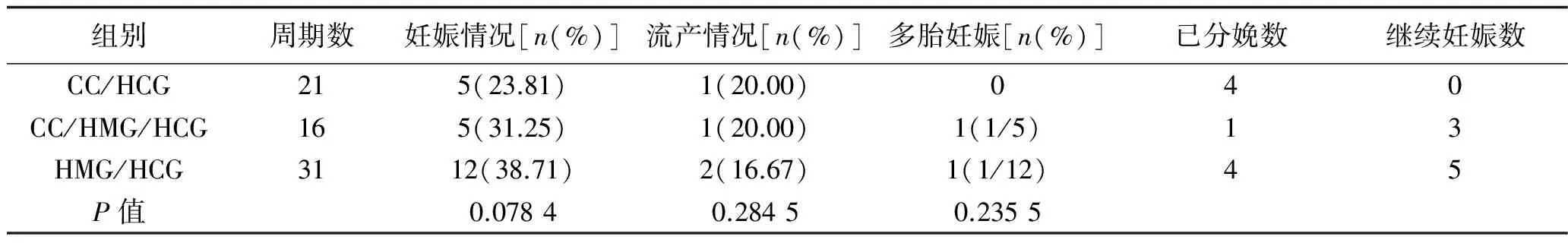
表2 3种促排卵药物方案的妊娠结果比较
3 讨 论
PCOS的病因至今尚未定论,一般认为与下丘脑-垂体功能障碍、肾上腺皮质功能异常、胰岛素抵抗、高胰岛素血症和遗传等因素有关,是育龄期女性无排卵、不孕不育的重要原因之一[7]。针对PCOS伴不孕患者,治疗的根本方法是促进其排卵。临床上常用CC作为促排卵药物,因为其能与下丘脑-垂体水平的内源性雌激素竞争受体,抑制雌激素负反馈,增加促性腺激素释放激素(GnRH)分泌的脉冲频率,从而调整促性腺激素(LH)与卵泡刺激素(FSH)的分泌比率,直接促使卵巢合成和分泌雌激素[8]。但其也有一些局限性,如阻碍雌激素对内膜的刺激,导致子宫内膜腺体发育不全,进而影响胚泡着床[9]。还有报道指出,一部分对CC反应不良的PCOS患者服用CC后,卵子质量不高,导致高排卵低妊娠率的发生[10]。针对这些问题,临床上常采用CC联合HMG或直接使用HMG的方法治疗PCOS。
一般认为,子宫内膜稀薄会减少其对胚胎的容受性从而降低妊娠率,或妊娠后易于流产[11]。本研究组采用CC/HCG、CC/HMG/HCG、HMG/HCG三种促排卵方案治疗PCOS,能明显增加子宫内膜厚度及多卵泡周期数。本研究中CC/HMG/HCG和HMG/HCG组由于加用HMG,明显改善子宫内膜的厚度,提示HMG能促进卵泡发育,提高血浆中雌激素水平进而促进子宫内膜生长。但CC/HMG/HCG和HMG/HCG组的妊娠率、流产率较CC/HCG组无明显变化,可能与本研究中样本量较小,以及CC/HCG组中因子宫内膜较薄或卵巢反应不良而取消周期有关。
相关文献报道,CC对PCOS不孕症的治疗,可使排卵率达到60%~80%,妊娠率达到30%~50%,未妊娠者加用HMG可获得38%~65%的妊娠率[12]。但其副作用较多[13],诱发OHSS的危险也较大。有学者报道[14],HMG促排卵可导致的OHSS的发生率高达45.4%。
以上结果表明,对 PCOS不孕患者使用任意一种促排卵方案都是可行的。对于常规患者,可使用CC或者CC/HCG治疗;而对于CC抵抗的患者,则可使用CC/HMG/HCG或者HMG/HCG促排卵。由于HMG促排卵会导致多卵泡发育使OHSS发生风险大大增加,故在使用HMG过程中需慎重掌握其剂量和方法。同样,HCG的治疗剂量也应因人及治疗周期而异,并备有严密的卵泡成熟监测措施,防止发生OHSS。
[1] Norman RJ,Dewailly D,Legro RS,et al.Polycystic ovary syndrome[J].Lancet,2007,370(9588):685-697.
[2] 柳雪琴,张海英,莫似恩,等.来曲唑和克罗米酚两种微刺激方法助孕的临床结局比较[J].微创医学,2010,3(6):222-224.
[3] Shang K,Jia X,Qiao J,et al.Endometrial abnormality in women with polycystic ovary syndrome[J].Reprod Sci,2012,19(7):674-683.
[4] Hardiman P,Pillay OC,Atiomo W.Polycystic ovary syndrome and endometrial carcinoma[J].Lancet,2003,361(9371):1810-1812.
[5] 李柳铭,李慕军,袁 华,等.超声引导下多胎妊娠选择性减胎术的临床应用分析[J].微创医学,2007,2(5):381-384.
[6] Chittenden BG,Fullerton G,Maheshwari A,et al.Polycystic ovary syndrome and the risk of gynaecological cancer:a systematic review[J].Reprod Biomed Online,2009,19(3):398-405.
[7] Kim JJ,Kurita T,Bulun SE.Progesterone action in endometrial cancer,endometriosis,uterine fibroids,and breast cancer[J].Endocr Rev,2013,34(1):130-162.
[8] Lee WL,Lee FK,Su WH,et al.Hormone therapy for younger patients with endometrial cancer[J].Taiwan J Obstet Gynecol,2012,51(4):495-505.
[9] Haoula Z,Salman M,Atiomo W.Evaluating the association between endometrial cancer and polycystic ovary syndrome[J].Hum Reprod,2012,27(5):1327-1331.
[10]Fearnley EJ,Marquart L,Spurdle AB,et al.Polycystic ovary syndrome increases the risk of endometrial cancer in women aged less than 50 years:an Australian case-control study[J].Cancer Causes Control,2010,21(12):2303-2308.
[11]Burzawa JK,Schmeler KM,Soliman PT,et al.Prospective evaluation of insulin resistance among endometrial cancer patients[J].Am J Obstet Gynecol,2011,204(4):e351-357.
[12]Kaaks R,Lukanova A,Kurzer MS.Obesity,endogenous hormones,and endometrial cancer risk: a synthetic review[J].Cancer Epidemiol Biomarkers Prev,2002,11(12):1531-1543.
[13]陈桂荣,甘柏柳,周 霓,等.四维成像在胎儿体表畸形诊断中的应用研究[J].微创医学,2008,3(6):657-659.
[14]Tong XM,Lin XN,Jiang HF,et al.Fertility-preserving treatment and pregnancy outcomes in the early stage of endometrial carcinoma[J].Chin Med J (Engl),2013,126(15):2965-2971.
ClinicaltherapeuticeffectanalysisofdifferentovulationinductiondrugsinthetreatmentofinfertilitypatientsofpolycysticovarysyndromesupervisedbytrasvaginalB-ultrasound
LIULiling,PANGLihong,DENGLi,YINYan
(DepartmentofObstetricsandGynecology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning, 530021,Guangxi,P.R.China)
ObjectiveTo investigate the clinical therapeutic effects of ovulation induction drugs like clomiphene citrate (CC), human menopausal gonadotropin (HMG), and human chorionic gonadotrophin (HCG) in patients with polycystic ovarian syndrome (PCOS).MethodsAccording to the different combinations of ovulation induction drugs, 43 patients with PCOS were divided into CC/HCG, CC/HMG/HCG, or HMG/HCG group. Endometrial thickness of HCG day, incidence of multiple follicular number, incidence of ovarian hyperstimulation syndrome (OHSS), pregnancy rate, and abortion rate of 3 groups were measured under B-ultrasound supervising and compared.ResultsEndometrial thickness of HCG day, incidence of multiple follicular number, incidence of ovarian hyperstimulation syndrome (OHSS) in CC/HMG/HCG and HMG/HCG groups were significantly higher than those in CC/HCG group, but no statistical difference was detected between CC/HMG/HCG and HMG/HCG groups (P>0.05). There was no significant difference in pregnancy rate and abortion rate between 3 groups.ConclusionAll three ovulation induction strategies are feasible for infertility patients of PCOS. But for patients with CC resistance, the regimen of CC/HMG/HCG or HMG/HCG was recommended.
Polycystic ovary syndrome; Infertility; Ovulation induction drug; Curative effect; Transvaginal ultrasound
广西卫生厅课题重点(重2011098);广西科学研究与技术开发项目(11217004)
刘俐伶(1978~),女,硕士,主治医师,研究方向:妇科内分泌。
R 711.75
A
1673-6575(2014)02-0163-04
10.11864/j.issn.1673.2014.02.12
2014-01-06
2014-03-02)
*通讯作者

