石榴皮鞣花酸对4T1乳腺癌小鼠免疫功能的影响
张玉梅,王家晓
(广西中医药大学第一附属医院,广西 南宁 530023)
论 著
石榴皮鞣花酸对4T1乳腺癌小鼠免疫功能的影响
张玉梅,王家晓
(广西中医药大学第一附属医院,广西 南宁 530023)

目的 探讨石榴皮鞣花酸对人乳腺癌4T1细胞株生长的抑制作用及对乳腺癌荷瘤小鼠免疫功能的影响。方法 测定石榴皮鞣花酸对体外培养的4T1细胞生长的抑制率;流式细胞仪测定肿瘤细胞凋亡情况;检测应用石榴皮鞣花酸后荷瘤小鼠的脾淋巴细胞的NK、LAK、CTL活性及血清TNF活性改变,并与对照组比较。结果 石榴皮鞣花酸抑制4T1细胞生长形成;流式细胞仪显示石榴皮鞣花酸可有效诱导细胞凋亡;石榴皮鞣花酸低剂量组和高剂量组均可明显诱导荷瘤小鼠脾淋巴细胞NK、LAK和CTL活性提高,且血清TNF水平明显上升,与生理盐水组、DDP组比较均有显著性差异(P均<0.05)。石榴皮鞣花酸低剂量组与高剂量组均无显著性差异(P>0.05)。结论 石榴皮鞣花酸可明显抑制4T1细胞增殖诱导其凋亡,石榴皮鞣花酸可明显诱导提高荷瘤小鼠特异性抗肿瘤免疫反应。
石榴皮鞣花酸;乳腺癌;小鼠;免疫功能
乳腺癌是最常见的女性恶性肿瘤之一。多年来,乳腺癌发病率在发达国家一直占女性恶性肿瘤的首位。近年来中国的乳腺癌发病率在逐年上升且出现年轻化的趋势。据统计,全球乳腺癌新发病例在过去30 a间(1980年—2010年)逐年上升,年增长率达3.1%。有报道,2010年全世界乳腺癌患病人数更是高达1 643 000(1 421 000~1 782 000)人[1]。乳腺癌的发生发展是多基因参与的、多阶段的复杂过程,是细胞中多种基因表达改变累积的结果,在此过程中既有原癌基因的激活与抑癌基因的失活,也有细胞周期的调控和凋亡基因的改变以及细胞内调节环节的紊乱[2]。石榴皮是石榴科植物石榴的干燥果皮,性酸、味涩,具有涩肠、止血、杀虫的功效。现代药理学研究表明,石榴皮具有抗肿瘤、抗病毒、抗菌和抗氧化等作用,从其中提取的鞣花酸具有很强的抗肿瘤活性[3]。本研究观察了石榴皮鞣花酸对乳腺癌4T1细胞体外增殖和细胞凋亡的影响及其对乳腺癌4T1荷瘤小鼠的肿瘤抑制情况,以探讨石榴皮鞣花酸可能的抗癌机制。
1 实验资料
1.1 主要仪器及试剂 纯系BALB/C小鼠,雌雄各半,体质量18~22g,购于广西中医药大学实验动物部。小鼠4T1乳腺癌细胞株由广西中医药大学免疫学实验室惠赠。RPMI1640培养基为美国Gibco公司生产。胎牛血清为美国HyClone公司生产。石榴皮鞣花酸购自上海谱振生物科技有限公司,纯度为96%。SP试剂盒购自北京博奥森生物技术有限公司。CCK-8杀伤活性测定试剂盒购自Promega公司。
1.2 细胞培养 小鼠4T1乳腺癌细胞以含10%胎牛血清的RPMI1640于37 ℃,5% CO2培养箱中培养,隔天换液1次,0.25%胰酶消化传代。取对数生长期细胞制备单细胞悬液进行不同的实验。
1.3 CCK-8法检测细胞增殖率
1.3.1 标准曲线制备 取处于指数增殖期的小鼠4T1乳腺癌细胞,按照不同的细胞密度接种于96孔板中,培养24 h后每孔加入10 μL的CCK-8,继续培养4 h,于酶标仪上450 nm比色测吸光度值,根据检测结果绘制细胞增殖标准曲线。
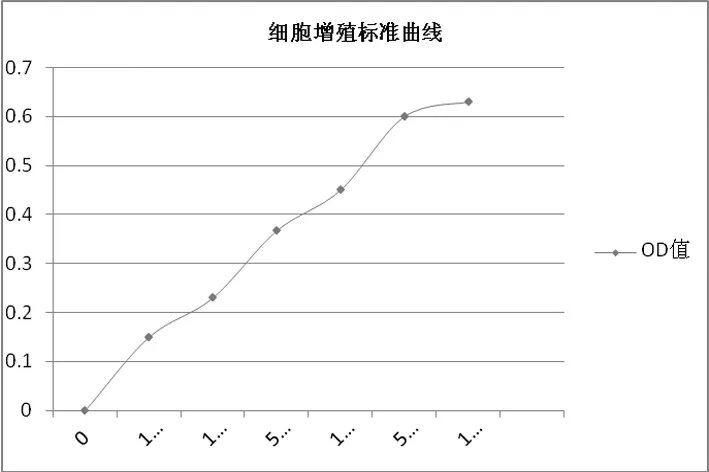
图1 小鼠4T1乳腺癌细胞增殖标准曲线
1.3.2 细胞增殖抑制率检测 取处于指数增殖期的肿瘤细胞按照5×104mL-1接种于96孔培养板,设置对照和实验组,每个剂量和对照均设3复孔。实验组加入不同浓度石榴皮鞣花酸(10,20,30 g/L),对照组和DDP组分别加等量的生理盐水和DDP,加药共培养48 h后加入CCK-8,同上检测细胞450 nm比色测吸光度值,细胞增殖抑制率=(1-实验组OD值/阴性对照组OD值)×100%。
1.4 细胞周期分析 取指数增殖期的小鼠4T1乳腺癌细胞种植于6孔板中,细胞种植密度为104mL-1,每孔3 mL。设置对照和实验组,实验组加入不同浓度石榴皮鞣花酸(10,20,30 g/L),对照组加生理盐水,共培养48 h后收集细胞,PBS洗2次,使用30%PBS乙醇重悬细胞沉淀,摇匀后向细胞悬液中加入5 mL的PI,闭光作用5 min后上机检测细胞周期。
1.5 小鼠4T1乳腺癌荷瘤小鼠的建立 6周龄BALB/C小鼠右侧腋窝皮下接种小鼠4T1乳腺癌细胞0.1 mL(含5×105个小鼠4T1乳腺癌细胞),12 d左右肿瘤直径达0.5 cm大小时即成小鼠4T1乳腺癌荷瘤小鼠。
1.6 观察石榴皮鞣花酸对乳腺癌荷瘤小鼠的保护作用 将52只BALB/C乳腺癌荷瘤小鼠随机分为4组:石榴皮鞣花酸高剂量组、石榴皮鞣花酸低剂量组、DDP组和生理盐水组,每组13只。接种小鼠4T1乳腺癌细胞后第2天开始灌胃,连续灌胃给药10 d,鞣花酸高剂量组每天1次灌注0.4 mL鞣花酸高浓度稀释液(相当于鞣花酸30 g/L),鞣花酸低剂量组每天1次灌注0.4 mL鞣花酸低浓度稀释液(相当于鞣花酸10 g/L),DDP组每天1次灌注0.4 mL DDP稀释液(相当于DDP 5 g/L),生理盐水组每天1次灌注0.4 mL生理盐水。连续喂养3周。另外以13只正常小鼠每天1次灌注0.4 mL生理盐水作为对照组。
1.7 小鼠脾淋巴细胞免疫功能测定 测定各组NK、LAK、CTL活性和TNF水平。
1.7.1 各组小鼠脾NK、LAK、CTL活性检测 连续喂养3周后无菌取出BALB/C小鼠脾脏,体外制成脾淋巴细胞悬液,培养液中加入50 IU/mL rhIL-2进行培养。参照文献[4]采用LDH 4 h释放法进行测定(按试剂盒说明书操作)。
1.7.2 各组小鼠血清TNF水平检测 上述各组小鼠在连续喂养3周后处死,在处死前先以拔眼球法分别提取各小鼠的全血2 mL,室温放置4 h,离心2 000 r/min,25 min后分离出血清。以血清作为待测样品,置于-20 ℃冰箱中贮存备测。参照文献[5]采用LDH 4 h释放法进行测定(按试剂盒说明书操作)。
1.8 统计学处理 采用SPSS 13.0软件进行统计分析,多组均数的比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 石榴皮鞣花酸对小鼠4T1乳腺癌细胞增殖的影响 石榴皮鞣花酸对小鼠4T1乳腺癌细胞具有明显的增殖抑制作用。不同浓度的鞣花酸组对小鼠4T1乳腺癌细胞抑制增殖作用的时间曲线基本相同,都是在培养48 h时最明显。鞣花酸20 g/L组与30 g/L组的抑制增殖作用与10 g/L组比较有显著性差异(P均<0.05)。但20 g/L组与30 g/L组比较无显著性差异,提示鞣花酸对小鼠4T1乳腺癌细胞的增殖可能有饱和抑制作用。见表1。
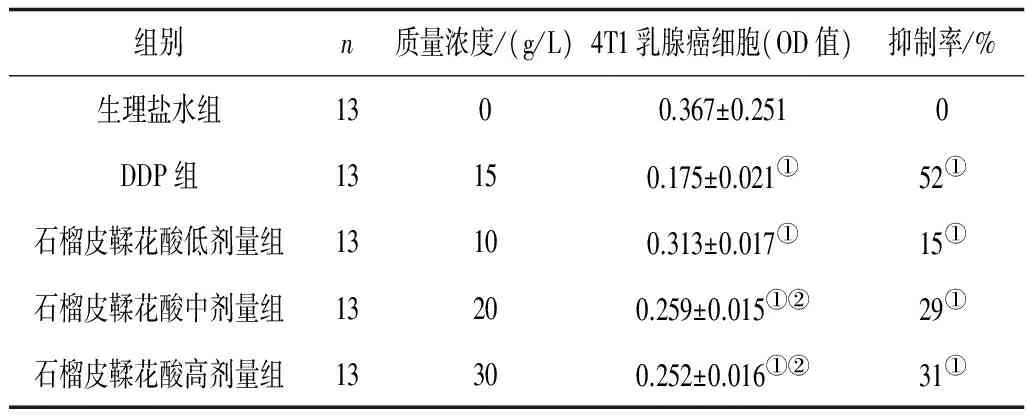
表1 各组对小鼠4T1乳腺癌细胞的抑制作用
注:①与生理盐水组比较,P<0.05;②与鞣花酸低剂量组比较,P<0.05。
2.2 各组对小鼠4T1乳腺癌细胞的诱导凋亡作用 流式细胞仪细胞凋亡计数结果显示,不同浓度石榴皮鞣花酸在一定时间范围内,诱导肿瘤细胞凋亡的作用随药物浓度及作用时间的增加而增强,但当鞣花酸到达一定浓度(20 g/L)后凋亡诱导作用逐渐趋向稳定。见图2~图4。
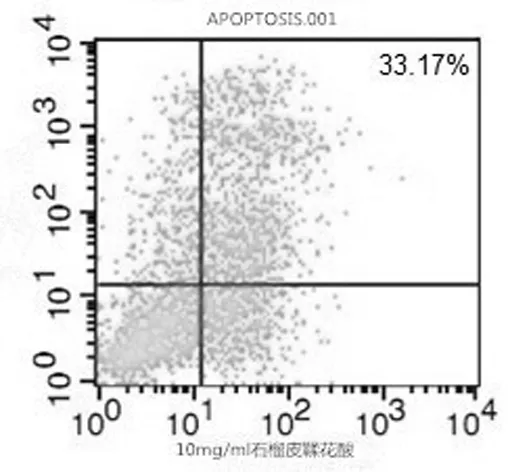
图2 石榴皮鞣花酸低剂量细胞凋亡情况
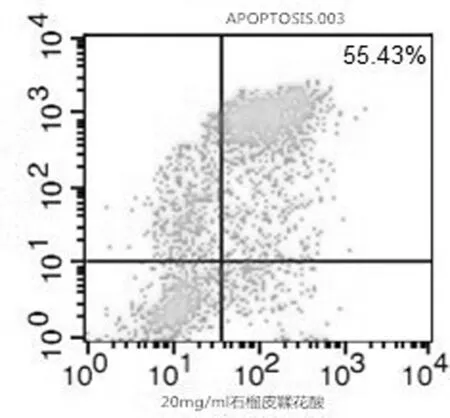
图3 石榴皮鞣花酸中剂量细胞凋亡情况
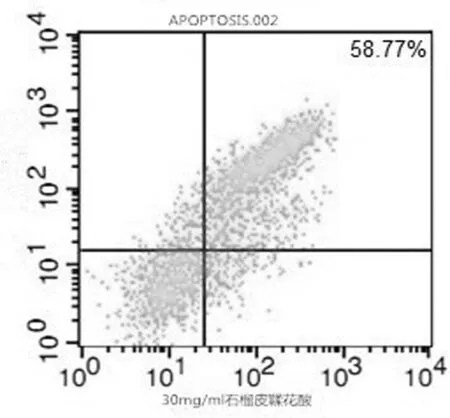
图4 石榴皮鞣花酸高剂量细胞凋亡情况
2.3 细胞周期分析 不同浓度鞣花酸与小鼠4T1乳腺癌细胞共培养后,细胞周期分布发生了明显变化,G1期的细胞均增加明显,G2/M期的细胞出现减少,并且可见到较明显的凋亡峰形成。各浓度组G1期细胞与生理盐水组比较均有显著性差异(P均<0.05);鞣花酸3个浓度组中,低浓度组与中浓度组和高浓度组比较均有显著性差异(P均<0.05),但中浓度组与高浓度组比较无显著性差异(P>0.05)。见表2。
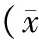
表2 各组小鼠4T1乳腺癌细胞周期分布比较±s,%)
注:①与生理盐水组比较,P<0.05;②与石榴皮鞣花酸低剂量组比较,P<0.05。
2.4 各组小鼠NK、LAK、CTL和TNF活性比较 各组NK、LAK、CTL和TNF活性比较均有显著性差异(P均<0.05)。各实验组NK、LAK、CTL活性和血清TNF水平均较对照组低(P均<0.05),DDP组NK、LAK、CTL活性和血清TNF水平均较生理盐水组荷瘤小鼠降低(P均<0.05)。石榴皮鞣花酸低剂量组和高剂量组NK、LAK、CTL活性和血清TNF水平均较生理盐水组、DDP组高(P均<0.05),但仍低于正常小鼠的水平(P<0.05),提示石榴皮鞣花酸可明显改善荷瘤小鼠的免疫功能状态。石榴皮鞣花酸低剂量组NK、LAK、CTL活性和血清TNF水平与高剂量组比较无显著性差异(P均>0.05)。见表3。
表3 各组小鼠NK、LAK、CTL和TNF活性比较
注:①与生理盐水组比较,P<0.05;②与DDP组比较,P<0.05;③与对照组比较,P<0.05。
3 讨 论
乳腺癌是全球现代女性最常见恶性肿瘤之一,占癌症总发病率的29%,也是女性癌症死亡的首要原因,占癌症死亡率的14%,严重危害妇女身心健康。目前普遍认为乳腺癌是多因素作用、多基因参与、多阶段发展的疾病,导致乳腺癌常见发病因素包括遗传、内分泌、饮食及物理因素,其中遗传因素中涉及众多癌基因和抑癌基因失衡、信号通路传导异常和细胞周期调节的改变等。然而其发生和发展的确切机制尚未阐明[6]。
在本研究中,石榴皮鞣花酸对4T1乳腺癌细胞具有明显的增殖抑制作用,可诱导4T1乳腺癌细胞凋亡,荷瘤小鼠经胃灌注石榴皮后肿瘤生长受到明显抑制,这些均表明石榴皮鞣花酸具有明显的抗肿瘤作用。然而,当石榴皮鞣花酸浓度升到一定值后,对肿瘤细胞的抑制作用往往逐渐呈饱合状态,石榴皮鞣花酸低剂量细胞抑制率与中剂量组比较无显著性差异,表明石榴皮鞣花酸虽然对肿瘤细胞具有明显的增殖抑制作用,但与化疗药物相比,石榴皮鞣花酸可能主要通过对肿瘤细胞周期的改变引起肿瘤细胞凋亡。细胞凋亡受抑导致病变组织内肿瘤细胞存活时间延长,破坏细胞群体内存活与死亡的平衡,存活细胞数大于死亡细胞数,则肿瘤细胞数量净增多[7]。
肿瘤的发生发展往往伴随着机体免疫功能下降,本文结果显示,荷瘤小鼠免疫细胞较正常小鼠出现明显下降,而荷瘤小鼠应用DDP治疗后免疫力下降更明显,石榴皮低剂量组和高剂量组NK、LAK、CTL活性和血清TNF水平均较生理盐水组和DDP组高,但均低于正常小鼠的水平,提示石榴皮鞣花酸可明显改善荷瘤小鼠的免疫功能状态。石榴皮鞣花酸低剂量组NK、LAK、CTL活性和血清TNF水平与高剂量组比较无显著性差异,表明石榴皮鞣花酸对机体免疫功能的激活可能有饱和效应,这也是其治疗的瓶颈所在。石榴皮鞣花酸治疗后荷瘤小鼠肿瘤稍缩小,肿瘤大小与其他各组相比均有显著性差异,表明石榴皮鞣花酸过继免疫后不仅有助于小鼠机体免疫功能的恢复,同时激活机体免疫系统对肿瘤产生特异性的抗瘤作用。
综上所述,石榴皮鞣花酸可以增强荷瘤小鼠的免疫功能,研究开发石榴皮鞣花酸免疫增强剂具有实际意义和广阔的应用前景。
[1] Forouzanfar MH,Foreman KJ,Delossantos AM,et al. Breast and cervical cancer in 187 countries between 1980 and 2010:a systematic analysis[J]. Lancet,2011,378(9801):1461-1484
[2] Thornton H. New citizens’juries in breast screening review are biased[J]. BMJ,2012,345:7552-7555
[3] 杜欣,叶盛英. 石榴叶和石榴皮药理活性研究进展[J]. 天津药学,2007,19(2):64-66
[4] Chen HY,Wu SL,Yeh MY,et al. Antimetastatic activity induced by clostridium butyricum and characterization of effector cells[J]. Anticancer Res,2005,13(1):107-111
[5] Decker T,Lohmann-Matthes ML. A quick and simple method for the quantitation of lactate dehydrogenase release in measurements of cellular cytotoxicity and tumor necrosis factor (TNF) activity[J]. J Immunol Meth,2008,115(4):61-69
[6] Emens LA. Breast cancer immunobiology driving immunotherapy:vaccines and immune checkpoint blockade[J]. Expert Rev Anticancer Ther,2012,12(12):1597-1611
[7] Basu S,Ma R,Moskal JR,et al. Apoptosis of breast cancer cells: modulation of genes for glycoconjugate biosynthesis and targeted drug delivery[J]. Adv Exp Med Biol,2012,749:233-255
Influence of pomegranate peel ellagic acid on immune function of mice with 4T1 breast cancer
Zhang Yumei, Wang Jiaxiao
(The Affiliated First Hospital of Guangxi Traditional Medical University, Nanning 530023, Guangxi, China)
Objective It is to observe the inhibitory action of pomegranate peel ellagic acid on human 4T1 breast cancer cell and its influence on immune function in breast tumor-bearing mice. Methods The growth inhibition rate of pomegranate peel ellagic acid on 4T1 cell cultured in vitro was detected; the tumor cell apoptotic ratio was measured by flow cytometry; the changes of NK, LAK, CTL activity in spleen lymphocytes and serum TNF of tumor-bearing mice were detected after treated by pomegranate peel ellagic acid, and compared with the control group. Results The growth and formation of 4T1 cells were inhibited by pomegranate peel ellagic acid. Flow cytometry showed that pomegranate peel ellagic acid could induce apoptosis effectively. Pomegranate peel ellagic acid low-dose and high-dose groups could significantly enhance the induction of tumor-bearing mouse spleen lymphocytes NK, LAK and CTL activity, and the serum TNF levels were significantly increased, there were significant difference compared with the saline group or DDP group (P<0.05). There was no significant difference between pomegranate peel ellagic acid low-dose and high-dose groups (P>0.05). Conclusion Pomegranate peel ellagic acid can inhibit the proliferation and induce apoptosis in 4T1 cells. Pomegranate peel ellagic acid can significantly improve tumor-bearing mice induce specific anti-tumor immune response.
pomegranate peel ellagic acid; breast cancer; mouse; immune function
张玉梅,女,副主任医师,主要从事肿瘤内科临床研究工作。
王家晓,Tel:13005900116,E-mail:zhzm09@163.com
广西自然科学基金项目(2010GXNSFA013213);广西青年基金项目(2011GXNSFB018104);广西中医药大学院级重点课题(2D2009003);广西中医药大学院级课题(P2009129)
10.3969/j.issn.1008-8849.2014.15.001
R-332
A
1008-8849(2014)15-1597-04
2013-12-10

