柑橘黄龙病防控药剂筛选试验初报
陈仕钦, 卢小林,陈玉龙,吴 东,杨必赛,王中康*
(1.重庆大学生命科学学院,重庆 400030; 2.亚洲果业广西利添生物科技发展有限公司,合浦 536128)
柑橘黄龙病防控药剂筛选试验初报
陈仕钦1, 卢小林1,陈玉龙1,吴 东2,杨必赛2,王中康1*
(1.重庆大学生命科学学院,重庆 400030; 2.亚洲果业广西利添生物科技发展有限公司,合浦 536128)
为筛选有效防治罹病柑橘植株体内黄龙病菌的药剂,选取6种药剂进行韧皮部输液,利用实时定量PCR对病株体内带菌量进行动态监测以确定相对防效。结果表明,连续施药8个月后,硫酸铜、布罗波尔处理组和对照组带菌量下降了20%~30%,2,2-二溴-3-次氮基丙酰胺、异噻唑啉酮以及氨苄青霉素带菌量减少了80%以上;ZnSO4处理带菌量下降了65.60%。各观察期内相对防效都超过50%的药剂有2,2-二溴-3-次氮基丙酰胺(≥50%)和氨苄青霉素(≥70%)。相对防效分析表明,施药后8个月1g/L 2,2-二溴-3-次氮基丙酰胺、异噻唑啉酮、氨苄青霉素相对防效分别达到了89.75%、83.72%和87.27%,初步判断这3种药剂对黄龙病病树有防控效果。
黄龙病; 韧皮部; 2,2-二溴-3-次氮基丙酰胺; 异噻唑啉酮; 氨苄青霉素
柑橘黄龙病(Citrus Huanglongbing,HLB)是世界范围流行的毁灭性柑橘病害,严重制约柑橘产业的健康发展,各柑橘主产国都将其列为重大植物检疫性对象。近年来,柑橘黄龙病的传播范围越来越广,危害程度也随之加剧,难以根除。该病害现已在亚洲、非洲、大洋洲、南美洲和北美洲的50多个国家和地区广泛分布[1-2]。中国的19个柑橘栽培省、区中已有11个遭受黄龙病危害,受害面积占柑橘栽培总面积的80%以上[3]。
该病病原亚洲种柑橘黄龙病菌(CandidatusLiberibacter asiaticus,Las)属α-变形菌纲(Alpha-proteobacterial),是一种限于寄主韧皮部筛管细胞内生活的革兰氏阴性细菌。目前,黄龙病菌虽有成功纯培养的报告[4],但尚未通过柯赫氏鉴定和重复性验证,因此筛选防治药剂的工作进行迟缓。由于缺乏有效的杀菌剂和抗病品种,挖除病树、加强检疫、防控木虱是目前最主要的柑橘黄龙病防控措施[5-6]。基于柑橘寄主内黄龙病病原菌防控药剂的筛选工作也在陆续进行[7-8],针对黄龙病的特效药剂尚待研究和开发。为此,笔者开展了黄龙病防控药剂的田间防效试验。
1 材料与方法
1.1 试验条件
防治对象:柑橘黄龙病亚洲韧皮杆菌(Ca.Liberibacter asiaticus)。
供试品种:‘奥林达’夏橙6年生结果树,供试植株为黄龙病植株(qPCR检测为阳性),健康植株作为qPCR检测阴性对照。
试验地点:广西壮族自治区合浦县商业柑橘种植园。
试验时间:2012年3月—2012年11月。
1.2 供试药剂
硫酸铜(CuSO4),市售分析纯化学铜基试剂;硫酸锌(ZnSO4),市售分析纯化学纯锌基试剂;杀生剂布罗波尔(bronopol),醇溶性白色粉末;2,2-二溴-3-次氮基丙酰胺(DBNPA),醇溶性白色粉末,均购自山东润鑫精细化工有限公司;16%异噻唑啉酮(isothiazolin-ketone,Isothz),母液为黄色液体;氨苄青霉素(ampicillin),市售医用抗生素。
1.3 试验方案
在树干或主枝基部捆绑滴药针头,植株上部悬挂塑料药瓶,处理组分别装入HLB防控药液硫酸铜、硫酸锌、布罗波尔、DBNPA、异噻唑啉酮、氨苄青霉素,剂量均为1g/L,对照植株输以等量清水;药液传送滴管采用一次性医用输液器(配针规格:0.8 mm×28 mm,山东康利莱医疗器材有限公司),药液从韧皮部注射输入树体。供试柑橘植株视树体情况输液300~600mL,每处理重复3株成年结果树,试验病树总共21株,21个小区,试验随机区组设计。施药后检查并调整药液滴注速度,用输液管上流速调节阀控制滴注速度,以每分钟1滴为宜;滴注速度不宜过快,流出基部树干针头包埋点为宜。试验区辅以正常的水肥(叶面肥和根肥)管理和农药(主要防治柑橘木虱)防治措施。处理组和非处理组保持水肥、施药一致。
从3月21日开始施药,此后施药时间是4月25日、5月29日、6月26日、8月15日、9月20日。每次施药前采集疑似黄龙病植株叶片样品,在柑橘黄龙病病树树冠东南西北中五个方位采集斑驳黄化叶片,每采集点取中下部的成熟叶片各4~5片,每棵树共采集20~25片叶,采集过程避免样品之间交叉污染。采集的样品立即送至实验室处理或暂时保存到4 ℃条件下。
1.4 DNA的提取及qPCR检测分析
撕取叶片样品的中脉,液氮研磨成粉末(约200mg),根据天根公司质粒小提试剂盒提取DNA的方案提取柑橘叶片中脉样品DNA。本研究应用Wang[9]等在2006年建立的SYBR Green Ⅰ荧光染料法(SGI-qPCR)检测平台,引物对CQULA04F/CQULA04是根据柑橘黄龙病亚洲韧皮杆菌(Las)的核糖体蛋白基因rplJ/rplL(GenBank编号为M94319)特异性靶序列设计的引物,由上海生物工程公司合成,扩增片段大小为87 bp,为单拷贝片段[10-11]。
SYBR GreenⅠ荧光定量PCR 25 μL的反应体系含有终浓度为1× SYBR Green Ⅰ定量IQ SYBR Green Supermix (Bio-Rad,USA)、0.75 μmol/L的引物对CQULA04F/CQULA04R以及2 μL模板。在CFX96C1000Thermal Cycler(Bio-Rad)荧光定量PCR仪上进行SGI-qPCR检测,预扩增95 ℃,1min;95 ℃变性,15 s,59 ℃退火,15 s,72 ℃延伸,20s,41个循环;在每个循环的延伸阶段设置同步多次采集荧光。为验证扩增的特异性,在扩增完成后立即进行熔解曲线的分析,反应程序为:95 ℃,30s;55 ℃,30s;从55 ℃开始每升高0.5 ℃保持1s,连续升高80次(到95 ℃为止)。
由SGI-qPCR检测分析得到的Ct值通过符合本试验条件的通用回归方程Y=-0.288X+11.61转换为拷贝数,因变量Y代表样品模板浓度(每个反应管中初始DNA拷贝数,Copy Number/g.c.t,CN/g.c.t)对数的估计值,自变量X代表测得的Ct值[9-11]。每反应管初始模板为2 μL,取自于母液(30μL),母液DNA提取自200mg的柑橘叶片中脉组织,故每克叶片中脉组织中目的片段拷贝数或带菌量,为上述换算所得拷贝数估计值的75倍。依此建立适合本研究的带菌量换算方程(1.1):
CN=75×10-0.288X+11.61
式中:
CN=黄龙病病树每克组织带菌量 (拷贝数,copy number/g,CN/g);
X= 本反应体系测得的Ct值。
按照以上算法,阴性对照判定标准为Ct值>35,就相当于阴性样品每克组织中的DNA拷贝数或带菌量小于 2 450CN/g。
1.5 药剂防效评测方法
施药期间观察树势及药害发生情况,并根据处理区和对照区的HLB带菌率差异计算相对防效。利用SPSS数据处理软件对各处理重复小区的田间相对防效进行邓肯氏新复极差多重比较(one-way ANOVA/Duncan test)。根据以下公式计算HLB带菌量减退率及相对防效百分率。
HLB带菌量减退率(%)=

相对防效(%)=

2 结果与分析
2.1 不同药剂输液处理对柑橘植株体内带菌量的影响
对黄龙病染病植株进行连续8个月的树体药剂输液,每次施药前采集叶片进行实时荧光定量PCR连续监测。结果显示各药剂连续处理8个月后,病树黄龙病带菌量均有下降,但带菌量变化趋势不同(图1)。从初次施药(3月21日)到11月底,DBNPA、异噻唑啉酮以及氨苄青霉素药剂处理的植株黄龙病菌数量呈现减少的趋势,带菌量较基期减少了80%以上。而CuSO4、ZnSO4、布罗波尔(bronopol)和清水(CK)处理的病株带菌量在施药期间呈现起伏状态,前3个月都呈一定的下降趋势,到了第5、6月带菌量呈增长趋势,此期之后ZnSO4和CK组带菌量又明显降低。施药后8个月连续每月取样测试柑橘植株体内的带菌数量动态, ZnSO4处理组带菌量下降了65.60%,表明对病害有一定的抑制作用。而CuSO4、Bronopol处理组及对照组,带菌量仅下降20%~30%。
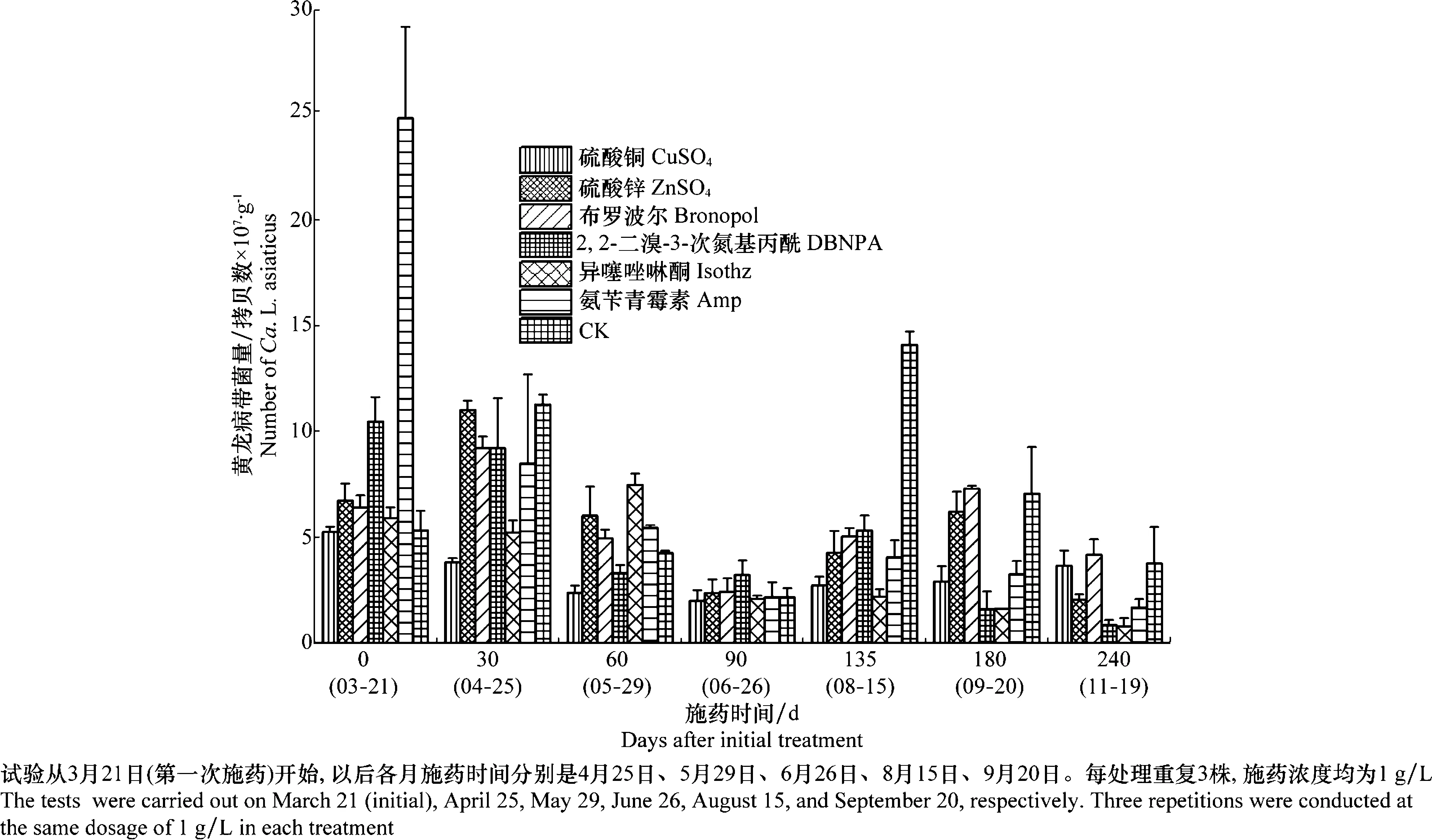
图1 不同药剂韧皮部输液处理前后柑橘植株体内带菌量变化趋势Fig.1 The monitoring dynamics of bacterial titers of HLB-affected citrus plants phloem-injected with six different chemicals in the field
对照组及所有处理组在施药后第3个月(6月26日)带菌量都达到低谷,而之后各处理带菌量呈现不同增长。各处理组带菌量高峰期集中在第2次施药之前(3月下旬到4月25日),而对照组带菌量两次高峰则出现在第2次施药之前(4月25日)以及施药后第4.5个月(8月15日)。
2.2 不同药剂输液处理对黄龙病的防治效果
6种药剂对黄龙病的相对防效变化情况见图2,根据HLB防控动态检测结果,各观察期内氨苄青霉素相对防效均≥70%,DBNPA相对防效超过50%;8个月后相对防效在50%~ 80%的药剂处理有4个,其余处理小于50%。
从各月防治效果情况来看,施药一个月后并不能达到最佳的控病效果,异噻唑啉酮在施药后第3个月后才能达到比较高且稳定的防效。施药后第3个月、第4、5个月以及第6个月,各药剂处理相对防效都超过50%。其中,施药后第4~5个月(5月29日)各处理相对防效都超过70%。
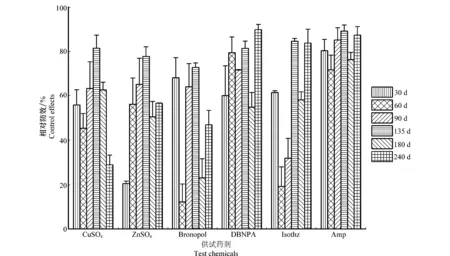
图2 六种药剂韧皮部输液处理后对柑橘黄龙病树体内带菌量的相对防效变化情况Fig.2 The change in the control effects of six different chemical compounds against HLB-affected citrus plants by phloem-injection in 8 months
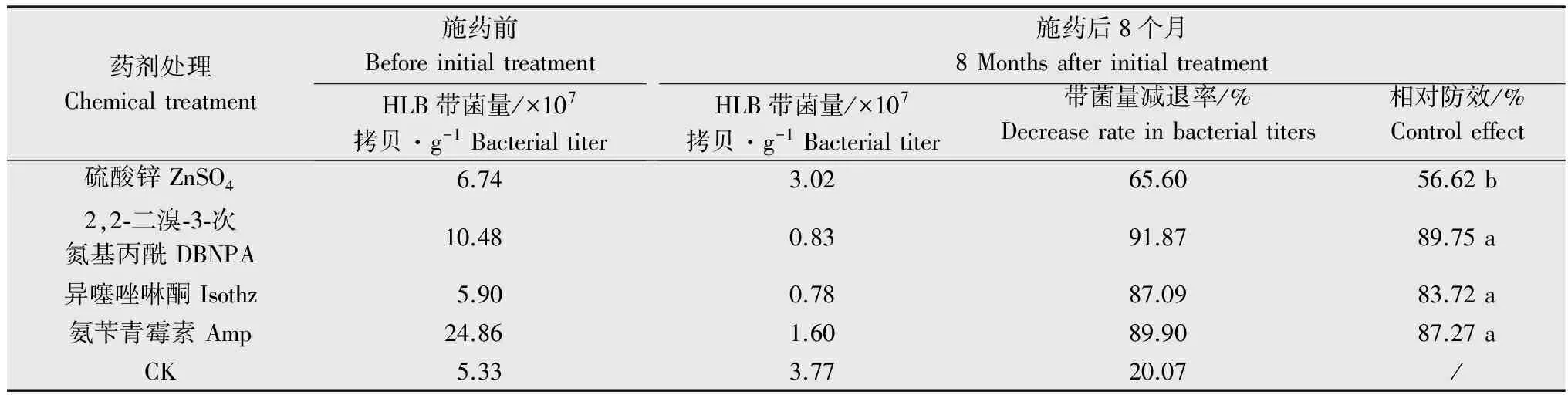
表1 四种药剂对柑橘黄龙病韧皮部输液的防效结果1)Table 1 The control effects of four different chemicals against HLB by phloem-injection treatment
1) 表中所列数据都是3个重复处理的平均值。处理间数据标注不同小写字母表示差异显著(P<0.05,Duncan test)。 All data in the table are the average for three repetitions.The data followed by different letters at the same column indicate significant differences among different treatments at 5% level (one-way ANOVA/Duncan test).
2.3 田间症状观察
连续间隔施药8个月后,柑橘植株都未发现明显的症状消退,叶片斑驳、黄化、黄梢与大小果为主要表现病症。由于注射器针管的直接接触和药液的持续性输入,6种不同药剂施药后,施药部位的韧皮组织均呈现不同程度的物理性伤口和生理性病害,包括流胶、腐蚀腐烂和真菌、昆虫的侵染,但随着病树的自身防御系统的启动,注药伤口会在1~2个月后得到修复。在各药剂1g/L处理浓度下,观察期内树体除了黄龙病症外,生长均无异常,没有出现系统性的药害。
3 结论与讨论
从3月到11月的带菌量变化(图1)可以看出,对照组在3-5月以及8-9月有较高的带菌量,这可能是自然条件下柑橘体内叶脉带菌量受到气候等因素影响的结果。各处理组带菌量也存在类似的趋势,只是变化幅度存在差异,可能原因是不同药剂在试验浓度下对树体叶脉带菌量抑制下限不同,且各处理药效发挥时间、持效作用或存在差异。
韧皮部输液筛选出的几种杀菌剂,树体输液处理8个月后1g/L的DBNPA、异噻唑啉酮、氨苄青霉素相对防效分别达到了89.75%、83.72%和87.27%,对黄龙病有明显的抑制效果。本研究中使用1g/L氨苄青霉素作为处理对照,对黄龙病相对防效可以达到80%以上,但抗生素只能暂时缓解黄龙病的病状[7]。通过加压注射四环素可使病树树势得以恢复,延长病树结果年限可达5~6年,但四环素不能完全防治黄龙病,且病源可能会传播蔓延[12]。四环素注射的病树在初期易引起叶片焦枯、叶脉褐化与大量落叶等暂时性药害,但半年内树体可恢复生长,此法适用于发病早期的治疗[13]。Muqing等人[14]的研究表明:5 g青霉素和0.5 g的四环素同时施用能有效控制黄龙病,降低药害同时减少抗药性,在生产上的应用价值尚待商榷。抗生素施用于农田生态系统,主要进入土壤及地表水、地下水环境,并通过作物吸收和积累进入食物链,同时致病菌因抗生素的频繁施用而诱导产生的抗药性基因也随之扩散,对动物和人体健康构成潜在危害[15],因此抗生素在生产上并非理想的黄龙病防控药剂,不建议推广应用。由于抗生素如氨苄青霉素、四环素等对黄龙病防控速效性较高,在防控药剂筛选试验中可作为供试试剂的参照药剂。氨苄青霉素在各施药期间的相对防效都可达70%以上,DBNPA次之(达50%以上),初期防效和防效稳定性都高于异噻唑啉酮。DBNPA和异噻唑啉酮在施药8个月后控病效果与氨苄青霉素无显著性差异,且是两种环保型的杀菌剂,对黄龙病的防控作用可以作进一步的药效评估。
以韧皮部输液进行黄龙病防控药剂筛选,其优势在于药剂可直接作用于韧皮部的黄龙病菌,同时减少了药剂对生态环境的污染。但是药剂在韧皮部向树体其他组织输导的方向和能力不尽相同[16],仅仅依靠叶脉组织带菌量的变化评价防效只能初步判断筛选药剂是否有效,而整体防治效果还需对施药后的病症变化情况进行观察评估。通过8个月的带菌量监测,DBNPA、异噻唑啉酮和氨苄青霉素处理的相对防效达到90%,但病症改善不明显。因此,根据带菌量变化及相对防效分析,初步筛选出这几种药剂对黄龙病具有防控效果。
[1] Bové J M.Huanglongbing: A destructive,newly-emerging,century-old disease of citrus[J].Journal of Plant Pathology,2006,88: 7-37.
[2] Gottwald T R.Current epidemiological understanding of citrus Huanglongbing[J].Annual Review of Phytopathology,2010,48: 119-139.
[3] 范国成,刘波,吴如健.中国柑橘黄龙病研究30年[J].福建农业学报,2009,24(2): 183-190.
[4] Sechler A,Schuenzel E L,Cooke P,et al.Cultivation of ‘CandidatusLiberibacter asiaticus’,‘Ca.L.africanus’,and ‘Ca.L.americanus’ associated with Huanglongbing[J].Phytopathology,2009,99: 480-486.
[5] do Carmo Teixeira D,Luc Danet J,Eveillard S,et al.Citrus huanglongbing in São Paulo State,Brazil: PCR detection of the ‘Candidatus’ Liberibacter species associated with the disease[J].Molecular and Cellular Probes,2005,19(3): 173-179.
[6] 吴如健,柯冲.柑桔黄龙病治理试验及综合防治措施[J].江西农业学报,2007,19(9): 69-71.
[7] 柯冲,王芝生.应用抗生素防治柑桔黄龙病的研究[J].福建省农科院学报,1988,3(1): 1-11.
[8] Zhang M Q,Duan Y P,Zhou L J,et al.Screening molecules for control of Citrus Huanglongbing using an optimized regeneration system for ‘CandidatusLiberibacter asiaticus’-infected Periwinkle (Catharanthusroseus) cuttings[J].Phytopathology,2010,100: 239-245.
[9] Wang Z K,Yin Y P,Hu H,et al.Development and application of molecular-based diagnosis for ‘CandidatusLiberibacter asiaticus’,the causal pathogen of citrus huanglongbing[J].Plant Pathology,2006,55(5): 630-638.
[10]Li W B,Li D Y,Twieg E,et al.Optimized quantification of unculturableCandidatusLiberibacter spp.in host plants using real-time PCR[J].Plant Disease,2008,92: 854-861.
[11]Kim J,Wang N.Characterization of copy numbers of 16S rDNA and 16S rRNA ofCandidatusLiberibacter asiaticus and the implication in detection in planta using quantitative PCR[J].BMC Research Notes,2009,2(1): 37.
[12]龙钦贤,庄贤兰,邱柱石,等.加压注射四环素族抗生素治疗甜橙黄龙病树的效果[J].中国柑桔,1981(1): 29-32.
[13]苏鸿基,蔡佳欣,冯雅智,等.柑橘黄龙病之研究及健康管理[C]∥近年来我国重大作物病害之发生及其诊断、监测与防治研讨会专刊,农业试验所特刊第149号,2010: 33-61.
[14]Zhang M Q,Powell C A,Zhou L J,et al.Chemical compounds effective against the citrus Huanglongbing bacterium ‘CandidatusLiberibacter asiaticus’ in planta[J].Phytopathology,2011,101(9): 1097-1103.
[15]周启星,罗义,王美娥,等.抗生素的环境残留、生态毒性及抗性基因污染[J].生态毒理学报,2007,2(3): 243-250.
[16] Edgington L V,张少铭.内吸性杀菌剂结构上的必要条件[J].世界农药,1983(1): 2-8.
PreliminaryreportonscreeningofchemicalcompoundsagainstthecitrusHuanglongbingbacteriumCandidatusLiberibacterasiaticusincitrusplants
Chen Shiqin1, Lu Xiaolin1, Chen Yulong1, Wu Dong2, Yang Bisai2, Wang Zhongkang1
(1.CollegeofLifeSciences,ChongqingUniversity,Chongqing400030,China;2.LuckyTeamBiotechDevelopment(Hepu)Ltd.,Co.,Guangxi536128,China)
In order to screen effective chemical compounds against the citrus Huanglongbing (HLB) bacteriumCandidatusLiberibacter asiaticus in citrus plants,6chemical compounds were injected into phloem.HLB bacterial titers were dynamically measured by real-time quantitative PCR to determine the control effect.The results showed that,after eight months of continuous injection,the bacterial titers of copper sulfate,bronopol and the control dropped by 20%-30% versus a 65.60% decline in ZnSO4treatment,while 2,2-dibromo-3-nitrilopropionamide (DBNPA),isothiazolin-ketone and ampicillin achieved more than 80% decrease of bacterial titers.The control effects all reached more than 50% by both treatments of DBNPA (≥ 50%) and ampicillin (≥ 70%) during each observation period over eight months.The control efficiency analysis demonstrated that the control effects of DBNPA,isothiazolin-ketone and ampicillin were 89.75%,83.72% and 87.27%,respectively,at the same dosage of 1g/L after eight months of initial treatment.This preliminary study indicated that these three chemical compounds suppressed theCaL.asiaticus in HLB-affected citrus plants.
Huanglongbing; phloem; 2,2-dibromo-3-nitrilopropionamide; isothiazolin-ketone; ampicillin
2013-05-07
:2013-06-21
公益性行业(农业)科研专项(201003067);中央高校基本科研业务费专项资金 (CDJXS112300)
S 482.2,S 436.661
:BDOI:10.3969/j.issn.0529-1542.2014.02.033
* 通信作者 Tel:023-65120489;E-mail: w-zk@163.com

