二甲双胍对肺腺癌耐厄洛替尼细胞株A549ER的耐药逆转作用
杨 翠 徐 瑜 胡义德
二甲双胍对肺腺癌耐厄洛替尼细胞株A549ER的耐药逆转作用
杨 翠1徐 瑜2胡义德1
目的探讨二甲双胍对人肺腺癌耐厄洛替尼细胞株A549ER的耐药逆转作用。方法将人肺腺癌细胞株A549细胞设为亲本组;将耐厄洛替尼细胞株A549ER细胞分为空白对照组、厄洛替尼组、二甲双胍组和联合用药组(厄洛替尼+二甲双胍组),采用CCK8法检测不同浓度药物作用下各组细胞的50%抑制浓度(IC50),计算耐药倍数和逆转倍数。采用流式细胞术检测各组A549ER细胞的凋亡率和细胞周期,计算增殖指数。结果在0~20 mmol/L浓度范围内,二甲双胍对A549细胞及A549ER细胞均有生长抑制作用,抑制率随二甲双胍浓度升高而增加。厄洛替尼对A549细胞和A549ER的IC50分别为15.15 μmol/L和118.8 μmol/L,A549ER的耐药倍数为7.84。联合用药组A549ER细胞IC50为73.55 μmol/L,耐药倍数为4.85。二甲双胍对A549ER厄洛替尼耐药性的逆转倍数为1.62。空白对照组、厄洛替尼组、二甲双胍组和联合用药组的凋亡率分别为(5.53±3.00)%、(7.51±3.73)%、(10.25±4.23)%和(16.92±1.20)%。根据细胞周期结果计算空白对照组、厄洛替尼组、二甲双胍组和联合用药组的增殖指数分别为0.84±0.15、0.78±0.10、0.73±0.08和0.60±0.09。结论A549ER细胞较A549细胞对厄洛替尼有明显的耐药性;二甲双胍对A549ER细胞厄洛替尼的耐药性具有逆转作用;二甲双胍通过抑制细胞生长、促进细胞凋亡、减缓细胞周期进程等途径逆转A549ER细胞耐药。
腺癌,肺; 二甲双胍; 厄洛替尼; 耐药; 逆转
肺癌是最常见的恶性肿瘤之一,也是目前癌症相关死亡的主要原因之一[1-2]。近年来,靶向治疗药物如表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)厄洛替尼等在肺癌的治疗中取得了良好的效果,甚至被推荐作为一线治疗药物使用[3-5]。然而,部分患者在治疗过程中逐渐产生耐药直接影响后期的治疗效果[6]。二甲双胍是一种胰岛素增敏剂,被广泛用于2型糖尿病的治疗。但最近的研究表明,二甲双胍能抑制肿瘤细胞的增殖,增强化疗药物的敏感性[7]。本研究拟探讨联合使用二甲双胍是否能逆转耐厄洛替尼肺癌细胞株对厄洛替尼的耐药性。
材料与方法
一、实验材料
1.细胞株:人肺腺癌 A549细胞株及耐厄洛替尼细胞株A549ER由第三军医大学新桥医院全军肿瘤研究所提供[8]。
2.药品与试剂:厄洛替尼为南京安格医药化工有限公司产品;二甲双胍为sigma公司产品;RPMI1640培养基和青霉素链霉素溶液-双抗均为Hyclone公司产品;胎牛血清为Gibco公司产品;CCK-8为广州奕源生物科技有限公司产品;细胞凋亡试剂盒和细胞周期试剂盒均为BD公司产品。
二、实验方法
1.细胞培养:A549细胞培养在含10%胎牛血清的RPMI1640培养基中。A549ER细胞培养在含10%胎牛血清、25 μmol/L厄洛替尼(维持浓度)的RPMI1640培养基中。细胞置于37 ℃、 5% CO2培养箱中培养。培养基变黄换液,细胞铺满培养瓶底90%以上时0.25%胰酶消化传代。取对数生长期细胞为实验对象。
2.细胞分组:将培养在普通血清培养基中的A549细胞设为亲本组。将A549ER细胞分为空白对照组、厄洛替尼组、二甲双胍组和联合用药组,分别给予不含药物的血清培养基、含25 μmol/L厄洛替尼的血清培养基、含5 mmol/L二甲双胍的血清培养基、含25 μmol/L厄洛替尼和5 mmol/L二甲双胍的血清培养基培养。
3. CCK-8法检测二甲双胍对A549和A549ER的生长抑制作用:0.25%胰酶消化、血清培养基重悬A549细胞及A549ER细胞并计数,分别按5000个/孔接种于96孔板,置于37 ℃、 5% CO2培养箱中培养。12 h后细胞贴壁,吸除孔内培养液,分别加入含不同浓度二甲双胍 (1 mmol/L, 2.5 mmol/L, 5 mmol/L, 7.5 mmol/L, 10 mmol/L, 12.5 mmol/L, 15 mmol/L, 20 mmol/L) 的血清培养基,同时设置空白孔(仅有培养基,无细胞)和对照孔(仅有培养基和细胞,未加药),每组设置4个复孔。置于37 ℃、 5% CO2培养箱中继续培养48 h。48 h后吸除孔内培养液,分别加入100 μl血清培养基和10 μl CCK8,置于37 ℃、 5% CO2培养箱中继续培养3 h。酶标仪测定450 nm处各孔吸光度。按公式计算抑制率。
抑制率=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%
4. CCK-8法检测厄洛替尼对亲本组A549细胞、厄洛替尼组A549ER细胞及联合用药组A549ER细胞的IC50:消化、血清培养基重悬各组细胞并计数,按5000个/孔接种于96孔板,培养箱中继续培养。12 h后细胞贴壁,吸除孔内培养液,分别加入含不同浓度厄洛替尼 (0.01 μmol/L, 0.1 μmol/L, 1 μmol/L, 10 μmol/L, 100 μmol/L) 的血清培养基,同时设置空白孔(有培养基,无细胞)和对照孔(仅有培养基和细胞,未加药),每组设置5个复孔。置于37 ℃、 5% CO2培养箱中继续培养48 h。48 h后吸除孔内培养液,分别加入100 μl血清培养基和10 μl CCK8,置于37 ℃、5% CO2培养箱中继续培养3 h。酶标仪测定450 nm处各孔吸光度。根据公式计算相应的细胞生长抑制率,计算出IC50、耐药倍数和逆转倍数。
耐药倍数=耐药细胞株IC50/亲本细胞株IC50
逆转倍数=使用逆转剂前IC50/使用逆转剂后IC50
5. 流式细胞术检测各组A549ER细胞周期:消化收集各组细胞,PBS洗涤2次,加入预冷处理的70%乙醇溶液4 ℃固定过夜,PBS洗涤除去乙醇,加PI染液(终浓度为50 μg/ml,含50 μg/ml RNase)在室温避光条件下孵育30 min。流式细胞仪检测细胞周期。按公式计算细胞增殖指数。
增殖指数=(S期百分比+G2/M期百分比)/(G0/G1期百分比)
6. 流式细胞术检测各组A549ER细胞凋亡率:消化收集各组细胞,预冷的PBS洗涤2次,PBS重悬并计数细胞,使100 μl悬液中含约5×105个细胞,离心弃上清,加入400μl 1×Annexin V Binding Buffer悬浮细胞,加入5 μl的Annexin V-FITC混匀后,避光室温孵育10 min。加入5 μl Propidium Iodide染色,避光室温孵育5 min。流式细胞仪检测细胞凋亡率。
三、统计学方法
结 果
一、二甲双胍对A549细胞和A549ER细胞的生长抑制作用
在0至20 mmol/L浓度范围内,二甲双胍对A549细胞及A549ER细胞均有生长抑制作用,抑制率随二甲双胍浓度升高而增加。当浓度≤5 mmol/L时,二甲双胍对A549细胞和A549ER细胞的抑制率无差异;当浓度>5 mmol/L时,二甲双胍对A549ER细胞的抑制率高于A549细胞(P<0.01),见表1,图1。
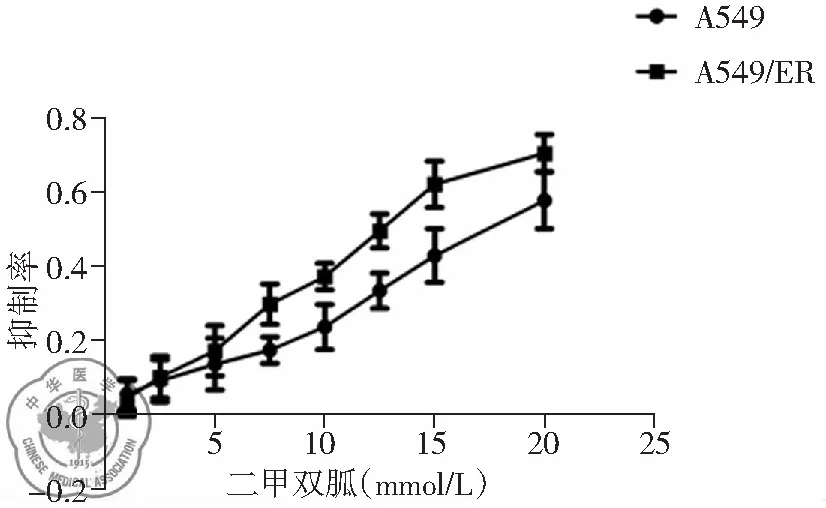
图1 二甲双胍对A549细胞和A549ER细胞的抑制曲线
二、厄洛替尼对各组细胞的抑制作用
不同浓度厄洛替尼对亲本组A549细胞、厄洛替尼组A549ER细胞及联合用药组A549ER细胞的抑制率见表2。根据GraphPad.Prism.v5.01软件计算亲本组A549细胞IC50为15.15 μmol/L,厄洛替尼组A549ER细胞IC50为118.8 μmol/L,联合用药组A549ER细胞IC50为73.55 μmol/L。根据公式计算厄洛替尼组A549ER细胞对厄洛替尼的耐药倍数为7.84,联合用药组A549ER细胞对厄洛替尼的耐药倍数为4.85。二甲双胍对A549ER细胞对厄洛替尼耐药性的逆转倍数为1.62。
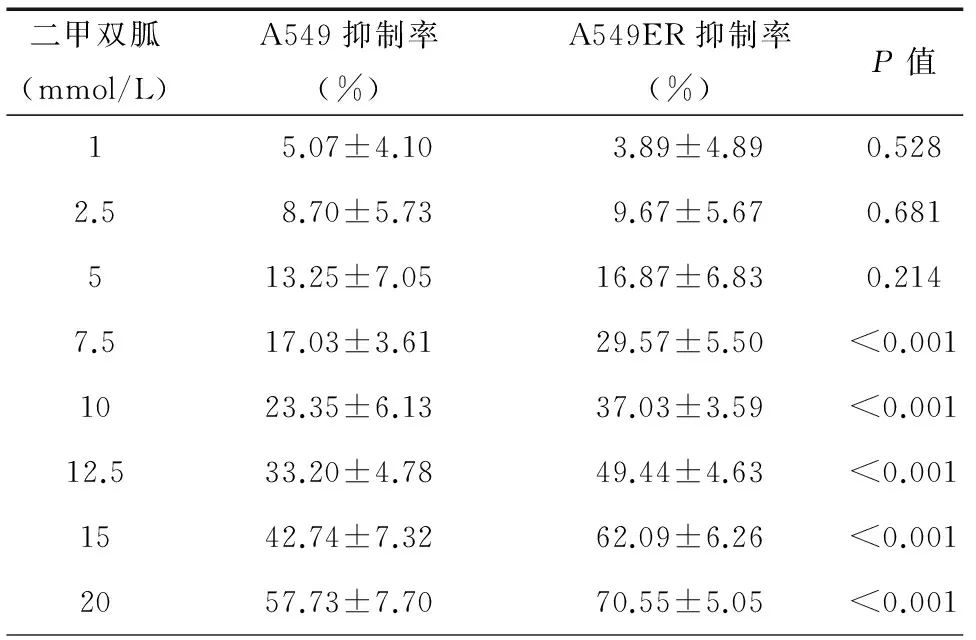
表1 二甲双胍对A549细胞和A549ER细胞的抑制率

表2 CCK8法检测不同浓度厄洛替尼对各组细胞的抑制率
三、各组A549ER细胞周期结果及增殖指数
流式细胞术检测各组A549ER细胞周期结果如表3所示。根据细胞周期结果计算空白对照组、厄洛替尼组、二甲双胍组和联合用药组的增殖指数分别为0.84±0.15、0.78±0.10、0.73±0.08和0.60±0.09。联合用药组增殖指数较其他三组均降低,但仅与空白对照组的差异有统计学意义(P<0.05)。
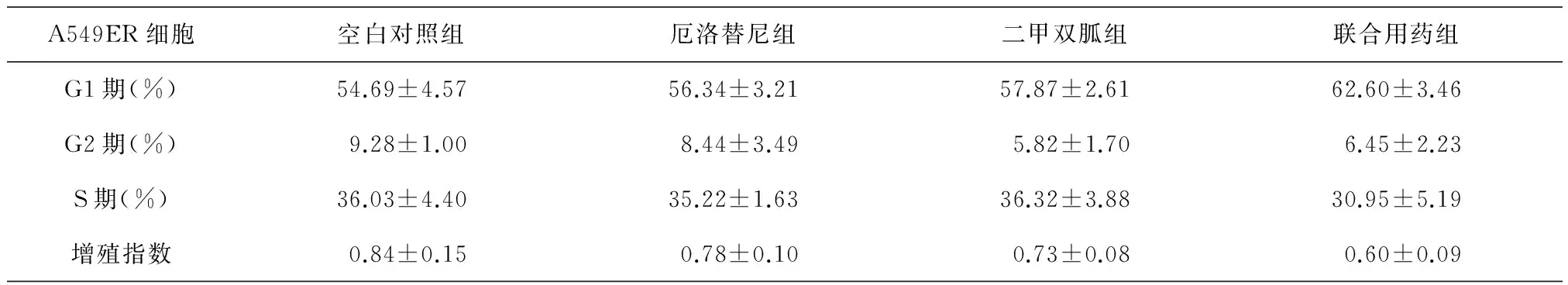
表3 各组A549ER细胞周期结果及增殖指数
四、各组A549ER细胞凋亡率
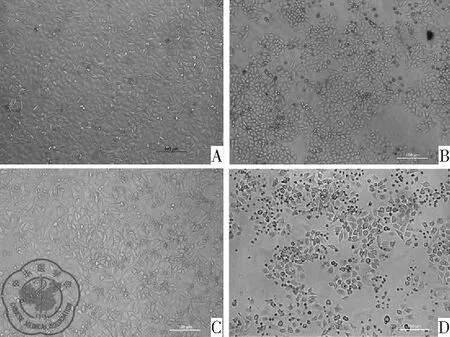
流式细胞术检测空白对照组、厄洛替尼组、二甲双胍组和联合用药组的凋亡率分别为(5.53±3.00)%、(7.51±3.73)%、(10.25±4.23)%和(16.92±1.20)%。联合用药组凋亡率较其他三组均显著升高(P<0.01、P<0.01、P<0.05),见图2。
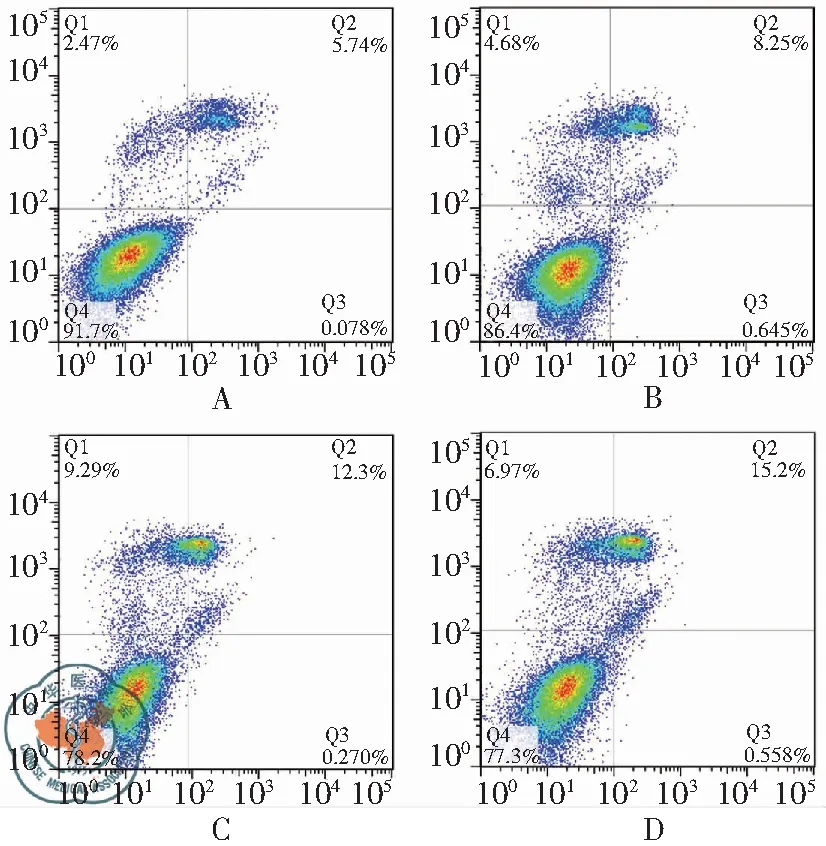
注:A:空白对照组;B:厄洛替尼组;C:二甲双胍组;D:联合用药组
讨 论
靶向治疗为肺癌的治疗提供了新的方法。厄洛替尼作为主要的靶向治疗药物之一,被越来越广泛地应用于肺癌的治疗中并取得了良好的治疗效果[9]。然而,耐药的产生成为影响厄洛替尼治疗效果的重要因素,对厄洛替尼耐药机制的研究成为了新的热点[6]。最新研究表明,在肺癌中特定miRNA能够调节Axl介导的EGFR-TKI耐药性[10]。另一项研究也表明,在非小细胞肺癌中改变miR-21/PTEN的表达能够调节肺癌细胞对EGFR-TKI的耐药性[11]。而在小细胞肺癌中,miR-200b能够通过调节ZEB2来调整多药耐药性[12]。对于本研究所采用的A549肺腺癌细胞,研究显示核糖体蛋白l39-L可能在细胞耐药机制中发挥重要作用[13]。
近年来二甲双胍被发现能抑制肿瘤细胞的增殖,增强化疗药物的敏感性,这提示二甲双胍可能将在肺癌的预防、治疗中发挥重要作用[7]。因此,研究二甲双胍能否逆转厄洛替尼耐药性具有重要的临床价值。
本实验采用CCK8法检测二甲双胍对人肺腺癌细胞株A549及耐厄洛替尼细胞株A549ER的生长抑制作用。发现二甲双胍对两株细胞均有明显的生长抑制作用,且当二甲双胍浓度不超过5 mmol/L时,二甲双胍对两株细胞的生长抑制率无显著差异。结合之前的文献报道,我们选择5 mmol/L的二甲双胍浓度进行后续实验[14]。
CCK8法测得A549与A549ER细胞对厄洛替尼的IC50分别为15.15 μmol/L和118.8 μmol/L,与之前的文献报道基本一致[8]。我们先将A549ER细胞在含厄洛替尼和二甲双胍的培养基中培养,然后再采用CCK8法测定A549ER细胞对厄洛替尼的IC50,新的IC50为73.55 μmol/L,较前降低,利用公式计算得到的耐药倍数也较使用二甲双胍前明显降低,A549ER细胞对厄洛替尼的耐药性明显逆转,逆转倍数为1.62。在我们的实验方案中,先将A549ER细胞在含二甲双胍和厄洛替尼的培养基中培养,再使用仅含有不同浓度厄洛替尼的培养基测定IC50。这样新测得的IC50就排除了联合二甲双胍协同抑制作用的影响。得到的结果更加能说明二甲双胍对厄洛替尼耐药性的逆转作用。
我们的实验结果提示二甲双胍联合化疗后能提高A549ER细胞G0/G1期比例,这与文献报道相一致[15-16],见图3。且依据细胞周期结果计算得到的增殖指数也明显降低,提示二甲双胍联合化疗能抑制细胞增殖生长,也与之前的几项报道相一致[14-17]。采用流式细胞术测定细胞凋亡发现经二甲双胍联合化疗处理的A549ER细胞凋亡率明显升高,这在之前的文献中也见有报道[15-16]。有研究报道二甲双胍可能是通过激活JNK/p38 MAPK通路和GADD153基因来诱导肺癌细胞凋亡的[18]。通过我们的研究证实二甲双胍对肺腺癌耐厄洛替尼细胞株的耐药性具有逆转作用,可能正是通过抑制细胞生长、促进细胞凋亡、减缓细胞周期进程和抑制细胞增殖等途径起到发挥逆转耐药性的作用。二甲双胍联合化疗可能是延缓或逆转肿瘤化疗药物耐药性的有效手段。
注:A:空白对照组;B:厄洛替尼组;C:二甲双胍组;D:联合用药组
1 李 羲, 钱桂生. 肺癌临床的罕见表现[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(1): 4-7.
2 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
3 D′Arcangelo M, Cappuzzo F. Erlotinib in the first-line treatment of non-small-cell lung cancer[J]. Expert Rev Anticancer Ther, 2013, 13(5): 523-533.
4 Nguyen KS, Neal JW. First-line treatment of EGFR-mutant non-small- cell lung cancer: the role of erlotinib and other tyrosine kinase inhibitors[J]. Biologics, 2012, 6: 337-345.
5 Tan BX, Yao WX, Ge J, et al. Prognostic influence of metformin as first-line chemotherapy for advanced nonsmall cell lung cancer in patients with type 2 diabetes[J]. Cancer, 2011, 117(22): 5103-5111.
6 Jackman D, Pao W, Riely GJ, et al. Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J]. J Clin Oncol, 2010, 28(2): 357-360.
7 Gallagher EJ, LeRoith D. Diabetes, cancer, and metformin: connections of metabolism and cell proliferation[J]. Ann N Y Acad Sci, 2011, 1243: 54-68.
8 徐 睿, 孙建国, 陈正堂. 自噬在A549肺腺癌细胞耐厄洛替尼中的作用研究[J]. 重庆医学, 2013, 42(12): 1324-1329.
9 Li W, Zhou F, Zhou C. Role of erlotinib in the targeted treatment of non-small-cell lung cancer in Chinese patients[J]. Onco Targets Ther, 2014, 7: 253-261.
10 Wang Y, Xia H, Zhuang Z, et al. Axl-altered microRNAs regulate tumorigenicity and gefitinib resistance in lung cancer[J]. Cell Death Dis, 2014, 5: e1227.
11 Shen H, Zhu F, Liu J, et al. Alteration in Mir-21/PTEN Expression Modulates Gefitinib Resistance in Non-Small Cell Lung Cancer[J]. PLoS One, 2014, 9(7): e103305.
12 Fang S, Zeng X, Zhu W, et al. Zinc finger E-box-binding homeobox 2 (ZEB2) regulated by miR-200b contributes to multi-drug resistance of small cell lung cancer[J]. Exp Mol Pathol, 2014, 96(3): 438-444.
13 Liu HS, Tan WB, Yang N, et al. Effects of ribosomal protein l39-L on the drug resistance mechanisms of lung cancer A549 cells[J]. Asian Pac J Cancer Prev, 2014, 15(7): 3093-3097.
14 Wang Y, Dai W, Chu X, et al. Metformin inhibits lung cancer cells proliferation through repressing microRNA-222[J]. Biotechnol Lett, 2013, 35(12): 2013-2019.
15 Ashinuma H, Takiguchi Y, Kitazono S, et al. Antiproliferative action of metformin in human lung cancer cell lines[J]. Oncol Rep, 2012, 28(1): 8-14.
16 Storozhuk Y, Hopmans SN, Sanli T, et al. Metformin inhibits growth and enhances radiation response of non-small cell lung cancer (NSCLC) through ATM and AMPK[J]. Br J Cancer, 2013, 108(10): 2021-2032.
17 Teixeira SF, Guimarǎes Idos S, Madeira KP, et al. Metformin synergistically enhances antiproliferative effects of cisplatin and etoposide in NCI-H460 humanlung cancer cells[J]. J Bras Pneumol, 2013, 39(6): 644-649.
18 Wu N, Gu C, Gu H, et al. Metformin induces apoptosis of lung cancer cells through activating JNK/p38 MAPK pathway and GADD153[J]. Neoplasma, 2011, 58(6): 482-490.
(本文编辑:王亚南)
杨 翠,徐 瑜,胡义德. 二甲双胍对肺腺癌耐厄洛替尼细胞株A549ER的耐药逆转作用[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(5): 507-511.
Metformin reverses the resistance of erlotinib-resistant human lung adenocarcinoma cell line A549ER in vitro
YangCui1,XuYu2,HuYide1
(1DepartmentofOncology,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;2InstituteofRespitationDiseases,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China)
HuYide,Email:huyide_mit@aliyun.com
Objective To detect the resistance reversal effects of metformin on erlotinib-resistant human lung adenocarcinoma cell line A549ER. Methods The human lung adenocarcinoma cell line A549 was defined as parental group. The erlotinib-resistant human lung adenocarcinoma cell line A549ER was set as blank group. A549ER treated with erlotinib alone was erlotinib group. A549ER treated metformin alone was metformin group. A549ER treated with erlotinib and metformin was combination group. The growth inhibitory effects of erlotinib on parental group A549 cell, erlotinib group A549ER cell and combination group A549ER cell were detected with CCK8 assay, and the half maximal inhibitory concentration (IC50), resistance index and reversal index were calculated. The cell cycle and cell apoptosis of blank group, erlotinib group, metformin group and combination group A549ER cell were detected with flow cytometry, and the proliferation index were calculated. Results The metformin inhibit growth of A549 and A549ER and the inhibition increased with increasing concentration. The IC50 of erlotinib on parental group A549 cell, erlotinib group A549ER cell and combination group A549ER cell were 15.15μmol/L, 118.8 μmol/L and 73.55μmol/L, respectively. The resistance index of erlotinib group A549ER cell and combination group A549ER cell were 7.84 and 4.85, respectively. The reversal index of metformin on the resistance of erlotinib was 1.62. The cell apoptosis rates of blank group A549ER cell, erlotinib group A549ER cell, metformin group A549ER cell and combination group A549ER cell were (5.53±3.00)%, (7.51±3.73)%, (10.25±4.23)% and (16.92±1.20)%, respectively. The cell apoptosis rate of combination group A549ER cell was significant higher compared with the other there groups (P<0.05). The proliferation index of blank group A549ER cell, erlotinib group A549ER cell, metformin group A549ER cell and combination group A549ER cell were 0.84±0.15, 0.78±0.10, 0.73±0.08 and 0.60±0.09, respectively. Conclusions A549ER has significant higher resistance of erlotinib compared with A549. The metformin reversed the resistance of erlotinib of A549ER. The metformin inhibited the cell proliferation, and promoted cell apoptosis in A549ER cells.
Lung adenocarcinoma; Metformin; Erlotinib; Resistance; Reversal
10.3877/cma.j.issn.1674-6902.2014.05.008
国家自然科学基金面上项目 (81372340)
1400037 重庆,第三军医大学新桥医院肿瘤研究所2400037 重庆,第三军医大学新桥医院呼吸研究所
胡义德, Email:huyide_mit@aliyun.com
R734
A
2014-06-26)

