右丙亚胺联合参芪扶正注射液减轻乳腺癌FAC方案心脏毒性临床研究
冯 琼
(湖北中医药大学,武汉市武昌医院,武汉 430000)
我国乳腺癌发病率逐年递增,发病年龄也呈明显年轻化的趋势[1]。以蒽环类为基础的化疗在乳腺癌的综合治疗中占有举足轻重的地位。但在提高患者无瘤生存率和总生存率的同时常导致机体一系列不良反应,其中心血管不良事件已受到广泛关注。本研究采用右丙亚胺联合参芪扶正注射液减轻乳腺癌FAC化疗方案所致心脏毒性,现报告如下。
1 临床资料
1.1 一般资料 选取2009年4月—2013年1月期间在我院住院治疗的60例Ⅱa~Ⅱb期女性乳腺癌患者作为研究对象。根据用药情况随机分为2组:实验组为32例(加用参芪扶正注射液),对照组(不加用参芪扶正注射液)为28例。其中实验组年龄42~63岁,平均(49.39±5.72)岁;对照组年龄43~64岁,平均(51.18±5.56)岁。2组患者年龄、分期、组织学分型及临床情况差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准 1)已完成乳腺癌保乳根治术或改良根治术,术后病理证实为浸润性导管癌;2)预计生存期≥12个月;3)按照《乳腺癌临床实践指南》规定,能够行FAC化疗者;4)化疗前血常规、心功能及肝肾功能检查均正常,KPS评分≥80分;4)化疗前无糖尿病、甲亢、高血压、冠心病等病史;5)既往未曾用过蒽环类药物、曲妥珠单抗或其他可引起心脏毒性的药物;6)既往从未接受过胸部纵膈放疗。[2-3]
1.3 排除标准 1)以往或同时伴有其他恶性肿瘤;2)化疗期间疾病进展者;3)出现严重化疗毒副反应而被迫停药者或未完成全程化疗而自动中途退出者;4)化疗前心脏功能、肝脏功能、骨髓功能异常者;5)出现急性感染、主要器官功能衰竭或恶病质患者;6)按不良事件通用术语标准3.0(CTC-AE3.0)≥2级的心脏功能异常者。
1.4 治疗药物 参芪扶正注射液(丽珠集团利民制药厂生产)规格250 mL;右丙亚胺(江苏奥赛康医药公司,商品名奥诺先)规格250 mg/瓶,本品为粉红色疏松块状物或粉末,配有专用溶剂。
2 方法
2.1 治疗方案 观察组和对照组均给以相同的化疗方案。5-氟尿嘧啶500 mg/m2,静脉滴注,第1天、第8天;阿霉素50 mg/m2,静脉注射,第1天;环磷酰胺500 mg/m2,静脉注射,第1天,每21天为1周期,共6个周期。观察组在给予阿霉素化疗前30 min,予右丙亚胺(江苏奥赛康医药公司,商品名奥诺先)快速静脉滴入(右丙亚胺∶阿霉素=20∶1,30 min内滴完)[4]。且从化疗开始之日起,予以参芪扶正注射液250 mL,1次/d静滴,在化疗前3 d开始使用直至化疗结束,每21 d重复1次,与化疗同步。对照组单用右丙亚胺,其余相同。治疗期间均予止吐(5-羟色胺受体拮抗剂)、护胃(质子泵抑制剂)等对症处理。化疗过程中出现骨髓抑制者可以使用粒细胞集落刺激因子(G-CSF)。化疗后,患者如果有放疗的适应症则行放疗,如果病理雌激素受体和/或孕激素受体阳性则给予内分泌治疗。
2.2 观察指标 观察指标包括化疗前后患者的生活质量(QOL)、心功能、不良反应(骨髓抑制、胃肠道反应、肝肾功能损伤)及cTnT浓度及LVEF的变化。
2.3 生活质量评估(QOL) 应用KPS量化评分标准进行生活质量评定。治疗前后评分增加10分及以上为提高,减少10分及以上为降低,变化在10分以内者为稳定。
2.4 不良反应评估 按照美国国立癌症研究所常见毒性反应标准(NCI-CTCAE 3.0版)进行评估。根据纽约心脏协会(NYHA)关于心脏状态的分类评估以及不良反应评价标准(NCI-CTC 3.0)进行心脏毒性分级的评定。心脏毒性事件定义:LVEF减少≥10%或降低到≤45%,或出现临床心功能不全[3]。
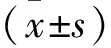
3 结果
60例乳腺癌患者均完成6个周期术后辅助化疗,无因心力衰竭及其他严重不良反应退出研究的病例。
3.1 QOL比较 实验组QOL改善12例(37.5%),稳定18例(56.2%),减退2例(0.06%);对照组QOL改善9例(32.1%),稳定13例(46.4%),降低6例(21.4%)。实验组患者的QOL改善率明显高于对照组,差异有统计学意义(P<0.05)。
3.2 不良反应比较 实验组和对照组患者化疗后胃肠道反应及肝肾功能反应较轻(均Ⅰ~Ⅱ度),2组差异无统计学意义(P>0.05)。实验组Ⅰ~Ⅳ度骨髓抑制发生率分别为28.1%,12.5%,9.4%和3.1%;对照组Ⅰ~Ⅳ度骨髓抑制发生率分别为21.8%,15.6%,18.7%和3.6%。2组比较差异有统计学意义(P<0.05)。见表1。
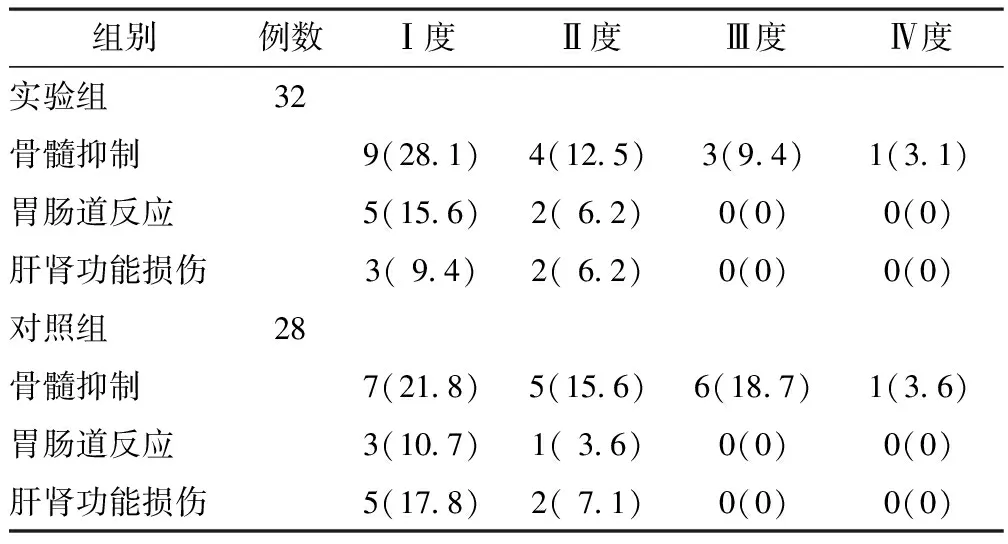
表1 2组乳腺癌患者化疗后不良反应比较 例(%)
3.3 心功能比较 实验组中出现心功能异常者为2例(6.7%),为Ⅰ度;而对照组中出现有心功能异常者为5例(16.7%),4例为Ⅰ度,1例为Ⅱ度。2组相比差异有统计学意义(P<0.05)。见表2。

表2 2组心功能分级比较 例(%)
3.4 心肌钙蛋白T(cTnT)、LVEF变化 2组治疗前的cTnT浓度比较差异无统计学意义(P>0.05),治疗后cTnT的浓度比较具有统计学意义(P<0.05),但治疗前后LVEF变化比较差异无统计学意义(P>0.05)。见表3。
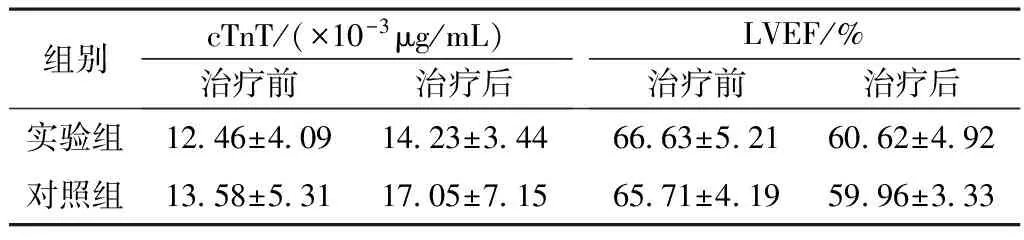
表3 2组乳腺癌患者化疗后cTnT、LVEF变化比较
4 讨论
以阿霉素为代表的蒽环类细胞周期非特异性化疗药抗肿瘤作用广泛且疗效确切,与非蒽环类化疗药物或新型靶向试剂联用可加重其剂量限制性心脏毒性。因而,保护心脏的策略应该在临床实践中引起更广泛的关注[5]。
蒽环类药物所致心脏毒性机制十分复杂,可能是一个多基因、多因素和多步骤发生的过程。其机制主要是铁介导的活性氧簇的产生以及促进心肌的氧化应激,细胞内钙超载以及铁离子代谢紊乱[6],引起线粒体破裂、肿胀,线粒体外膜通透性增强,细胞色素C释放,呼吸链功能障碍,心肌细胞自噬、凋亡、坏死,心肌肌丝合成受到抑制,心肌细胞超微结构以及心肌能量代谢改变,细胞器尤其是线粒体和内膜系统损伤,肌浆网扩张和肌纤维消失等,这些改变使得心脏功能受损并最终导致心力衰竭[7]。
右丙亚胺(Dexrazoxane,DEX)是国际上唯一公认的可保护心脏毒性的药物,它是螯合剂EDTA的类似物[8],具有强烈的螯合铁的能力,能抑制超氧化自由基的产生,在无铁和酶的情况下,本身就具有清除自由基和抗氧化的作用,抑制蒽环类诱导活性氧的形成以及心肌细胞的氧化损伤,对蒽环类药物造成的心脏损害有显著的防护作用且不影响蒽环类药物的抗癌作用及患者生存率[9],但会增加骨髓抑制的发生率。在随机对照的临床试验中,化疗联合右丙亚胺组在第1、第2个化疗周期时血小板和白细胞计数降低的程度高于对照组[10]。最新研究[11]报道也显示,DEX联合蒽环类药物增加了乳腺癌患者骨髓抑制的发生风险。
一些中药注射液、中成药和煎剂对心肌的保护作用也逐渐被认识[12]。现代研究[13]表明,它们均能不同程度提高GPX、SOD活力水平,减少氧自由基的生成,提高心肌组织抗脂质过氧化损伤和减少NO生成,并能降低心肌细胞内游离Ca2+浓度,抑制心肌细胞凋亡,增强心肌细胞膜Na+-K+-ATP酶活性,升高心肌线粒体膜电位和GPX活性,从而防治蒽环类药物的心脏毒性。其中参芪扶正注射液是以党参、黄芪为原料提取的纯中药制剂,具有益气扶正之功效。2012年的一项Meta分析[14]表明,参芪扶正注射液能提高放疗、化疗的近期疗效,降低毒副反应(恶心呕吐、骨髓抑制)的发生率,尤其是白细胞及血小板减低的发生率,提高患者生活质量。赵冰冰等[15]回顾性分析显示,参芪扶正注射液可以减轻蒽环类药物心脏损伤,改善因化疗而降低的心脏功能,并能减少异常心电图发生率。刘孟娟等[16]应用参芪扶正注射液联合TP方案治疗卵巢上皮癌,结果Ⅱ度及以上骨髓抑制的发生率较单纯化疗组明显减少。现代药理学研究[17]证实,党参及其有效成分不仅能通过清除体内活性氧以及减少膜脂过氧化来稳定机体内环境并增强机体对缺氧环境的适应性,还能通过增强网状内皮系统的吞噬功能、增加血红蛋白含量来抑制血小板黏附和聚集,改善血液循环,减轻化疗的毒副反应。黄芪及其有效成分通过清除氧自由基并增强自由基的迁移来降低氧化应激反应,保护心肌细胞线粒体。与此同时,通过影响肌浆网内Ca2+-ATP酶,阻断Ca2+内流和细胞内Ca2+的释放,抑制细胞内钙超载等途径来改善心脏功能,减轻心肌损伤[18]。动物实验[19]表明,参芪扶正注射液可能通过改变Caspase-8、Bcl-2在心肌细胞中的表达,减轻凋亡达到改善心功能作用。
本研究结果[20]显示,实验组患者的心功能及QOL得到了显著改善,且Ⅰ~Ⅳ度骨髓抑制发生率明显低于对照组,2组患者化疗后cTnT浓度比较具有统计学意义,但LVEF比较差异无统计学意义。可能是因为LVEF正常者也可能存在亚临床的心脏损伤,而CTnT在出现明显LVEF变化前,即可检测到阿霉素等蒽环类药物的早期心脏毒性。
总的来说,右丙亚胺联合参芪扶正注射液能明显减轻乳腺癌FAC方案化疗诱导的心脏毒性,减轻化疗期间的骨髓抑制,促进骨髓造血功能,降低胃肠道反应及肝肾功能损伤的发生率,提高患者生存质量,这就大大提高了患者治疗的依从性,保障了临床化疗的顺利进行。但由于本研究入选病例较少,尚需要大样本、多中心、完全随机对照临床试验的进一步证实。
[1]Youlden DR,Cramb S M,Dunn NAM,et al.The descriptive epidemiology of female breast cancer:an international comparison of screening,incidence,survival and mortality[J].Cancer Epidemiology,2012,36(3):237-248.
[2]乳腺癌诊疗规范(2011年版)编审专家组.乳腺癌诊疗规范(2011年版)[S/OL],2011-06-23.
[3]Lenihan D J,Oliva S,Chow E J,et al.Cardiac toxicity in cancer survivors[J].Cancer,2013,119(S11):2131-2142.
[4]马军,沈志祥,秦叔逵.防治蒽环类抗肿瘤药物心脏毒性的中国专家共识(2011版)[J].临床肿瘤学杂志,2011,16(12):1122- 1129.
[5]Menna P,Gonzalez Paz O,Chello M,et al.Anthracycline cardiotoxicity[J].Expert opinion on drug safety,2012,11(1):21-36.
[6]Khouri M G,Douglas P S,Mackey J R,et al.Cancer Therapy-Induced Cardiac Toxicity in Early Breast Cancer Addressing the Unresolved Issues[J].Circulation,2012,126(23):2749-2763.
[8]H Doroshow J.Dexrazoxane for the Prevention of Cardiac Toxicity and Treatment of Extravasation Injury from the Anthracycline Antibiotics[J].Current Pharmaceutical Biotechnology,2012,13(10):1949-1956.
[9]高甫,耿翠芝.蒽环类抗肿瘤药物的心脏毒性及防治研究[J].临床荟萃,2012,27(2):178-182.
[10]Marty M,Espie M,Llombart A,et al.Multicenter randomized phase Ⅲ study of the cardioprotective effect of dexrazoxane (cardioxane) in advanced/metastatic breat cancer patients treated with anthracycline-based chemotherapy[J].AnnOncol,2006,17(4):614-622.
[11]王培,张晟,张霄蓓,等.右丙亚胺对接受含蒽环类药物化疗乳腺癌患者的心脏保护作用[J].中华肿瘤杂志,2013,35(2):135-139.
[12]邱瑞瑾,闫会苓,卢雯平.疏肝益肾方对HER-2阳性乳腺癌患者生活质量的影响[J].长春中医药大学学报,2013,29(4):587-589.
[13]于静,杨继章,苏素文,等.多柔比星心脏毒性及其中药防治研究进展[J].医药导报,2013,32(2):174-177.
[14]张硕,张莉,商洪才.参芪扶正注射液对恶性肿瘤增效减毒作用的系统评价[J].中国执业药师,2012,9(12):17-24.
[15]赵冰冰,雷铭德,高宏伟,等.参芪扶正注射液减轻蒽环类药物化疗所致心脏损伤临床评价[J].吉林中医药,2012,32(12):1237-1239.
[16]刘孟娟,周陈西,王增,等.参芪扶正注射液在卵巢上皮癌术后化疗中的骨髓功能保护作用[J].中国药房,2011,22(4):340-341.
[17]冯佩佩,李忠祥,原忠.党参属药用植物化学成分和药理研究进展[J].沈阳药科大学学报,2012,29(4):307-311.
[18]张蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3203-3207.
[19]陈金水,吴天敏,陈国梁.参芪扶正注射液对心衰大鼠心肌Bcl-2,Caspase-8mRNA表达的影响[J].光明中医,2010(8):1370-1372.
[20]高甫,耿翠芝.蒽环类抗肿瘤药物的心脏毒性及防治研究[J].临床荟萃,2012,27(2):178-182.

