HSP27作为评价皮肤急性刺激性生物标志物的研究*
张贤英, 张 磊, 戴桃李, 孟 甜, 李淑华, 张齐好,2△, 黄亚东,2△
(1暨南大学生命科学技术学院医药生物研究院, 2广东省生物医学工程重点实验室,广东 广州 510632;3广东省生物制品与药物研究所,广东 广州 510300; 4广州市妇女儿童医疗中心, 广东 广州 510623)
皮肤刺激性定义为皮肤暴露于受试物后局部产生的可逆性炎性变化。常用评价方法是由Draize等[1]建立的皮肤刺激性实验(Draize实验),观察指标包括红斑、焦痂或水肿。然而,以动物作为受试对象,该评价体系具有明显的缺点:天然皮肤结构不仅与遗传、营养、精神状态有关,还受生理状态和环境因素的影响,个体差异大,重复性较差;观察指标为表观的定性判别,难以量化[2]。随着国际动物保护和动物福利运动的兴起,以动物替代为主的原则已成为药品和化妆品质量检验的重要理念。因此,构建皮肤替代模型,开发出新的、能够有效评价体外皮肤刺激效应的生物标志,建立完整的替代方法成为关键的核心问题。
在评价皮肤刺激性标记物的研究中,除了经典的细胞活性和白细胞介素1α(interleukin 1α,IL-1α)指标外[3-4],学者尝试将更多标志物作为刺激性评价的检测点,以增加替代方法的敏感性和特异性,如角质形成细胞前列腺素E2(prostaglandin E2,PGE2)、主要组织相容性复合体(major histocompatibility complex,MHC)表达变化以及IL-8、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)、IL-1受体拮抗剂(interleukin-1 receptor antagonist,IL-1RA)、干扰素γ(interferon γ,IFN-γ)等炎症介质的释放[5-7]。由于药物、化妆品等物质的皮肤毒性是非常复杂的生物过程,其效应可能是皮肤老化、接触性皮炎、过敏反应,也可能是黑素增生、细胞癌变等。它们涉及到不同的损伤机制,既具有共性,又具有特异性。而目前所用的生物标志物虽然能满足某些种类物质刺激性的区分,但还不足以区分不同类别的化学物质[8],因此需要进一步寻找更多的标志物用于体外皮肤毒性实验,以提高体外实验方法的敏感性和特异性。本研究以欧盟规定的刺激性化合物作用于人体皮肤组织,应用蛋白组学技术筛选用于评价化合物皮肤急性刺激性的特异性生物标志。
材 料 和 方 法
1 材料与仪器
人体皮肤组织(由广州市儿童医院提供),DMEM培养基(Gibco),胎牛血清(杭州四季青),十二烷基硫酸钠(sodium lauryl sulfate,SLS;Sigma),3,3’-二硫代二丙酸(3,3’-dithiodipropionic acid,DA;Sigma),10-十一碳烯酸(10-undecenoic acid,UA;Alfa),组织裂解液{7 mol/L 尿素,4% 3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS),2 mol/L硫脲},水化液(2%CHAPS,7 mol/L尿素),Ettan IPGphor Ⅲ等电聚焦系统(GE),SE 600 Ruby 标准垂直电泳系统,预制干胶条(pH 3~10)。
2 化合物处理皮肤组织
无菌条件下,去除包皮切除术后皮肤组织的皮下脂肪,并剪成小块,大小为0.8 mm×0.8 mm。皮肤组织放置于自制的不锈钢网架上,采用气液交界培养法培养,表皮面朝上,在12孔培养板的孔内加入0.9 mL的DMEM培养基(含10% FBS)。分别把SLS、UA和DA涂抹于皮肤表皮面:其中液体化合物取(10±1)μL;固体化合物取(10±2)mg+10 μL PBS,以利于样品均匀分布,与皮肤表面充分接触。作用时间为15 min,然后用无菌PBS将组织样品反复冲洗10遍后收集样品。
3 组织蛋白的提取
组织样品剪碎后,加入组织裂解液充分研磨10 min。然后在冰上放置约1 h,期间不定时进行研磨。收集液体,9 000×g离心1 h,收集上清蛋白,测定蛋白浓度。
4 二维电泳
取300 μg样品进行等电聚焦,上样体积为250 μL。样品与水化液混合后上样,胶条与样品接触后,充分吸胀30 min,进行等电聚焦,时间约22 h,条件为:30 V 12 min;500 V 1 h;1 000 V 1 h;8 000~64 000 V 10 h;2 000 V 10 h。等电聚焦结束后,分别用含有1%二硫苏糖醇的平衡液和含有2.5%吲哚-3-乙酸平衡液各平衡15 min。用12.5% SDS-PAGE进行第二相电泳,先每个胶15 mA,电泳15 min后,然后每个胶30 mA直至电泳结束。
固定液固定过夜,敏化液敏化30 min,水洗4次,每次10 min,0.1% AgNO3银染40 min,简单水洗后加入NaCO3显色液显色。
5 图像和质谱分析
用ImageMaster 2D Platinum软件分析电泳胶,蛋白点匹配后,以差异度达到2倍或者2倍以上作为具有显著性差异的蛋白点进行质谱鉴定。从胶上挖出蛋白点,酶解后冻干。冻干的蛋白质多肽溶于3 μL 30%乙腈(含0.1%的三氟乙酸)中,点样0.5 μL于MALDI板上,再加入0.5 μL 10 g/L α-氰基-4-羟基肉桂酸基质,晾干后,行MALDI-TOF/TOF MS质谱鉴定。完全冻干的样品重新用0.1%三氟乙酸溶解,然后使用美国应用生物系统公司4800 Plus MALDI-TOF-TOF Analyzer串联飞行时间质谱仪进行分析。质谱鉴定采用板上混合点样方法,操作参数如下:反射模式,正离子检测,一级质谱的质量扫描范围为800~4 000 Da,使用标准肽混合物作为外标校正,每一个样品质谱信号累加600~800个激光shots;对于每一个样品,再选择信噪比最强的且大于或等于50以上的5个峰分别作为前体离子,然后进行二级质谱分析,单个前体离子的质谱信号累加1 200激光shots。获得的一级和二级质谱数据使用GPS Explore 3.6(美国应用生物系统公司)软件进行分析,分析后的每一个样品的一级和二级质谱数据再整合成一个文件,使用MASCOT 2.1 (Matrix Science)搜库软件对本地数据库进行检索,鉴定蛋白质。
6 Real-time RT-PCR检测
按照Qiagen RNeasy Mini Kit (Qiagen)的操作方法分别提取各处理组及对照组的组织总RNA,检测RNA浓度和纯度,放置于-80 ℃保存备用。应用M-MLV first-strand synthesis system试剂盒(Bio-Rad)逆转录为cDNA,随后加入引物和cDNA,设计程序进行qPCR检测。热休克蛋白27(heat-shock protein 27,HSP27) 上游引物5’-GGACGAGCATGGCTACATCT-3’,下游引物5’-GACTGGGATGGTGATCTCGT-3’;62 ℃退火10 s;40循环;产物166 bp。GAPDH上游引物5’- GAAGGTGAAGGTCGGAGTC-3’,下游引物5’-AAGATGGTGATGGGATTTC-3’;60 ℃退火10 s;40循环;产物226 bp。
7 Western blotting检测
配备12% SDS-PAGE凝胶,蛋白样品上样电泳;转膜后室温下封闭1~2 h,然后孵育Ⅰ抗(goat anti-human HSP27 antibody; Santa Cruz,1∶2 000)4 ℃过夜;以辣根过氧化物酶标记的Ⅱ抗(Sigma-Aldrich, 1∶200)在室温下孵育2 h;采用ECL化学发光法检测蛋白;对蛋白条带进行灰度分析(ImageJ)。
8 统计学处理
用SPSS 11.0软件分析,数据用均数±标准差(mean±SD)表示,组间差异采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 二维电泳和MALDI-TOF/TOF MS的结果
SLS、UA和DA处理皮肤组织后,提取全蛋白,进行二维电泳,共获得约1 400个蛋白点,经过软件分析选取了有统计学意义的10个蛋白表达差异点。图1是2-D电泳图谱,箭头标示的是差异表达蛋白点。在这些差异表达蛋白中,HSP27表现为显著上调,在SDS和UA处理组中分别上调2.86和3.66倍。图2显示的是HSP27在2-D图谱中的确切位点。能够被MALDI-TOF/TOF MS质谱分析法所鉴定的蛋白点有8个,差异倍数详见表1。

Figure 1. Representative 2-D maps of protein expression in human skin with different treatments.N: normal group.
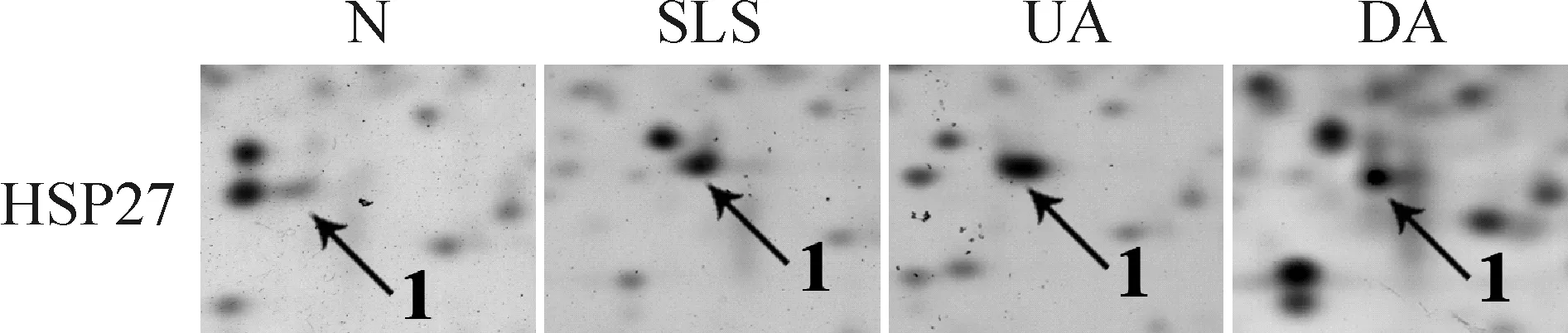
Figure 2. Expression of HSP27 in 2-DE maps of human skin with different treatments.

表1 MALDI-TOF/TOF MS鉴定不同处理组皮肤样品中差异蛋白的表达
2 Real-time RT-PCR检测HSP27 mRNA的表达
SLS和UA处理15 min后,皮肤组织HSP27 mRNA的表达并没有发生显著改变,见图3。
3 Western blotting验证HSP27蛋白的表达
与正常组比较,SLS和UA刺激使人体皮肤HSP27蛋白的表达明显上调,差异有统计学意义(P<0.01);而阴性对照组DA与正常组比较,HSP27的表达没有显著差异,见图4。

Figure 3. The mRNA expression of HSP27 in skin tissues exposed to SLS, UA and DA detected by real-time RT-PCR.Mean±SD.n=3.
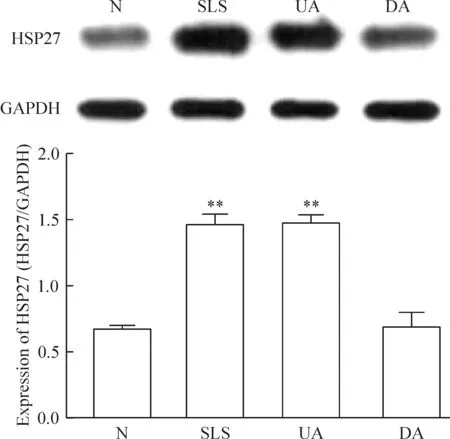
Figure 4. The protein expression of HSP27 in skin tissues exposed to SLS, UA and DA detected by Western blotting.Mean±SD.n=3.**P<0.01 vs N group.
讨 论
在本实验中,根据欧洲替代方法验证中心(the European Centre for the Validation of Alternative Methods, ECVAM)的测试流程[9](ECVAM SIVS, 2007),人体皮肤组织暴露于欧盟定义的刺激性化合物SLS、UA和非刺激性化合物DA中,作用15 min后,应用双向电泳的蛋白质组学技术,筛选出8个差异表达蛋白,其中HSP27表达显著上调。我们的前期研究已经证实,在细胞模型中,HSP27有可能成为评价皮肤刺激性的候选生物标志。
人HSP27的分子量为27 kD,在生物体内主要有2种HSP:诱导型和构成型。诱导型HSP主要在外界环境的刺激下表达,具有保护细胞的功能;构成型HSP在生理状态下表达,与细胞的分化、发育密切相关。应激条件下,热休克转录因子(heat-shock transcription factor,HSF)与热休克调节元件结合,激活HSP27基因,使HSP27表达增加。HSP27主要在皮肤的上皮层中表达,在多种应激条件下,诱导型HSP27表达增加,作为分子伴侣保护细胞功能[10]。紫外线[11]、加热[12]和对羟基苯甲酸甲酯[13]都可以使角质细胞中的HSP27表达上调。HSP27能够启动接触超敏反应,诱导树突状细胞中IL-1α、TNF-α、IL-6、IL-12 p70和IL-12 p40的上调,建立接触过敏早期阶段适应性和先天免疫之间的联系[14]。紫外线照射后诱导上调的HSP27可以调节角质细胞中促炎细胞因子IL-8和IL-1的释放,并且还可以调节NF-κB通路依赖促炎介质的产生[15]。
在我们前期的研究已经发现,SLS和酸碱化合物能够使角质细胞的HSP27表达下调[16],重金属则可以使HSP27表达上调[17];而在本实验中,SLS和UA使皮肤组织中HSP27表达上调。有研究发现,数小时的缺氧导致脐静脉内皮细胞HSP27表达下调,最终导致细胞骨架崩溃死亡[18]。也就是说,HSP27蛋白表达的改变与刺激的时间、强度有关,而细胞和组织对同种刺激也会产生不同的效应。在2-D图谱中,1号点和3号点同时鉴定为HSP27,提示HSP27可能发生了蛋白磷酸化修饰,有待后续研究进一步验证。此外,SLS和UA处理15 min后,与蛋白表达比较,HSP27在mRNA水平上的表达并没有发生改变,说明是在翻译水平上调HSP27蛋白的表达,与HSP27对细胞的保护作用相关。综上所述,HSP27有可能成为评价皮肤刺激性体外替代方法体系的候选生物标志物,其表达改变的强度需要与既定的体外模型对应。
[参 考 文 献]
[1] Draize JH, Woodard G, Calvery HO. Methods for the study of irritation and toxicity of substances applied topically to the skin and mucous membranes[J]. J Pharmacol Exp Ther, 1944, 82(3): 377-390.
[2] Hartung T, Blaauboer BJ, Bosgra S, et al. An expert consortium review of the EC-commissioned report “Alternative (Non-Animal) Methods for Cosmetics Testing: Current Status and Future Prospects - 2010”[J]. ALTEX, 2011, 28(3): 183-209.
[3] Casas JW, Lewerenz GM, Rankin EA, et al.Invitrohuman skin irritation test for evaluation of medical device extracts[J]. Toxicol In Vitro, 2013, 27(8): 2175-2183.
[4] Hoffmann S, Saliner AG, Patlewicz G, et al. A feasibility study developing an integrated testing strategy assessing skin irritation potential of chemicals[J]. Toxicol Lett, 2008, 180(1): 9-20.
[5] Ponec M, Kempenaar J. Use of human skin recombinants as aninvitromodel for testing the irritation potential of cutaneous irritants[J]. Skin Pharmacol Physiol, 1995, 8(1-2): 49-59.
[6] Bernhofer LP, Barkovic S, Appa Y, et al. IL-1alpha and IL-1ra secretion from epidermal equivalents and the prediction of the irritation potential of mild soap and surfactant-based consumer products[J]. Toxicol In Vitro, 1999, 13(2): 231-239.
[7] Bernhofer LP, Seiberg M, Martin KM. The influence of the response of skin equivalent systems to topically applied consumer products by epithelial: mesenchymal interactions[J]. ToxicolInVitro, 1999, 13(2): 219-229.
[8] Welss T, Basketter DA, Schroder KR.Invitroskin irritation: facts and future. State of the art review of mechanisms and models[J]. Toxicol In Vitro, 2004, 18(3): 231-243.
[9] Katoh M, Hamajima F, Ogasawara T, et al. Assessment of human epidermal model LabCyte EPI-MODEL forinvitroskin irritation testing according to European Centre for the Validation of Alternative Methods (ECVAM)-validated protocol[J]. J Toxicol Sci, 2009, 34(3): 327-334.
[10] Huang CM, Foster KW, DeSilva T, et al. Comparative proteomic profiling of murine skin[J]. J Invest Dermatol, 2003, 121(1): 51-64.
[11] Wong JW, Shi B, Farboud B, et al. Ultraviolet B-mediated phosphorylation of the small heat shock protein HSP27 in human keratinocytes[J]. J Invest Dermatol, 2000, 115(3): 427-434.
[12] McClaren M, Isseroff RR. Dynamic changes in intracellular localization and isoforms of the 27-kD stress protein in human keratinocytes[J]. J Invest Dermatol, 1994, 102(3): 375-381.
[13] Ishiwatari S, Suzuki T, Hitomi T, et al. Effects of methyl paraben on skin keratinocytes[J]. J Appl Toxicol, 2007, 27(1): 1-9.
[14] Yusuf N, Nasti TH, Huang CM, et al. Heat shock proteins HSP27 and HSP70 are present in the skin and are important mediators of allergic contact hypersensitivity[J]. J Immunol, 2009, 182(1): 675-683.
[15] Sur R, Lyte PA, Southall MD. Hsp27 regulates pro-inflammatory mediator release in keratinocytes by modulating NF-κB signaling[J]. J Invest Dermatol, 2008, 128(5): 1116-1122.
[16] Zhang Q, Dai T, Zhang L, et al. Identification of potential biomarkers for predicting acute dermal irritation by proteomic ana-lysis[J]. J Appl Toxicol, 2011, 31(8): 762-772.
[17] Zhang Q, Zhang L, Xiao X, et al. Heavy metals chromium and neodymium reduced phosphorylation level of heat shock protein 27 in human keratinocytes[J]. ToxicolInVitro, 2010, 24(4): 1098-1104.
[18] Eguchi R, Naitou H, Kunimasa K, et al. Proteomic ana-lysis of hypoxia-induced tube breakdown of aninvitrocapillary model composed of HUVECs: potential role of p38-regulated reduction of HSP27[J]. Proteomics, 2008, 8(14): 2897-2906.

