8周游泳运动对2型糖尿病大鼠周围神经病变的影响
尚画雨, 夏 志, 张 丹, 黄玫梅, 上官若男, 苏全生△
(1北京体育大学运动人体科学学院,北京 100084; 2井冈山大学体育学院,江西 吉安 343009; 3四川省体育科学研究所,4成都体育学院,四川 成都 610041; 5成都大学体育学院,四川 成都 610106)
糖尿病周围神经病变(diabetic peripheral neuro-pathy, DPN)是糖尿病(diabetes mellitus, DM)最常见的慢性并发症之一,在临床上表现为进行性的感觉功能缺失,随着病情的发展会出现疼痛、麻木甚至可能因坏疽而导致截肢[1]。目前,临床上主要通过药物治疗DPN,但值得考虑的是,长期服药不仅会产生毒副作用,且只能暂时应对部分问题,停药后疗效也无法持续。
引起DPN的发病机制有很多,近年来随着炎症学说的兴起和研究的增多,越来越多的学者趋向认为神经功能障碍主要是由于炎症反应引起[2-4]。运动与“胰岛素、饮食”一并被比喻为治疗DM的“三驾马车”。目前,国内外鲜见对炎症与DPN关系的研究,且尚未见报道从炎症反应的角度研究长期游泳运动在DPN发病中的干预作用。本研究拟通过对DPN模型大鼠神经组织病理学、坐骨神经中炎症因子和神经电生理的检测,探讨运动对T2DM大鼠坐骨神经损伤的保护作用及其可能机制。
材 料 和 方 法
1 主要试剂与仪器
链脲佐菌素(streptozocin,STZ)(Sigma);ELISA试剂盒(成都三鹰生物技术有限公司);血糖仪(美国强生公司);PowerLab数据采集分析系统(AD Instruments)。
2 动物分组及模型制备
健康雄性Wistar大鼠45只,8周龄,体重200~230 g(四川大学华西医学院动物中心提供)。适应性喂养1周后,随机抽取14只分为空白对照组(C,n=7)和单纯运动组(CE,n=7),给予标准大鼠饲料喂养7周后腹腔注射相同剂量的枸橼酸缓冲液。其余31只给予高糖高脂饲料(10.0%猪油,20.0%蔗糖,2.5%胆固醇,1.0%胆酸钠,66.5%常规饲料)喂养(期间死亡5只),7周后空腹12 h腹腔注射STZ 30 mg/kg(溶于0.1 mol/L、pH4.2的枸橼酸缓冲液中)。72 h后用血糖仪检测非禁食血糖>16.7 mmol/L者作为2型糖尿病(type II diabetes mellitus, T2DM)大鼠[5]。将20只成模大鼠(造模成功率为76.9%)随机分为2组:DM对照组(DM,n=10)和DM+运动组(DME,n=10)。
3 运动干预方案
采用改进的Ploug等[6]训练方案,池(100 cm×70 cm×60 cm)水深50 cm,水温(30±2)℃。先进行2次适应性游泳练习,每次10 min。第1周前3 d训练时间分别为20 min、30 min和45 min,第4天起每天持续游泳60 min,每周训练6 d,共训练8周。CE组和DME组进行训练,C组和DM组不予运动。
4 观察指标及检测方法
实验期间记录大鼠一般情况及行为改变,定时称重。分别于STZ注射前、运动8周后禁食12 h测量各组大鼠空腹血糖(fasting blood glucose,FBG)和空腹血清胰岛素(fasting insulin,FINS)。使用血糖仪测定FBG,ELISA测定血清FINS;胰岛素抵抗指数HOMA-IR=FBG×FINS/22.5。
运动8周后,大鼠腹腔注射10%水合氯醛(3.5 mL/kg)麻醉后,俯卧位固定,迅速脱毛,仔细分离右侧从坐骨切迹至踝部的坐骨神经。坐骨神经分离暴露后立即测定,用生理盐水作为导电介质,以钩状电极作为刺激电极和记录电极分别置于坐骨切迹处和踝部,另将一个参考电极置于记录电极和刺激电极之间,大约位于腓肠肌处。测试时保持室温(25±1)℃,大鼠体温37 ℃左右,并连接PowerLab数据采集分析系统(频率20 Hz;单刺激方式;波宽1 ms;强度1.4 V;采样速率20 kHz)[7]。运动神经传导速度(motornerve conduction velocity,MNCV;m/s)=刺激电极与记录电极之间的距离(cm)×10/动作电位产生时间 (ms),重复电刺激3次取平均值。MNCV测定后,取大鼠左侧坐骨神经(坐骨切迹至远端1 cm),行HE染色。左侧剩余神经组织迅速置于液氮速冻后,保存于-80 ℃冰箱备用。ELISA测定坐骨神经中肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6, IL-6)和C-反应蛋白(C-reactive protein,CRP)含量。
5 统计学处理
使用SPSS 17.0统计软件分析,数据以均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。进行方差分析之前先进行方差齐性检验,若方差齐,则直接采用Bonferroni法进行事后检验,以使结论稳健而不保守;若方差不齐,则将原始数据转换至齐性后再作统计。对于不能转换至齐性的指标数据,直接采用Tamhane’s T2的统计结果进行分析。
结 果
1 一般情况
实验期间由于环境和饮食改变、糖尿病慢性疾病状态和感染等原因导致大鼠死亡。C、CE、DM和DME组最终进入统计的有效样本量分别为6只、6只、7只和6只。
成模大鼠毛色无光泽、精神萎靡,多饮、多食、多尿,明显消瘦。
2 体重的变化
适应性喂养1周后,14只标准饲料喂养大鼠体重[(242.00±34.52) g]与31只高糖高脂饲料喂养大鼠体重[(233.30±24.87) g]无显著差异。开始运动前C和CE组体重增加,DM和DME组体重减轻,各组间体重差异无统计学意义(P>0.05)。实验末,C和CE组体重持续增加,组间差异无统计学意义(P>0.05);DM组体重显著低于C组和CE组(P<0.01);DME组体重较C组和CE组明显减轻(P<0.05),较DM组增加并不显著(P>0.05),见图1。
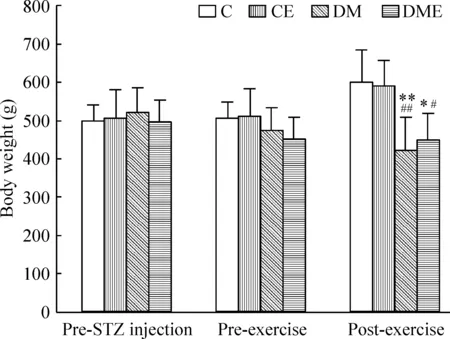
Figure 1. The change of body weight in diffe-rent groups at different time points. Mean±SD.n=6~7.*P<0.05, **P<0.01 vs C group; #P<0.05, ##P<0.01 vs CE group.
3 血糖的变化
实验期间C组和CE组的空腹血糖在正常范围内波动且组间差异无统计学意义(P>0.05)。DM和DME组在STZ注射前、开始运动前及运动后的空腹血糖均明显高于C组和CE组(P<0.01或P<0.05)。开始运动前,DM组和DME组的空腹血糖比较差异无统计学意义(P>0.05)。实验末,与DM组相比,DME组的空腹血糖明显降低(P<0.05),见图2。
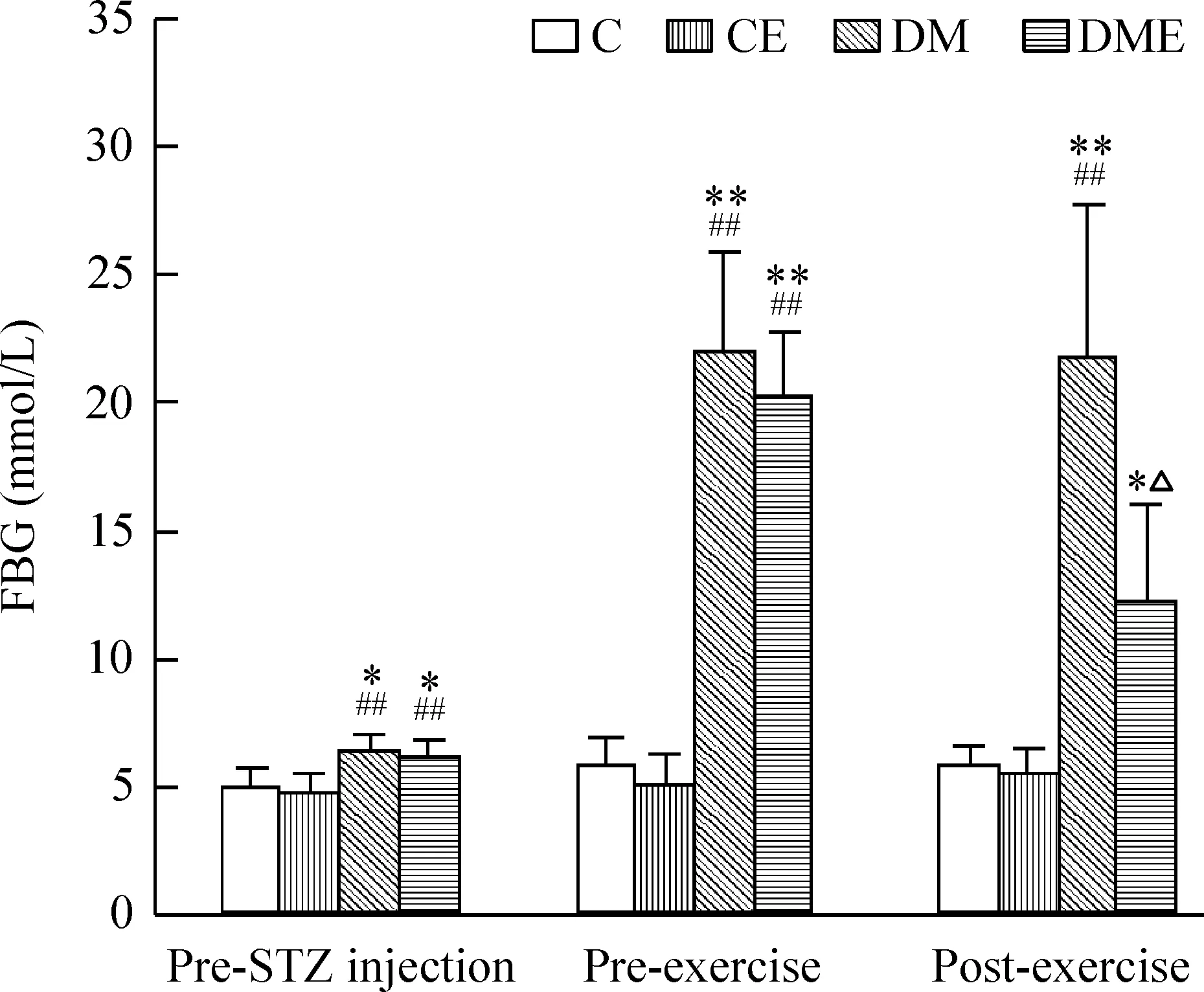
Figure 2. The change of fasting blood glucose (FBG) in diffe-rent groups at different time points. Mean±SD. n=6~7.*P<0.05, **P<0.01 vs C group; #P<0.05, ##P<0.01 vs CE group; ▲P<0.05 vs DM group.
4 血清FINS和HOMA-IR的变化
实验期间C组和CE组的血清FINS和HOMA-IR均未发生明显变化,且组间差异无统计学意义(P>0.05)。在STZ注射前,DM和DME组的血清FINS和HOMA-IR高于C组和CE组(P<0.05或P<0.01),但DM与DME两组间差异不显著(P>0.05)。实验末,DM组的血清FINS低于C组和CE组(P<0.01),HOMA-IR高于C组和CE组(P<0.01);DME组的血清FINS和HOMA-IR与C组和CE组相比无显著差异(P>0.05),血清FINS显著高于DM组(P<0.01),HOMA-IR明显低于DM组(P<0.05),见图3、4。
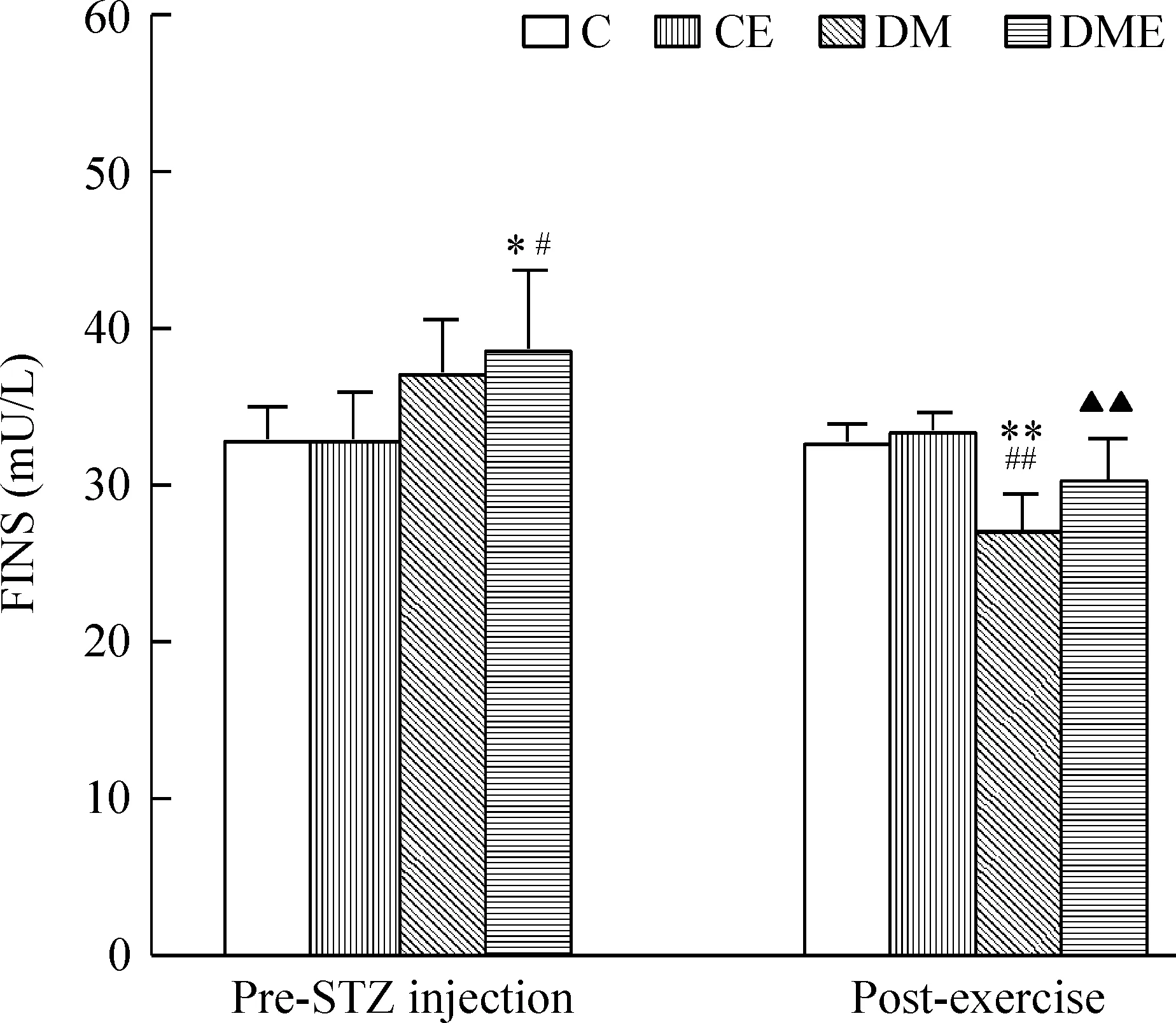
Figure 3. The change of fasting insulin (FINS) in different groups at different time points. Mean±SD. n=6~7.*P<0.05, **P<0.01 vs C group; #P<0.05, ##P<0.01 vs CE group; ▲▲P<0.01 vs DM group.

Figure 4. The change of HOMA-IR in different groups at different time points. Mean±SD. n=6~7.**P<0.01 vs C group; ##P<0.01 vs CE group; ▲P<0.05 vs DM group.
5 MNCV的变化
实验末,C组和CE组的MNCV差异无统计学意义(P>0.05)。DM和DME组的MNCV明显低于C组和CE组(P<0.01或P<0.05);与DM组相比,DME组的MNCV显著提高(P<0.05),见图5。
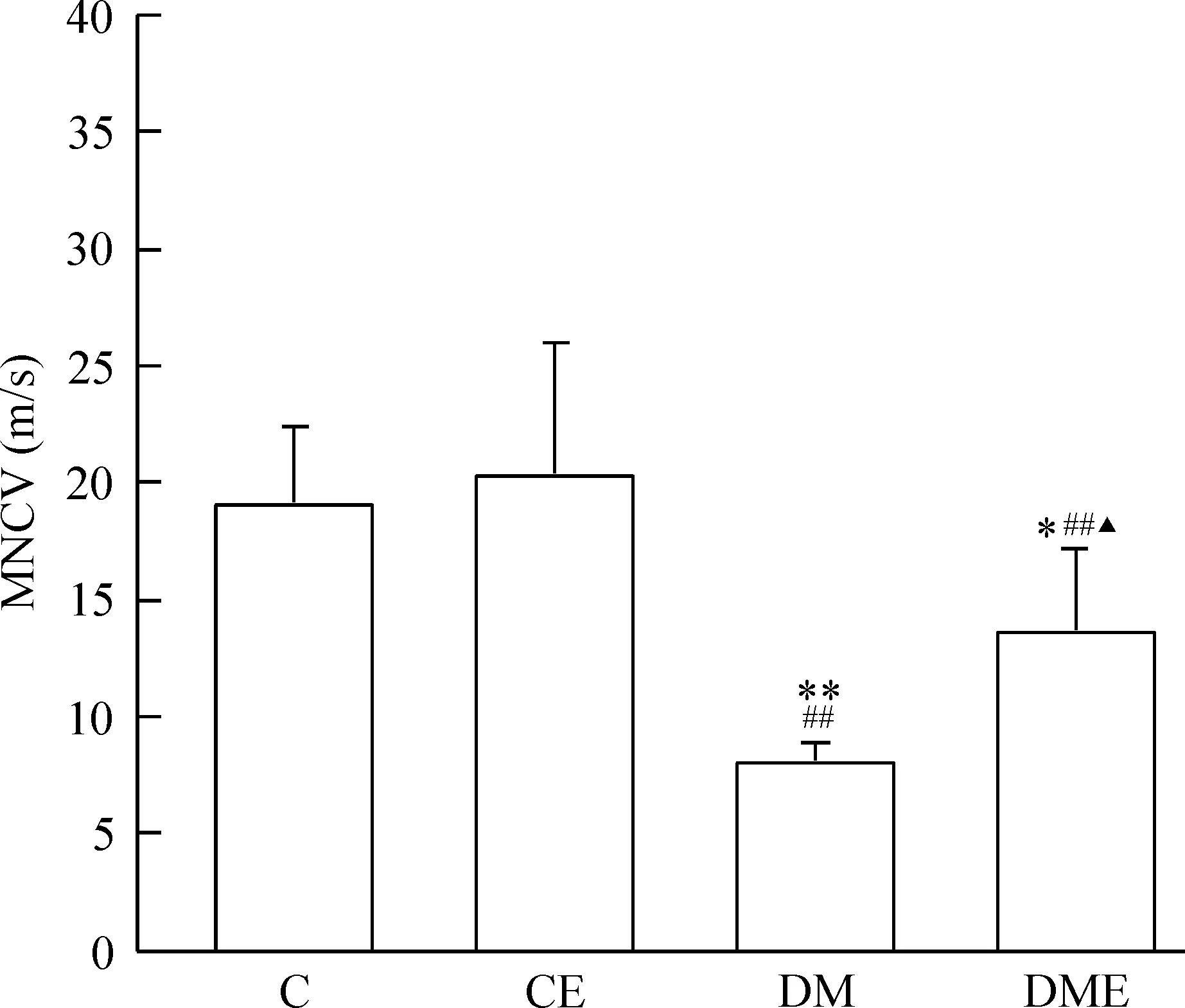
Figure 5. The change of MNCV in different groups. Mean±SD. n=6~7.*P<0.05, **P<0.01 vs C group; ##P<0.01 vs CE group; ▲P<0.05 vs DM group.
6 坐骨神经形态学的变化
实验末,C组(图6A)和CE组(图6B)的坐骨神经有髓神经纤维形态正常,神经纤维排列紧密,髓鞘正常包绕在神经纤维轴索外。与C组和CE组比较,DM组(图6C)表现出神经损伤,髓鞘空泡变性,部分神经纤维脱髓鞘(如箭头所指)。DME组(图6D)较DM组改善明显,髓鞘空泡变性数量减少,极少神经纤维脱髓鞘。
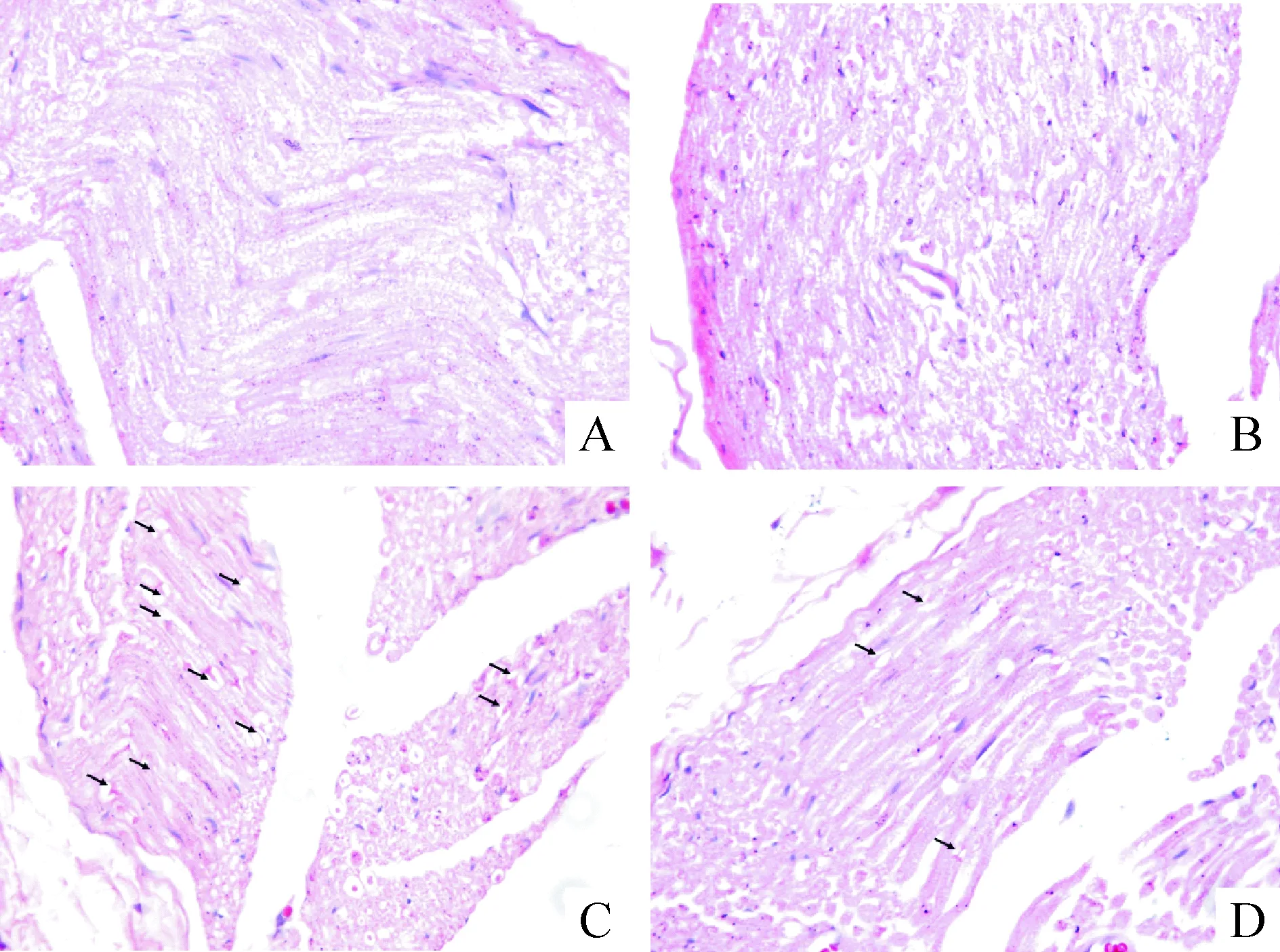
Figure 6. The morphological change of sciatic nerve in different groups (HE staining, ×400). A: C group; B: CE group; C: DM group; D: DME group. Black arrows show myelin damage.
7 坐骨神经中TNF-α、IL-6和CRP的变化
实验末,C组和CE组TNF-α、IL-6和CRP的水平无明显差异(P>0.05);与C组和CE组相比,DM组的TNF-α、IL-6和CRP水平明显升高(P<0.05),而DME组的TNF-α、IL-6和CRP水平升高不显著(P>0.05);DME组与DM组相比,虽然TNF-α、IL-6和CRP水平差异并不显著(P>0.05),但仍表现出了下降的趋势,见表1。
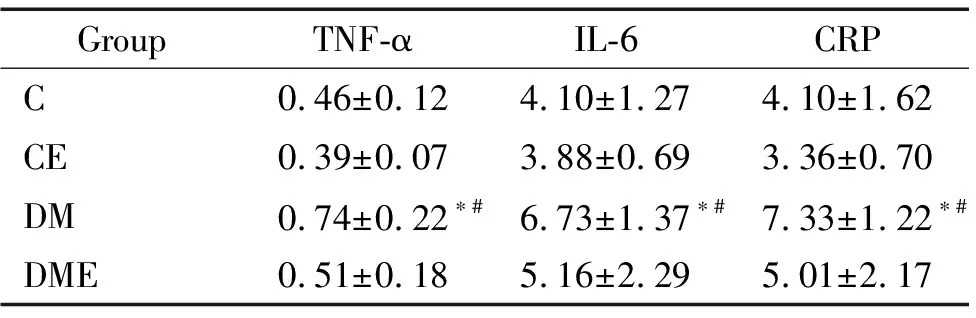
表1 各组大鼠神经炎症因子比较
讨 论
近年来,大量研究结果表明T2DM可能是一种慢性临床炎症性疾病,由免疫系统诱导、细胞因子介导[8]。细胞因子不仅能够预测DM的发生[9-10],而且与DM并发症如血管病变、肾病等有关[11-13]。这些炎症细胞因子主要包括急性时相反应蛋白CRP、TNF-α、IL-6等。研究指出:适宜的有氧运动,能明显提高血液纤维蛋白溶解酶活性,改善微循环,增加神经血流灌注,改善局部血液动力学,增强机体抗氧化反应,减轻炎症反应[14]。这为有氧运动治疗糖尿病并发症提供了理论依据。
本实验采用高糖高脂喂养联合小剂量STZ注射制备T2DM模型,我们发现当高糖高脂喂养7周后大鼠出现高胰岛素血症和胰岛素抵抗(insulin resis-tance, IR),胰岛素抵抗指数升高,继以小剂量STZ破坏大鼠胰岛功能,出现高血糖。结果显示DM大鼠均呈现典型“三多一少”症状,毛色无光泽,体重明显减轻,从而进一步说明,本研究成功建立了T2DM大鼠模型,与国内外学者研究结果一致[15-16]。随后,我们观察了从T2DM发病到出现神经损害的完整过程,模拟了人类DPN发病情况和病理特征。神经传导速度(nerve conduction velocity,NCV)是诊断周围神经损伤的“金指标”,也是DPN重要的检查手段。很多实验制备DPN动物模型进行研究,结果表明,在DM早期即出现NCV明显减慢[17-18]。NCV包括MNCV和感觉神经传导速度(sensory NCV,SNCV)。其中,MNCV是最常用于研究实验性DPN模型的观察指标。本实验在大鼠成模后立即进行运动干预,结果表明,8周游泳运动不能将血糖降至正常水平,但能有效控制体重下降和血糖升高,还能增加胰岛素的分泌,从而改善IR。8周运动后DM组MNCV较C、CE组明显减慢(P<0.01),而DME组与DM组比较明显提高(P<0.05)。提示8周游泳运动对T2DM大鼠MNCV减慢具有改善作用。另有资料表明,神经病变的发生同雪旺细胞与神经元轴突间的联系异常紧密相关。其中,髓鞘病变与神经传导速度有关,而轴突病变与诱发电位的波幅有关。光镜下我们观察到,DM组髓鞘空泡变性显著,部分神经纤维脱髓鞘。DME组干预后神经髓鞘空泡变性数量减少,极少神经纤维脱髓鞘,提示8周游泳运动能减轻T2DM大鼠周围神经损伤,延缓周围神经病变进程,与Balducci等[19]报道的长期运动训练可以改善DPN患者自然病程的结果相似。本研究还发现,T2DM大鼠8周时坐骨神经中炎症因子TNF-α、IL-6和CRP水平明显高于C和CE组(P<0.05),表明此时的确处于慢性炎症状态,这与DM炎症发病学说是吻合的。在慢性炎症状态下,肝细胞可产生较多CRP。目前认为肝脏CRP产生的主要兴奋剂为IL-6。TNF-α诱导IL-6表达及其它通道激活,扩大级联反应,增加CRP的合成。FINS受体的活性受到CRP抑制,从而产生IR,再一次诱导TNF-α产生,进而加重炎症反应。CRP受TNF-α、IL-6等因子调控,刺激血管内皮因子释放,造成神经组织血流减少,缺血甚至坏死,引起神经传导速度减慢及周围神经损伤。本实验在8周运动干预后DME组坐骨神经中TNF-α、IL-6和CRP水平较DM组虽无明显差异(P>0.05),但仍然表现出了降低的趋势,提示有氧运动可以抑制炎症反应,提高MNCV。
有氧运动对于TNF-α和CRP的影响报道不一[20-23]。这可能与不同的实验对象以及运动的时间和强度有关。Sloan等[24]研究发现12周中等强度(55%~60%最大心率)有氧运动后健康成年人TNF-α水平变化不大,只有12周高强度(75%~80%最大心率)有氧运动组TNF-α 出现显著下降。另有资料报道,TNF-α受体的水平比TNF-α更能反映TNF-α系统的活动[25]。另有研究结果显示有氧运动并不能降低TNF-α和CRP水平,但可以改善体适能[26-27]。You等[28]以绝经后肥胖妇女作为实验对象,对其进行6个月的节食联合运动干预,最后发现,节食联合运动干预可以使绝经后肥胖妇女CRP水平显著下降,提示从事有氧运动的同时需控制饮食,这样才能有效降低CRP水平。而IL-6未发生显著变化可能是8周的运动时间还不足以引起IL-6水平发生明显改变。本研究结果表明,8周游泳运动能通过降低炎症反应而减轻T2DM大鼠周围神经损伤。
综上所述,8周游泳运动可降低T2DM大鼠FBG水平,改善IR,提高MNCV,减轻DM造成的神经损伤,对周围神经起保护作用,其机制可能与减轻炎症反应有关。
[参 考 文 献]
[1] Boulton AJ, Malik RA, Arezzo JC, et al. Diabetic somatic neuropathies [J]. Diabetes Care, 2004, 27(6):1458-1486.
[2] Murata Y, Olmarker K, Takahashi I, et al. Effects of selective tumor necrosis factor-alpha inhibition to pain-behavioral changes caused by nucleus pulposus-induced damage to the spinal nerve in rats [J]. Neurosci Lett, 2005, 382(1-2):148-152.
[3] Ozaktay AC, Cavanaugh JM, Asik I, et al. Effects of interleukin-1 beta, interleukin-6, and tumor necrosis factor on sensitivity of dorsal root ganglion and peripheral receptive fields in rats [J]. Eur Spine J, 2006, 15(10):1529-1537.
[4] 高雪明,李明才,王亚清,等. IL-33及其在中枢神经系统疾病中的作用[J].中国病理生理杂志,2012,28(10):1901-1905.
[5] Elias D, Prigozin H, Polak N, et al. Autoimmune diabetes induced by the β-cell toxin STZ. Immunity to the 60-kDa heat shock protein and to insulin [J]. Diabetes, 1994, 43(8):992-998.
[6] Ploug T, Stallknecht BM, Pedersen O, et al. Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle [J]. Am J Physiol, 1990, 259(6 Pt 1): E778-E786.
[7] Zangiabadi N, Asadi-Shekaari M, Sheibani V, et al. Date fruit extract is a neuroprotective agent in diabetic periphe-ral neuropathy in streptozotocin-induced diabetic rats: a multimodal analysis [J]. Oxid Med Cell Longev, 2011, 2011: 976948.
[8] Pickup JC. Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes [J]. Diabetes Care, 2004, 27(3):813-823.
[9] Spranger J, Kroke A, Mohlig M, et al. Inflammatory cytokines and the risk to develop type 2 diabetes: results of the prospective population-based european prospective investigation into cancer and nutrition (EPIC)-potsdam study [J]. Diabetes, 2003, 52(3):812-817.
[10] Hu FB, Meiqs JB, Li TY, et al. Inflammatory markers and risk of developing type 2 diabetes in women [J]. Diabetes, 2004, 53(3):693-700.
[11] Nakamura T, Kawagoe Y, Oqawa H, et al. Effect of low-density lipoprotein apheresis on urinary protein and podocyte excretion in patients with nephritic syndrome due to diabetic nephropathy [J]. Am J Kidney Dis, 2005, 45(1):48-53.
[12] 陈燕铭,王一娜,钟毅敏,等.2型糖尿病视网膜病变患者血清炎症因子和脂联素水平的变化[J].中国病理生理杂志,2011,27(6):1154-1158.
[13] 陈祥攀,杨解人,郝 伟,等.红杉醇对2型糖尿病大鼠肝脏炎症损伤的保护作用[J].中国病理生理杂志,2013,29(4):632-636.
[14] Karikó K, Weissman D, Welsh FA. Inhibition of Toll-like receptor and cytokine signaling: a unifying theme in ischemic tolerance [J]. J Cereb Blood Flow Metab, 2004, 24(11):1288-1304.
[15] Goodyear LJ, Kahn BB. Exercise, glucose transport, and insulin sensitivity [J]. Annu Rev Med, 1998, 49:235-261.
[16] 郭啸华,刘志红,李 恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10(5):290-294.
[17] Calcutt NA, Dines KC, Cessena RM. Effects of the peptide HP228 on nerve disorders in diabetic rats [J]. Metabolism, 1998, 47(6):650-656.
[18] Kalichman MW, Dines KC, Bobik M, et al. Nerve conduction velocity, laser Doppler flow, and axonal caliber in galactose and streptozotocin diabetes [J]. Brain Res, 1998, 810(1-2):130-137.
[19] Balducci S, Lacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy [J]. J Diabetes Complications, 2006, 20(4):216-223.
[20] 张海峰,何玉秀,陈玉娟,等.肿瘤坏死因子α和脂联素在运动改善胰岛素抵抗中的作用[J].中国运动医学杂志,2010,29(3):367-371.
[21] Martins RA, Neves AP, Coelho-Silva MJ, et al. The effect of aerobic versus strength-based training on high-sensitivity C-reactive protein in older adults [J]. Eur J Appl Physiol, 2010, 110(1):161-169.
[22] Church TS, Earnest CP, Thompson AM, et al. Exercise without weight loss does not reduce C-reactive protein: the INFLAME study [J]. Med Sci Sports Exerc, 2010, 42(4):708-716.
[23] Donges CE, Duffield R, Drinkwater EJ. Effects of resis-tance or aerobic exercise training on interleukin-6, C-reactive protein, and body composition [J]. Med Sci Sports Exerc, 2010, 42(2):304-313.
[24] Sloan RP, Shapiro PA, Demeersman RE, et al. Aerobic exercise attenuates inducible TNF production in humans [J]. J Appl Phy-siol, 2007, 103(3):1007-1011.
[25] Kadoglou NP, Lliadis F, Angelopoulou N, et al. The anti-inflammatory effects of exercise training in patients with type 2 diabetes mellitus [J]. Eur J Cardiovasc Prev Rehabil, 2007, 14(6):837-843.
[26] O’Leary VB, Marchetti CM, Krishnan RK, et al. Exercise-induced reversal of insulin resistance in obese elderly is associated with reduced visceral fat [J]. J Appl Phy-siol, 2006, 100(5):1584-1589.
[27] Kelley GA, Kelley KS. Effects of aerobic exercise on C-reactive protein, body composition, and maximum oxygen consumption in adults: a meta-analysis of randomized controlled trials [J]. Metabolism, 2006, 55(11):1500-1507.
[28] You T, Berman DM, Ryan AS, et al. Effects of hypocaloric diet and exercise training on inflammation and adipocyte lipolysis in obese postmenopausal women [J]. J Clin Endocrinol Metab, 2004, 89(4):1739-1746.

