阿托伐他汀对糖尿病大鼠急性心肌梗死后心功能及HGF/c-Met信号通路的影响*
严广东, 李自成, 李健豪, 张在勇, 赵善隽, 张稳柱△
(1广州市番禺区中心医院心内科, 广东 广州 511400;2暨南大学第一附属医院心内科, 广东 广州 510630)
急性心肌梗死(acute myocardial infarction, AMI)及继发的心力衰竭严重威胁着人们的生活质量和生命健康,尤其是伴有糖尿病者。糖尿病(diabetes mellitus, DM)人群中急性心肌梗死及继发心力衰竭、猝死的发生率明显增加,其AMI预后明显不及非糖尿病者[1-2]。研究表明,AMI后心功能的恶化主要与心肌纤维化、心肌细胞凋亡等所致的心室重构有关,且心肌细胞凋亡与心室重构间可相互加重[3]。他汀类药物是指南强烈推荐的调脂药,其不仅具有调脂作用,还具有抑制炎症反应和氧化应激、改善血管内皮功能、稳定动脉粥样硬化斑块等多种独立于调脂作用外的“多效性”[4-5]。近年来,有临床研究及动物实验显示,他汀类药物可以抑制AMI后心室重构及心功能恶化[6],而以往研究大多针对于非糖尿病,目前涉及糖尿病AMI后心肌细胞凋亡、心室重构及心功能能否从他汀干预中获益的研究较少。其实,他汀类药物改善心功能的具体机制尚不明确,肝细胞生长因子(hepatocyte growth factor, HGF)通路是影响心肌纤维化、细胞凋亡及心室重构关键的信号通路之一。既往研究显示,HGF不仅表达于肝脏,其在心脏、肾脏均有表达,可通过作用其心脏上的受体c-Met,发挥抗炎、抗心肌纤维化、抗心肌细胞凋亡及促血管再生等作用,改善心室重构及心功能[7]。然而,他汀类药物对AMI后心室重构及心功能的影响是否与HGF/c-Met信号通路有关,既往未见报道。本研究将观察他汀类药物对糖尿病大鼠AMI后心肌细胞凋亡、心室重构及心功能的影响,并探讨其作用是否与 HGF/c-Met信号通路有关。
材 料 和 方 法
1 材料
1.1动物 清洁级雄性Sprague-Dawley(SD)大鼠(8周龄,体重200~250 g)70只,由广东省医学实验动物中心提供,许可证号为SCXK(粤)2008-0002。
1.2主要试剂与仪器 链脲霉素(streptozotocin,STZ)购自上海宝曼生物科技有限公司;末端脱氧核糖核酸转移酶介导的dUTP切口末端标记法(TUNEL)试剂盒购自Roche;抗HGF多克隆抗体、抗c-Met多克隆抗体购自SAB;HGF及c-Met实时荧光定量PCR(real-time PCR)逆转录引物购自上海GenePharm公司,cDNA试剂盒购自Fermentas;Philip公司ATL-HDI5000多普勒心脏彩超仪。
2 方法
2.1建立链脲霉素诱导的糖尿病大鼠模型 采用一次性腹腔内注射STZ法(65 mg/kg,溶于0.1 mmol/L、pH 4.5的柠檬酸钠缓冲液)制备1型糖尿病大鼠模型。于STZ注射后3 d、7 d、30 d和8周时,用便携式血糖仪(拜耳公司)检测血糖。血糖≥16.7 mmol/L,具有多尿、多饮、多食、消瘦及毛色灰暗的大鼠入选本研究。血糖不达标,即<16.7 mmol/L的大鼠从本研究中剔除。
2.2急性心肌梗死大鼠模型的建立及分组 诱导糖尿病后8周时,对糖尿病大鼠构建急性心肌梗死模型。假手术组11只仅在相应左冠状动脉部位处穿线但不结扎。AMI术后存活32只大鼠随机分为2组:AMI对照组(n=16)和阿托伐他汀干预组(n=16, 20 mg·kg-1·d-1)。于术后24 h始,阿托伐他汀干预组予以相应剂量阿托伐他汀(立普妥,辉瑞公司)溶于3 mL生理盐水中灌胃,AMI对照组和假手术组均予以等量生理盐水灌胃,治疗时间共计2周。
2.3心脏彩超检测 治疗2周后,大鼠经10%水合氯醛(3 mL/kg)腹腔注射麻醉后,采用ATL-HDI5000多普勒心脏彩超仪(10 MHz探头)测定左室射血分数(left ventricular ejection fraction, LVEF)、左室长轴缩短分数(fractional shortening, FS)、左室舒张末期内径(left ventricular end-diastolic diameter, LVDd)和左室收缩末期内径(left ventricular end-systolic diameter, LVDs),取5个连续心动周期的平均值。
2.4血脂的检测 心脏彩超检测完成后,即刻对麻醉大鼠开胸,暴露心脏经心室取血3 mL,分离血清(KDC-160HR离心机,4 ℃ 4 000 r/min离心10 min),使用全自动生化分析仪检测甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)。
2.5心肌组织标本采集 采血完成后,取出心脏去除心房,沿心脏长轴将左心室分为两部分,靠近心尖一侧心肌制作病理切片,用于形态学检测(HE染色和Masson染色)、心肌细胞凋亡检测及免疫组化检测;余下部分去除梗死区域后置于-80 ℃液氮中,用于real-time PCR检测。
2.6病理切片分析
2.6.1HE染色和Masson染色 (1)HE染色:观察糖尿病大鼠心肌梗死后心肌组织病理学改变;(2)Masson染色:可将胶原纤维染成蓝色、心肌纤维染成红色,在光学显微镜下(×100)随机选取5个梗死周边区视野进行观察,采用Image-Pro Plus 6.0图像分析软件进行分析,测定心肌胶原容积分数(collagen volume fraction, CVF),即胶原面积/(胶原面积+心肌面积)。
2.6.2心肌细胞凋亡的检测 采用TUNEL标记法标记心肌细胞凋亡,光镜下观察正常细胞核呈蓝色,凋亡细胞核呈深浅不一的颗粒状棕黄色,即为阳性反应。凋亡细胞的半定量分析:在400倍光镜下,每张切片计数5个视野中阳性细胞核数/总细胞核数,取其平均值作为心肌细胞凋亡指数(apoptotic index)。
2.6.3免疫组化检测心肌组织中HGF和c-Met蛋白的表达 抗HGF多克隆抗体稀释度为1∶100,抗c-Met多克隆抗体稀释度为1∶150,阳性产物为棕黄色。应用Image-Pro Plus 6.0图像分析软件,随机选取5个视野(×200)以求出积分吸光度值(integral absorbance,IA),各组间的蛋白表达采用IA值进行统计。
2.7Real-time PCR检测心肌组织中HGF和c-Met mRNA的表达 采用Trizol法提取心肌组织中的总RNA,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参照。HGF上游引物5′-GAGAGAGGCGAGGAGAAACG-3′,下游引物5′-GTGTAGCCCCAGCCGTAAAT-3′;c-Met上游引物5′-ACGTACGGTGTCTCCAGCAT-3′,下游引物5′-CTGGAGACACAGGATAGGAA-3′;GAPDH上游引物5′-CTCAGTTGCTGAGGAGTCCC-3′,下游引物5′-ATTCGAGAGAAGGGAGGGCT-3′。合成cDNA后,在R1011122 Rotor-Gene 荧光定量PCR仪上进行实时定量PCR。反应结束后,以目的基因的拷贝数/内参照的拷贝数为各基因的相对表达量进行统计。
3 统计学处理
数据用均数±标准差(mean±SD)表示,利用SPSS 13.0软件统计。组间差异采用单因素方差分析,方差齐时组间多重比较用LSD检验,方差不齐时用Dunnett’s T3检验分析。以P<0.05为差异有统计学意义。
结 果
AMI后2周,各组存活大鼠:假手术组9只,AMI对照组10只,阿托伐他汀干预组12只。存活大鼠进行心脏彩超、组织学、HGF和c-Met mRNA及蛋白检测。
1 各组大鼠心功能的比较
大鼠心脏彩超检测,AMI对照组及阿托伐他汀干预组大鼠LVEF和FS明显低于假手术组(P<0.05),LVDd和LVDs明显高于假手术组(P<0.05),说明实验AMI模型构建成功;阿托伐他汀干预组大鼠LVEF和FS高于AMI对照组,LVDd和LVDs低于AMI对照组,差异均有统计学意义(P<0.05),见图1、表1。

Figure 1. Echocardiography of rats from different groups. A: sham; B: AMI; C: AMI+atorvastatin.

表1 各组大鼠心脏彩超检测参数的比较
2 各组大鼠血糖、血脂的比较
2周后3组糖尿病大鼠体重、血糖及血脂水平变化如表2所示,各组间体重、血糖及各项血脂水平差异无统计学意义(P>0.05)。
3 心肌组织病理学改变
HE染色显示,假手术组大鼠心肌细胞排列规则,走向好,无肌丝断裂,细胞间隙均匀,少量炎症细胞浸润;AMI对照组具有明显较大面积的梗死区,心肌细胞显著减少、肌丝断裂、结构紊乱,有大量炎症细胞浸润;阿托伐他汀干预组与AMI对照组比较,其心肌细胞变性减少、结构紊乱减轻及炎症细胞浸润明显减少,见图2。
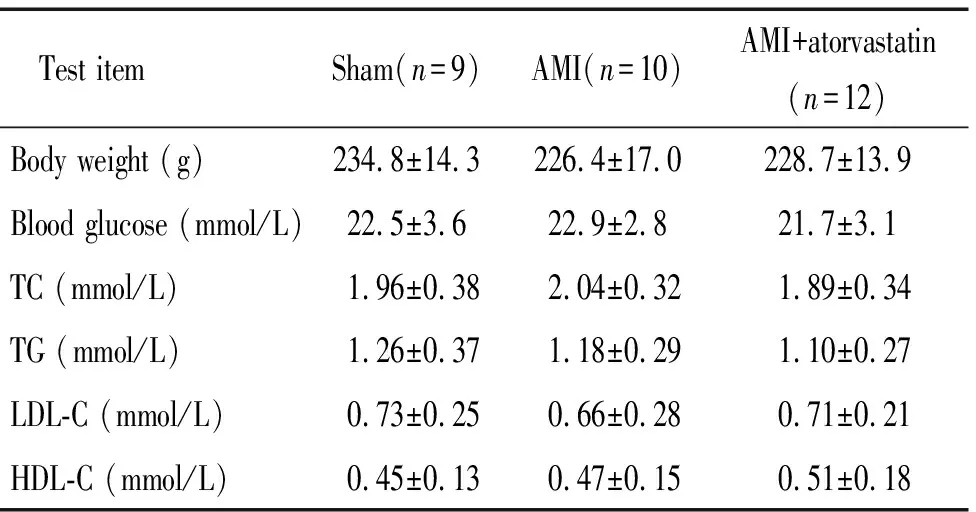
表2 各组大鼠体重、血糖、血脂水平的比较
Masson染色结果显示,AMI对照组及阿托伐他汀干预组发生心肌纤维化程度均较假手术组明显,但阿托伐他汀干预组的心肌纤维化的程度较AMI对照组明显减轻(P<0.05),见图2。各组的CVF值见图2。
4 心肌细胞的凋亡
TUNEL检测结果显示,假手术组见少量心肌细胞凋亡,AMI对照组和阿托伐他汀干预组心肌细胞凋亡均较假手术组明显,他汀干预组心肌细胞凋亡较AMI对照组明显减轻(P<0.05),TUNEL染色图及各组心肌细胞凋亡指数见图3。
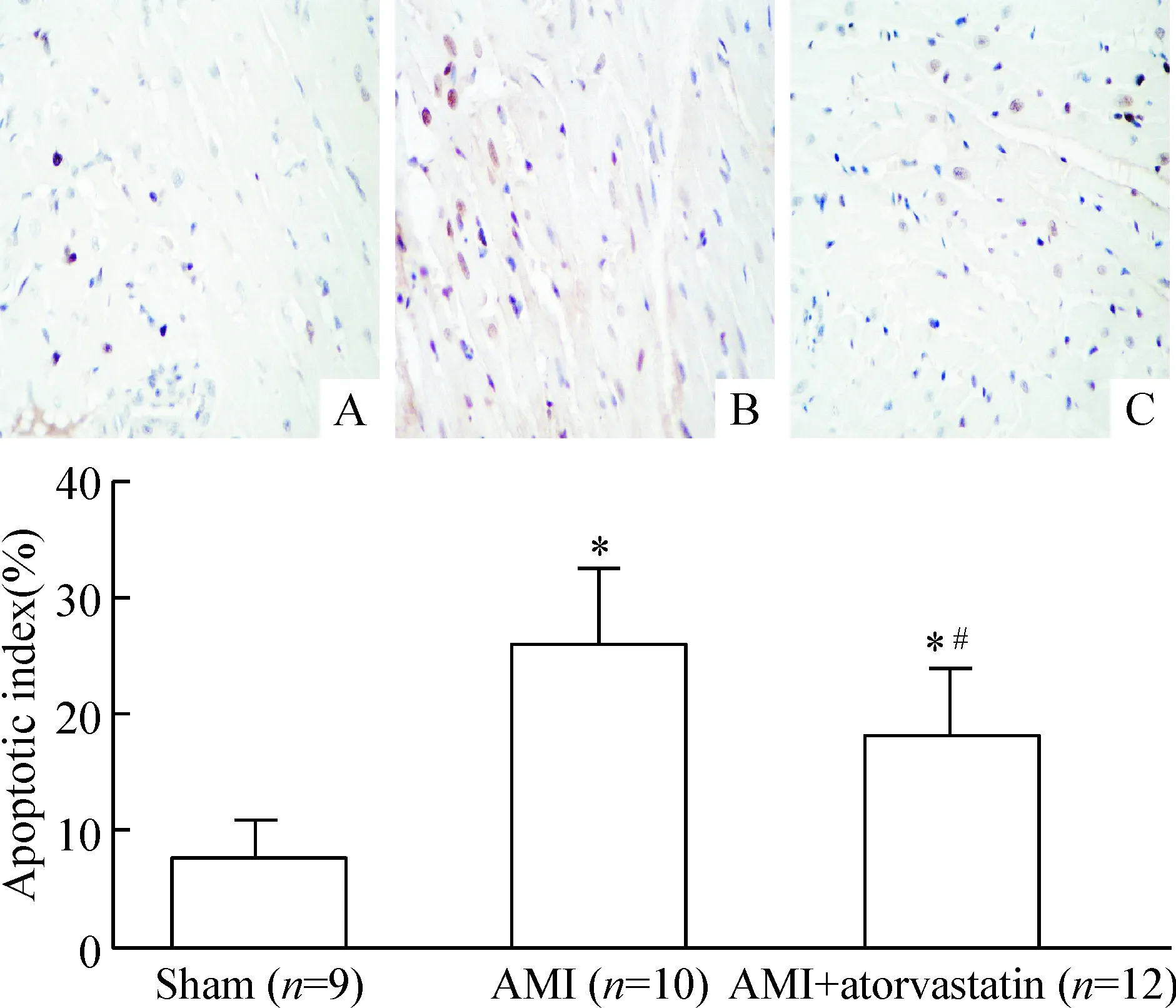
Figure 3. TUNEL staining (×400) of the myocardial tissue (the upper figure) and comparison of myocardial apoptotic index among the 3 groups (the lower fi-gure). A: sham; B: AMI; C: AMI+atorvastatin. Mean±SD. *P<0.05 vs sham; #P<0.05 vs AMI.
5 心肌组织中HGF及c-Met mRNA表达的比较
采用real-time PCR检测心肌组织中HGF及c-Met mRNA表达情况,结果显示,AMI对照组及阿托伐他汀干预组均显著高于假手术组(P<0.05), 阿托伐他汀干预组的HGF及c-Met mRNA表达高于AMI对照组,差异有统计学意义(P<0.05),见图4。
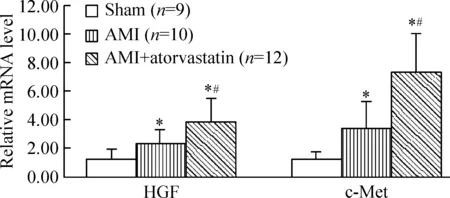
Figure 4. Comparison of HGF and c-Met mRNA among the 3 groups. Mean±SD. *P<0.05 vs sham; #P<0.05 vs AMI.
6 心肌组织中HGF及c-Met蛋白表达的比较
免疫组化检测心肌组织中HGF及c-Met蛋白表达情况如图5所示,AMI对照组及阿托伐他汀干预组均显著高于假手术组(P<0.05), 阿托伐他汀干预组的HGF及c-Met蛋白表达高于AMI对照组,差异有统计学意义(P<0.05)。

Figure 5. Immunohistochemical staining of HGF (A1, B1 and C1) and c-Met (A2, B2 and C2) in the myocardial tissue (×200). A1, A2: sham; B1, B2: AMI; C1, C2: AMI+atorvastatin. Mean±SD. *P<0.05 vs sham; #P<0.05 vs AMI.
讨 论
糖尿病AMI后心功能恶化会进一步加剧,Bäcklund等[8]研究显示,糖尿病促进了AMI后心肌细胞凋亡、心肌纤维化及结缔组织生长因子高度表达等,以致加重AMI后的心脏重构。我们的实验结果显示:糖尿病大鼠AMI阿托伐他汀治疗2周后,与对照组比较,阿托伐他汀干预组心肌纤维化、心肌细胞凋亡、心脏重构及心功能均显著改善(P<0.05)。提示阿托伐他汀可显著改善糖尿病AMI后心肌细胞凋亡、心脏重构及心功能,也进一步说明他汀类药物不单纯是一种调脂药,应为更全面的 “心血管领域用药”。既往有研究报道,他汀类药物可能会诱发甚至加重糖尿病[9],但结合实验及临床综合分析,他汀类药物的利仍远大于弊,在心血管领域应广泛推广。
他汀类药物抑制AMI后心室重构的机制目前仍不明确。既往研究发现HGF不仅存在肝脏,在心脏、肾脏、脑等组织均有一定表达,且对心脏及肾脏均具有重要的保护作用。HGF实际是间质细胞衍生的一种能促进细胞有丝分裂的多功能因子,是由α链和β链组成的异二聚体;其受体为原癌基因c-Met,α链先与c-Met结合,继而β链与之结合,并诱导c-Met受体酪氨酸磷酸化,从而发挥其生物学活性[10]。
Guo等[11]通过研究AMI大鼠的治疗,发现HGF能通过抑制心肌细胞凋亡和促进血管再生,明显改善心室重构和心脏功能。Komamura等[12]在高血压病大鼠治疗中,发现HGF可改善高血压及相应的动脉硬化和心力衰竭。实际,HGF信号通路在心血管药物的作用机制中也扮演着重要的作用[13]。临床研究发现,AMI病人血液中HGF水平会升高,且与心室重构及心功能具有相关性,其值越高表示预后越差[14];同时也是AMI后最早的心肌损伤标志物之一。可见HGF/c-Met信号通路已成为心脏的一种重要保护机制,然而他汀类药物对AMI后心脏重构的影响是否与HGF/c-Met通路有关,目前仍未见相关报道。本实验结果显示:(1) AMI对照组HGF及c-Met的mRNA及蛋白表达显著高于假手术组(P<0.05),提示HGF/c-Met信号通路在AMI后显著激活;(2)阿托伐他汀干预组HGF及c-Met的mRNA及蛋白表达较AMI对照组显著上调(P<0.05),提示阿托伐他汀可通过增强HGF/c-Met通路,以改善AMI后心功能,发挥其AMI后心脏保护作用。
本研究为AMI后心力衰竭的研究扩展思路,可考虑采用HGF基因治疗。目前,已有一些探索,在AMI细胞移植治疗中,发现转染HGF的移植细胞能更佳地改善AMI后心脏重构及心功能[15]。Yuan等[16]采用微型气泡运载HGF治疗AMI,发现可降低左室重量、心肌胶原含量及增加毛细血管密度。既往研究[17]发现,在动脉硬化性肾血管性疾病中,辛伐他汀可通过增加肾脏中HGF表达,抑制肾纤维化改善肾功能;Cantoni等[18]发现人间充质干细胞经瑞舒伐他汀干预后, HGF及其受体表达增加;可见以上研究与本研究结果具有一定的一致性。体外细胞培养发现他汀可降低小鼠骨肉瘤细胞的HGF分泌[19],说明他汀类药物对不同组织细胞在不同病理状态下HGF表达的影响不完全一致。
他汀类药物影响HGF通路的机制尚不明确。研究显示血管紧张素II(angiotensin II, Ang II)和转化生长因子(transforming growth factor, TGF)是HGF产生的重要抑制剂[20],心力衰竭及AMI后Ang II及TGF表达会明显增加,在一定程度上会对HGF产生起下调作用;有研究[21]已报道他汀类药物可明显抑制AMI后Ang II及TGF的增加,进而促进HGF表达进一步上调。当然他汀影响HGF通路的具体机制究竟如何,可能仍需进一步研究。
[参 考 文 献]
[1] Shiomi T, Tsutsui H, Ikeuchi M, et al. Streptozotocin-induced hyperglycemia exacerbates left ventricular remodeling and failure after experimental myocardial infarction[J]. J Am Coll Cardiol, 2003, 42(1):165-172.
[2] 裴汉军, 宋光远, 吴永健, 等. 糖尿病在糖尿病大鼠心肌梗死后心力衰竭形成中的效应[J]. 中国病理生理杂志, 2009, 25(6):1051-1058.
[3] Hojo Y, Saito T, Kondo H. Role of apoptosis in left ventricular remodeling after acute myocardial infarction[J]. J Cardiol, 2012, 60(2):91-92.
[4] Sadowitz B, Maier KG, Gahtan V. Basic science review: Statin therapy--Part I: The pleiotropic effects of statins in cardiovascular disease[J]. Vasc Endovascular Surg, 2010, 44(4):241-251.
[5] Swenne CA. Beyond lipid lowering: pleiotropic effects of statins in heart failure[J]. Neth Heart J, 2013, 21(9):406-407.
[6] Ducharme A, Rouleau JL. Do statins prevent heart failure in patients after myocardial infarction?[J]. Curr Heart Fail Rep, 2004, 1(4):156-160.
[7] Sala V, Crepaldi T. Novel therapy for myocardial infarction: can HGF/Met be beneficial?[J]. Cell Mol Life Sci, 2011, 68(10):1703-1717.
[8] Bäcklund T, Palojoki E, Saraste A, et al. Sustained cardiomyocyte apoptosis and left ventricular remodelling after myocardial infarction in experimental diabetes[J]. Diabetologia, 2004, 47(2):325-330.
[9] Wang KL, Liu CJ, Chao TF, et al. Statins, risk of diabetes, and implications on outcomes in the general population[J]. J Am Coll Cardiol, 2012, 60(14):1231-1238.
[10] Matsumoto K, Kataoka H, Date K, et al. Cooperative interaction between alpha- and beta-chains of hepatocyte growth factor on c-Met receptor confers ligand-induced receptor tyrosine phosphorylation and multiple biological responses[J]. J Biol Chem, 1998, 273(36):22913-22920.
[11] Guo Y, He J, Wu J, et al. Locally overexpressing hepatocyte growth factor prevents post-ischemic heart failure by inhibition of apoptosis via calcineurin-mediated pathway and angiogenesis[J]. Arch Med Res, 2008, 39(2):179-188.
[12] Komamura K, Miyazaki J, Imai E, et al. Hepatocyte growth factor gene therapy for hypertension[J]. Methods Mol Biol, 2008, 423:393-404.
[13] Kusunoki H, Taniyama Y, Rakugi H, et al. Cardiac and renal protective effects of irbesartan via peroxisome proliferator-activated receptor γ-hepatocyte growth factor pathway independent of angiotensin II Type 1a receptor blockade in mouse model of salt-sensitive hypertension[J]. J Am Heart Assoc, 2013, 2(2):e000103.
[14] Lamblin N, Bauters A, Fertin M, et al. Circulating levels of hepatocyte growth factor and left ventricular remodelling after acute myocardial infarction (from the REVE-2 study) [J]. Eur J Heart Fail, 2011, 13(12):1314-1322.
[15] Wang S, Qin X, Sun D, et al. Effects of hepatocyte growth factor overexpressed bone marrow-derived mesenchymal stem cells on prevention from left ventricular remodelling and functional improvement in infarcted rat hearts[J]. Cell Biochem Funct, 2012, 30(7):574-581.
[16] Yuan QY, Huang J, Li XJ, et al. Transendocardial delivery of HGF via microbubbles and ultrasound to treat acute myocardial infarction[J]. Curr Gene Ther, 2013, 13(1):31-38.
[17] Chade AR, Zhu XY, Grande JP, et al. Simvastatin abates development of renal fibrosis in experimental renovascular disease[J]. J Hypertens, 2008, 26(8):1651-1660.
[18] Cantoni S, Cavallini C, Bianchi F, et al. Rosuvastatin elicits KDR-dependent vasculogenic response of human placental stem cells through PI3K/AKT pathway[J]. Pharmacol Res, 2012, 65(3):275-284.
[19] Tsubaki M, Yamazoe Y, Yanae M,et al. Blockade of the Ras/MEK/ERK and Ras/PI3K/Akt pathways by statins reduces the expression of bFGF, HGF, and TGF-β as angiogenic factors in mouse osteosarcoma[J]. Cytokine, 2011, 54(1):100-107.
[20] Nakano N, Morishita R, Moriguchi A, et al. Negative regulation of local hepatocyte growth factor expression by angiotensin II and transforming growth factor-beta in blood vessels: potential role of HGF in cardiovascular disease[J]. Hypertension, 1998, 32(3):444-451.
[21] Ma S, Ma CC. Recent development in pleiotropic effects of statins on cardiovascular disease through regulation of transforming growth factor-beta superfamily[J]. Cytokine Growth Factor Rev, 2011, 22(3):167-175.

