转录因子CDX2过表达对人胃癌SGC-7901细胞增殖和细胞周期的影响*
曹稳珑, 韦尉元, 张笑石, 罗 文, 严林海, 谢玉波, 肖 强△
(广西医科大学第一附属医院 1胃肠腺体外科, 2麻醉科, 广西 南宁 530021)
胃癌是消化系统最常见的恶性肿瘤之一,在世界范围内,胃癌位居肿瘤死亡的第2位[1],而胃癌的发生发展是一个多因素相互作用的过程。近年来,关于肿瘤发生的分子机制研究表明,恶性肿瘤细胞的最基本特征是细胞的失控性增殖,而细胞失控性增殖的根本原因就是细胞周期调控机制的破坏,细胞凋亡驱动机制的破坏。而CDX2是肠道特异性尾型同源异型盒转录因子家族中成员之一,其突变、转录水平下降或者异位表达均有可能促成癌前病变甚至肿瘤的发生发展[2]。我们前期通过构建CDX2过表达真核质粒载体,发现其在体内体外环境下对胃癌MGC-803细胞的生长均具有抑制作用[3-4],但机制尚不十分明确。细胞凋亡是由凋亡基因进行调控的,细胞凋亡与细胞增殖、细胞周期密切相关[5]。慢病毒载体以其转染效率高且稳定等优点,现已被作为目的基因的理想载体,为了进一步验证我们前期实验,本实验通过重组慢病毒颗粒介导CDX2过表达转染人胃癌SGC-7901细胞,观察CDX2过表达后对人胃癌SGC-7901细胞增殖及其周期产生的影响,并进一步检测凋亡相关蛋白Bax、Bcl-2、cyclin D1和survivin的表达情况,从而深入探讨其可能的作用机制,旨在为胃癌治疗研究探索新的途径。
材 料 和 方 法
1 材料
含CDX2基因的重组慢病毒颗粒由上海Genechem公司构建;细胞周期试剂盒购自南京凯基生物技术有限公司;CCK-8试剂盒由碧云天公司提供;兔抗人Ⅰ抗HA抗体购自CST;羊抗兔Ⅱ抗IgG抗体购自LI-COR;人胃癌SGC-7901细胞购自科学院细胞库(上海);Trizol 试剂购自Invitrogen;逆转录试剂盒购自上海生工生物公司;细胞培养基RPMI-1640及胎牛血清购自Gibco。
2 方法
2.1细胞培养与基因转染 人胃癌SGC-7901细胞用含10%胎牛血清的DMEM培养液培养,在37 ℃、5% CO2的培养箱中培养。隔天细胞换液。取对数生长期的细胞接种于6孔板中(3.5×104cells/well),用不含抗生素含10%胎牛血清的DMEM培养液培养,观察待细胞融合度达40%~60%时,按慢病毒转染说明书操作,以CDX2过表达重组慢病毒颗粒(LV-CDX2-GFP)和对照慢病毒颗粒(LV-GFP)分别感染人胃癌SGC-7901细胞,作为实验组(LV-CDX2-GFP组)和阴性对照组(LV-GFP组);空白对照组的细胞不做任何处理,常规培养。待细胞长满孔板,常规消化收集细胞样本,进入下一步实验。
2.2细胞增殖活力检测 采用CCK-8法,分别将LV-CDX2-GFP细胞(实验组)、LV-GFP(阴性对照组)和未转染细胞(空白对照组)以每孔3×103个接种到96孔板中,每孔体积100 μL,每个样品设5个复孔。将细胞培养板移入CO2培养箱,在37 ℃、5% CO2及饱和湿度环境下培养,分别于0 h、24 h、48 h、72 h和96 h 后,每孔加CCK-8溶液10 μL呈色,在 37 ℃ CO2培养箱继续孵育1 h,终止培养,选择450 nm波长,在酶联免疫监测仪上测定各孔吸光度(A450值) 。
2.3流式细胞术检测细胞周期 取对数生长期细胞,倒去培养液,胰酶适度消化细胞,800 r/min 离心15 min 去上清,用 PBS 洗 2 次,加 0.5 mL PBS 吹匀,然后将细胞打入 5 mL 70% 乙醇(预冷) 中,封口膜封口,4 ℃ 固定过夜,用 0.4 mL PBS 重悬细胞并转至试管中轻轻吹打,加RNase-A,37 ℃水浴消化30 min; 用PI标记后室温避光染色30 min,300 目(孔径40~50 μm)尼龙网过滤,流式细胞术检测样品。
2.4RT-PCR检测人胃癌SGC-7901细胞CDX2、Bax、Bcl-2、cyclin D1和survivin mRNA表达 用Trizol法提取各组细胞的总RNA,按逆转录试剂盒说明逆转录获取cDNA, PCR 仪扩增。PCR各基因引物序列、相应退火温度及PCR产物片段大小见表1。反应条件:94 ℃预变性4 min;30个循环,94 ℃ 30 s,52~62 ℃ 30 s,72 ℃ 30 s;72 ℃ 5 min。取3 μL PCR产物经2%非变性琼脂糖凝胶电泳检测,凝胶成像获取图片经Quantity One 软件分析。以相对表达量(目的条带与内参GAPDH灰度值的比值)反映mRNA表达水平。
2.5Western blotting检测人胃癌SGC-7901细胞CDX2、Bax、Bcl-2、cyclin D1和survivin蛋白的表达 使用细胞裂解液提取各组细胞总蛋白,用BCA法测定蛋白含量。取100~125 μg蛋白在10%SDS-PAGE胶上电泳,后转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,用TBST配制5%脱脂奶分别加入兔抗人Bax、Bcl-2、cyclin D1和survivin抗体(1∶1 000),于常温孵育1.5 h;加入羊抗兔抗体IgG(1∶12 000),常温孵育30 min,红外荧光仪曝光显影,以GAPDH为内参照。
3 统计学处理
采用SPSS 16.0统计软件分析,计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 CDX2过表达对人胃癌SGC-7901细胞增殖的影响
采用CCK-8法测定了细胞培养 0 h、24 h、48 h、72 h和96 h 后的吸光度(A450值) ,结果显示LV-CDX2-GFP组24 h、48 h、72 h和96 h细胞的A450值明显低于LV-GFP组和空白对照组,差异有统计学意义(P<0.05);LV-GFP 组与空白对照组相比,差异无统计学意义 (P>0.05),见图1。
2 CDX2过表达对人胃癌SGC-7901细胞周期的影响
与 LV-GFP组和空白对照组相比,LV-CDX2-GFP组处于G0/G1期的细胞比例增加,而 S 期的细胞比例减少,差异有统计学意义(P<0.05);而LV-GFP 组与空白对照组相比,差异无统计学意义 (P>0.05),见表2。
3 CDX2过表达对人胃癌SGC-7901细胞CDX2、Bax、Bcl-2、cyclin D1和survivin mRNA表达量的影响
RT-PCR 结果表明,与LV-GFP组、空白对照组相比,LV-CDX2-GFP组中Bcl-2、cyclin D1和survivin mRNA表达水平均显著降低,CDX2和Bax mRNA表达水平均显著升高,差异有统计学意义(P<0.05);而LV-GFP组与空白对照组的CDX2、Bax、Bcl-2、cyclin D1和survivin mRNA表达量比较无显著差异(P>0.05),见表3。

表2 CDX2过表达对人胃癌SGC-7901细胞周期的影响
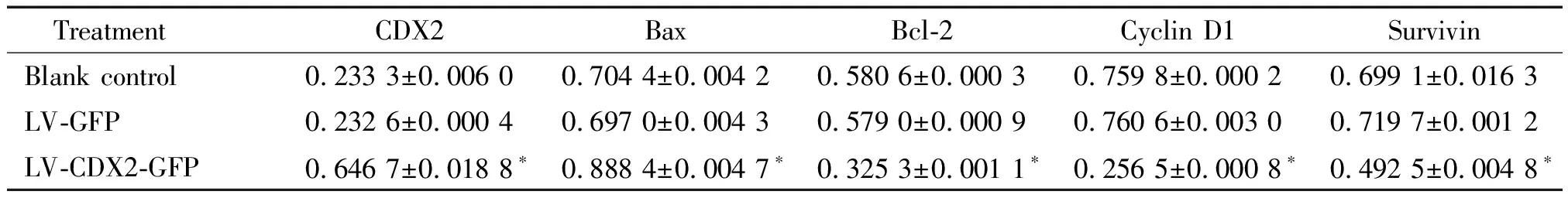
表3 各组细胞中凋亡相关基因mRNA的表达情况
4 CDX2过表达对人胃癌SGC-7901细胞CDX2、Bax、Bcl-2、cyclin D1和survivin蛋白表达量的影响
Western blotting结果表明,与LV-GFP组、空白对照组相比,LV-CDX2-GFP组中Bcl-2、cyclin D1和survivin蛋白表达水平均显著降低,CDX2和Bax 的蛋白表达水平均显著升高,差异均有统计学意义(P<0.05);LV-GFP组与空白对照组的CDX2、Bax、Bcl-2、cyclin D1和survivin 蛋白表达量比较无统计学差异(P>0.05),见表4。

表4 各组细胞中凋亡相关基因的蛋白表达情况
讨 论
胃癌是最常见的消化道恶性肿瘤,随着诊疗水平的不断改善,早期胃癌患者的生存率大幅度提高,但是晚期胃癌患者的预后仍不理想[6]。基因治疗已成为肿瘤治疗研究的新领域,选择基因作为靶向治疗是国内外研究的热点[7]。CDX2为同源盒基因Hox家族成员之一,是人体中肠道特异性表达的转录因子,对维护胃肠道细胞的正常形态起着重要作用。我们前期体外研究发现,转录因子CDX2过表达可以抑制胃癌细胞MGC-803的增殖,阻断细胞进入S期[4];同时,发现CDX2过表达抑制裸鼠人胃癌移植瘤的生长[3],但机制尚不明确。
慢病毒载体是一类逆转录病毒载体,以其转染效率高,可感染分裂期和非分裂期细胞,可容纳较大的基因片段等优点,现已被作为目的基因的理想载体,适用于体内外基因研究。为进一步验证前期实验,在本研究中,我们以CDX2过表达重组慢病毒颗粒瞬时转染人胃癌SGC-7901细胞,旨在揭示CDX2过表达对胃癌细胞的生物学作用。经CCK-8与流式细胞术检测发现,慢病毒介导的CDX2过表达抑制人胃癌SGC-7901细胞增殖,阻滞细胞周期从G1期向S期过度,与我们前期实验结果一致。
细胞凋亡与细胞增殖、细胞周期密切相关,凋亡性细胞死亡是一个细胞周期事件[5]。近年来研究发现,阻断或激活凋亡相关蛋白Bax、Bcl-2、cyclin D1和survivin将直接或间接抑制细胞增殖,诱导细胞凋亡[8-10]。研究表明CDX2过表达能够增加p53的表达[11],同时p53表达上调能抑制IL-6的转录活性,进而抑制IL-6/STAT3通路的信号转导[12]。而STAT3表达下调通过改变其下游Bax、Bcl-2、cyclin D1和survivin的表达引起细胞生物学变化[13]。Hattori等[14]在阻断STAT3通路后发现,STAT3下调引起Bax上调和Bcl-2下调。而Bcl-2与Bax蛋白表达量的比率决定异二聚体(Bcl-2/Bax) 与同源二聚体(Bax/Bax)的比值, Bax同源二聚体占优势时, 细胞易于在诱导剂的作用下发生凋亡,从而抑制其生长。Cyclin D1作为细胞周期核因子,促使细胞由G1期向S期转变促进增殖,而Huang等[15]研究发现,阻断STAT3 可以抑制cyclin D1蛋白的表达,抑制细胞DNA的合成,从而阻止细胞从G1期进入S期。Chen等[16]应用STAT3显性负性突变体阻断STAT3通路后STAT3及survivin表达同步下调,survivin表达缺失,有丝分裂过程中染色质分离错误,从而启动细胞周期中的自动检查机制促发异常的细胞凋亡,抑制细胞增殖。本实验结果表明,CDX2过表达使胃癌细胞Bcl-2、survivin和cyclin D1表达下调,Bax表达上调。据此我们推测CDX2过表达极可能通过调控p53,从而间接调控IL-6/STAT3通路,进而对细胞凋亡周期相关蛋白Bax、Bcl-2、cyclin D1和survivin产生影响,从而发挥对胃癌细胞的抑制作用。
综上所述,转录因子CDX2在体内外具有抑制胃癌细胞增殖的作用,其机制可能是CDX2过表达通过阻断IL-6/STAT3通路进而抑制Bcl-2、cyclin D1和survivin的表达,促进Bax表达。这提示CDX2基因在胃癌的发生发展中扮演着抑癌基因的角色,为胃癌的诊断和治疗提供了新的靶点。然而,细胞生长周期调控环节极为复杂,是否有其它因素参与调控呢?这有待我们进一步研究来明确。
[参 考 文 献]
[1] Griffiths EA, Pritchard SA, Welch IM, et al. Is the hypoxia-inducible factor pathway important in gastric cancer?[J]. Eur J Cancer, 2005, 41(18):2792-2805.
[2] Wang XT, Wei WY, Kong FB, et al. Prognostic significance of Cdx2 immunohistochemical expression in gastric cancer:a meta-analysis of published literatures[J]. J Exp Clin Cancer Res, 2012, 31:98.
[3] 廉 超, 王晓通, 谢玉波, 等. CDX2过表达对裸鼠人胃癌移植瘤生长和转移的影响[J]. 肿瘤防治研究, 2012, 39(4):400-402.
[4] Xie Y, Li L, Wang Xt, et al. Overexpression of Cdx2 inhibits progression of gastric cancerinvitro[J]. Int J Oncol, 2010, 36(2):509-516.
[5] 彭 波, 陶德定, 冯永东, 等. 细胞凋亡与细胞增殖协同作用的研究[J]. 中华肿瘤防治杂志, 2009, 16(15):1121-1124.
[6] 张彩凤, 夏永华, 李贞娟, 等. Stathmin siRNA抑制人胃癌SGC-7901细胞裸鼠移植瘤的生长并诱导细胞凋亡[J]. 中国病理生理杂志, 2012, 28(7):1253-1257.
[7] 嵇晓辉, 范秉琳, 张红鸽, 等. MicroRNA-100对肝癌细胞增殖活力和细胞周期的影响[J]. 中国病理生理杂志, 2013, 29(1):108-111.
[8] Datta SR, Ranger AM, Lin MZ, et al. Survival factor-mediated BAD phosphorylation raises the mitochondrial threshold for apoptosis[J]. Dev Cell, 2002, 3(5): 631-643.
[9] Lukas J, Bartek J, Strauss M. Efficient transfer of antibodies into mammalian cells by electroporation[J]. J Immunol Methods, 1994, 170(2):255-259.
[10] 郭 鹏, 沈维高, 赵丽晶, 等. Survivin-siRNA真核重组质粒对前列腺癌移植瘤的抑制作用[J]. 中国病理生理杂志, 2012, 28(12):2178-2181.
[11] Baba Y, Nosho K, Shima K, et al. Relationship of CDX2 loss with molecular features and prognosis in colorectal cancer[J]. Clin Cancer Res, 2009, 15(14):4665-4673.
[12] Goldman A, Chen HDR, Roesly HB, et al. Characterization of squamous esophageal cells resistant to bile acids at acidic pH: implication for Barrett′s esophagus pathogenesis[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 300(2): G292-G302.
[13] Bao GQ, Shen BY, Pan CP, et al. Andrographolide causes apoptosis via inactivation of STAT3 and Akt and potentiates antitumor activity of gemcitabine in pancreatic cancer[J]. Toxicol Lett, 2013, 222(1): 23-35.
[14] Hattori R, Maulik N, Otani H, et al. Role of STAT3 in ischemic preconditioning[J]. J Mol Cell Cardiol, 2001, 33(11): 1929-1936.
[15] Huang M, Page C, Reynolds RK, et al. Constitutive activation of Stat 3 oncogene product in human ovarian carcinoma cells[J]. Gynecol Oncol, 2000, 79(1):67-73.
[16] Chen CL, Hsieh FC, Lieblein JC, et al. Stat3 activation in human endometrial and cervical cancers[J]. Br J Cancer, 2007, 96(4):591-599.

