胡黄连苷Ⅱ对大鼠脑缺血损伤后髓鞘碱性蛋白表达的影响*
赵 丽, 郭云良
(青岛大学附属医院脑血管病研究所,山东 青岛 266003)
髓鞘碱性蛋白(myelin basic protein,MBP)是中枢神经系统中一种具有重要功能的髓鞘结构蛋白[1],位于髓鞘浆膜面,与髓鞘脂质紧密结合,利于稳定中枢神经系统髓鞘的结构和功能[2],且具有神经组织特异性[3]。MBP缺乏将会导致髓鞘形成障碍,其水平变化可以反映中枢神经系统的损伤及髓鞘损伤的严重程度[4],足量的MBP对于中枢神经系统功能的恢复非常重要[5]。动物实验证明[6],正常成年大鼠脑内有少量的MBP mRNA的表达,脑缺血损伤早期MBP mRNA[7]和MBP蛋白[8]表达降低,并且降低程度具有时间依赖性[9]。但随着缺血时间的推移,MBP mRNA的表达缓慢上升,在第7天表达明显高于损伤后第1天的表达量。段建刚等[10]研究表明,针刺治疗能上调MBP表达,促进髓鞘的再生。胡黄连苷Ⅱ的抗氧化、抗炎、抗凋亡作用已经得到证实[11-12],但具有神经保护作用的中药活性成分能否影响MBP表达水平,迄今尚未见报道。本课题组的前期工作从大鼠神经行为功能、脑梗死体积和免疫组化染色等方面,探讨胡黄连苷Ⅱ治疗脑缺血再灌注损伤剂量和时间窗,发现在脑缺血1.5 h,腹腔注射胡黄连苷Ⅱ 20 mg/kg时其脑保护作用最强[13-14]。鉴于神经行为学评价和免疫组化染色受主观因素影响较大,结果难免存在局限性。本次实验试图应用多种生物学方法定性及定量地检测脑组织中MBP表达水平及髓鞘的结构变化,深入探讨胡黄连苷Ⅱ治疗脑缺血损伤的作用及其最佳治疗剂量和时间窗。
材 料 和 方 法
1 动物模型
成年健康雄性SPF级Wistar大鼠200只,体重230~250 g,青岛市药物检验所实验动物中心提供[SCXK(鲁)20100010]。动物置实验室适应环境1周,自由进食、饮水;室温(23±2) ℃,自然光照。随机抽取5×3只为对照组,其余185只用于建立脑缺血模型。术前动物禁食12 h,经10%水合氯醛腹腔注射麻醉(3 mL/kg),仰卧固定、无菌操作,颈部正中切口,分离并结扎双侧经总动脉(bilateral common carotid artery occlusion,BCCAO)建立前脑缺血模型[15-16],术中保持动物肛温36~37 ℃。术后2 h仍未苏醒或死亡的26只动物剔除,成模共159只纳入统计范围。对照组大鼠不结扎双侧颈总动脉,其余操作同实验组。
2 设计分组和干预措施
将成功造模的159只动物随机分为模型组(5×3只)和治疗组(16×3×3只),治疗组按二因素四水平[L16(45)]正交试验设计原理分组。治疗时间窗为A因素,设缺血1.0 h、1.5 h、2.0 h和2.5 h 4个水平;治疗剂量为B因素,设5、10、20和40 mg/kg 4个水平。正交试验重复3次。
胡黄连苷Ⅱ,纯度>98%,分子式:C23H28O13,粉剂由天津奎青医药公司提供,按照大鼠体重秤取相应剂量的胡黄连苷Ⅱ粉剂,应用等渗盐水溶解稀释成1 mL溶液,按照[L16(45)]正交设计,在相应的缺血时间腹腔注射不同浓度的胡黄连苷Ⅱ溶液各1 mL。对照组和模型组与术后2 h腹腔注射等量等渗盐水。
3 标本采集
3.1石蜡切片 治疗后24 h,随机取对照组5只、模型组5只和治疗组16×3只大鼠,以10%水合氯醛3 mL/kg腹腔注射麻醉,经心脏依次灌注生理盐水200 mL和4%多聚甲醛200 mL,完整取脑,置4%甲醛溶液中固定2 h,蒸馏水浸泡4 h。常规梯度乙醇脱水、二甲苯透明、石蜡包埋,连续冠状切片,厚度5 μm,贴于多聚赖氨酸处理的载玻片上,4 ℃保存。
3.2总蛋白提取 治疗后24 h,随机取对照组5只、模型组5只和治疗组16×3只大鼠,麻醉后经心脏灌注生理盐水200 mL,开颅取脑,切取缺血脑组织200 mg,迅速置1.5 mL EP管中,按1∶4比例加细胞裂解液(500 μL裂解液+5 μL PMSF,No. P0013,碧云天生物技术研究所),超声波匀浆,4 ℃冷冻离心机(Eppendorf 5801型)10 949×g离心10 min,去沉淀组织留上清液,BCA法测定蛋白浓度,-20 ℃保存。
3.3RNA提取 治疗后24 h,随机取对照组5只、模型组5只和治疗组16×3只大鼠,麻醉后经心脏灌注生理盐水200 mL,开颅取脑,切取缺血脑组织200 mg,放入1.5 mL EP管,加1 mL RNA-Solv Reagent,剪碎研磨,超声振荡30 s,室温放置5 min,4 ℃、12 000×g离心15 min,取上清置另一EP管,加0.2 mL氯仿,盖紧离心管,振荡混匀15 s,冰上放置10 min,4 ℃、12 000×g离心15 min;取无色水相置于EP管中,并加入0.5 mL异丙醇,轻轻混匀,冰上放置10 min,4 ℃、12 000×g离心15 min,小心弃上清;加75%乙醇1 mL洗涤沉淀,涡旋混匀,4 ℃、7 500×g离心5 min,小心弃上清;通风橱干燥15~30 min(沉淀由白色变为透明方可),加0.1% DEPC水30 μL后置于57 ℃水浴中10 min;室温静置后,紫外分光光度计(Bekamann DU640)测定RNA纯度和丰度,-20 ℃保存。
4 观察指标
4.1固绿髓鞘染色 切片常规脱蜡入水,经95%乙醇处理1 min后置于固绿乙醇溶液,37 ℃染色1 h,95%乙醇洗10 s×2次,蒸馏水洗15 s×3次,0.3%碳酸锂分色10 s×2次,蒸馏水洗15 s×3次,核固红复染90 s,蒸馏水冲洗后常规脱水、透明、封固。光镜下正常髓鞘呈条索状,深绿色,排列紧密,细胞呈红色。在400倍光镜下选取顶叶脑白质区5个不重叠的视野,Quantity One软件进行灰度分析,取均值。以髓鞘染色灰度值(dyeing gray value,DGV)表示髓鞘变化情况。
4.2免疫组化染色 兔抗鼠MBP Ⅰ抗、链霉亲和生物素辣根过氧化物酶(SABC)试剂盒、3,3-二氨基联苯氨(DAB)显色试剂盒均由武汉博士德生物公司提供。石蜡切片常规脱蜡水化,按SABC试剂盒说明书步骤操作,DAB显色,苏木素复染,光镜下观察髓鞘呈棕黄色条索状,阳性细胞胞质着色不均匀,呈空泡状。阴性对照切片不加Ⅰ抗以0.01 mol/L PBS替代染色,不出现阳性着色。在400倍光学显微镜下随机观察大脑缺血脑白质区5个不重叠的视野,Quantity One软件进行灰度分析,取均值。以髓鞘免疫组化灰度值(immunohistochemical gray value,IGV)表示MBP表达程度。
4.3Western blotting检测 制备12%分离胶,5%浓缩胶,先后在75 V、120 V电压下电泳,获得目的条带(MBP分子量:18 kD,23 kD),360 mA转膜40 min,磷酸盐-吐温缓冲液(phosphate buffered saline with Tween-10,PBST)洗膜5 min×3次,然后加MBP兔抗大鼠Ⅰ抗(Abcam)孵育2 h,PBST洗涤Ⅰ抗10 min×3次,辣根酶标记山羊抗兔Ⅱ抗(北京中杉金桥)孵育1 h,PBST洗涤5 min×3次,PBS 5 min×3次清洗后显影。将膜置于A、B混合显影液中,用Bio-Rad 2000型凝胶成像系统扫描,Quantity One软件进行灰度分析。以同一标本β-actin(42 kD)的灰度值作为内参照,校正目的蛋白灰度值,计算目的蛋白相对值(relative value of protein, RVP):样品灰度值/β-actin灰度值。重复测定3次。
4.4RT-PCR检测 (1) 引物设计:应用Primer Premier 5.0进行引物设计(上海英潍捷基有限公司合成)。MBP上游引物5’-CCC ATT GGT GCA CAC TAA CCT-3’,下游引物5’-CGA CTT GAT TCA GCG ACA GGA-3’,片段长度103 bp。内参照GAPDH上游引物5’-CGT TGA CAT CCG TAA AGA CCT C-3’,下游引物5’-TAG GAG CCA GGG CAG TAA TCT-3’,片段长度110 bp。(2) 逆转录合成cDNA体系25 μL:Oligo(dT) 2 μL,RNA 2 μg,DEPC-H2O补至13.4 μL。混匀后置于70 ℃ 5 min,冰浴5 min后,加入以下物质:M-MLV RT 5×5 μL,dNTP Mixture 5 μL,RNase inhibitor 0.62 μL,M-MLV Reverse Transcriptase 1 μL。混匀后42 ℃ 1 h,70 ℃反应15 min,-20 ℃保存。(3) PCR体系50 μL:10×PCR buffer 5 μL,dNTP (10 mmol/L) 1 μL,cDNA 1 μL,primer 1 (10 μmol/L) 1 μL,primer 2 (10 μmol/L)1 μL,Taq聚合酶 0.4 μL,0.1% DEPC-H2O补至50 μL。循环条件:95 ℃预变性3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 40 s,30个循环,72 ℃ 3 min。(4)电泳:RT-PCR体系50 μL,加6×DNA loading buffer 10 μL 振荡混匀,离心5 s,上样10 μL。选取适合的DNA Marker 2 μL上样,2%琼脂糖凝胶电泳(120 V、100 mA)30 min,溴化乙啶(EB)染色,凝胶成像分析系统(Bio-Rad)检测各条带灰度值,以目的基因与内参照GAPDH灰度值的比值,表示目的基因的相对丰度(relative content of mRNA,RCM)。重复测定3次。
5 统计学处理
应用SPSS 17.0统计软件分析。数据以均数±标准差(mean±SD)表示。单因素方差分析(One-way ANOVA)进行多组数据之间差异的比较,多重比较运用最小显著差异(least significant difference,LSD)法。根据不同缺血(给药)时间和剂量以及缺血时间和剂量的交互作用对实验检测指标是否有显著影响,得出最佳的剂量和时间窗。以P<0.05为差异有统计学意义。
结 果
1 检测结果
对照组固绿染色髓鞘呈条索状,深绿色,排列紧密。造模后,髓鞘疏松,染色变浅,胶质细胞空泡形成。DGV、IGV、MBP蛋白含量(RVP)和MBP mRNA丰度(RCM)均显著低于对照组(P<0.05)。经胡黄连苷Ⅱ治疗后,DGV、IGV、RVP和RCM较模型组均显著升高(P<0.05),见表1和图1~4。正交试验各指标结果如表2所示,表中所列数据均为3次正交试验的均值,表中Ⅰ、Ⅱ、Ⅲ、Ⅳ和SS为固绿髓鞘染色MGV方差分析数据,其余方差分析指标数据从略。

表1 检测结果
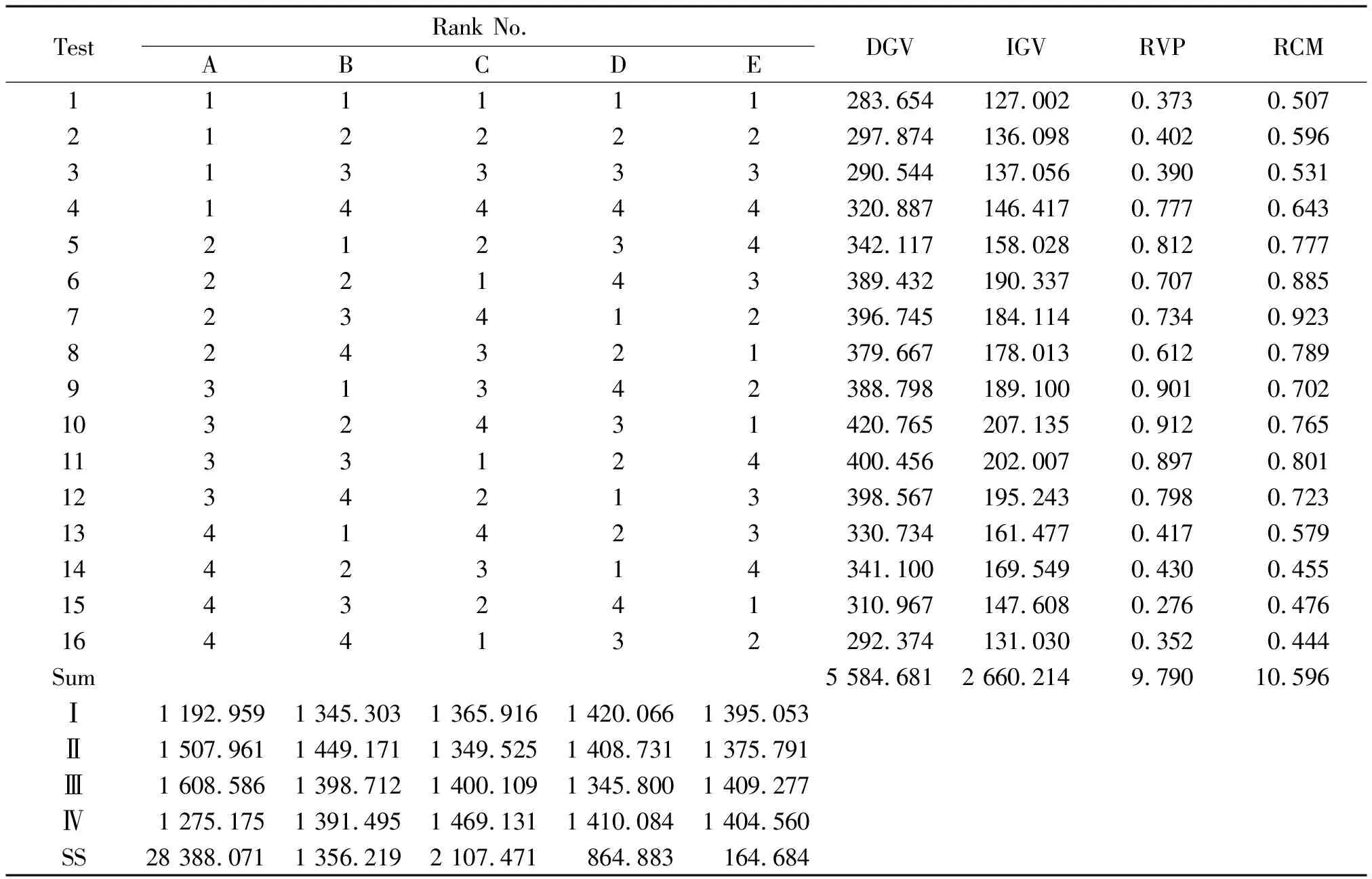
表2 L16 (45)正交表及检测结果
2 结果分析
2.1固绿髓鞘染色 由图1和表2可见,自变量因素A(时间)的不同水平对髓鞘损伤有显著影响(P<0.01),而因素B(剂量)和因素C (时间-剂量交互作用)无统计学意义(P>0.05),即给药时间对脑缺血后髓鞘损伤程度有显著的影响,而给药剂量无显著影响,时间-剂量交互作用可忽略不计。LSD法对不同水平进行两两比较得LSD值,给药时间各组之间比较,差异均有统计学意义(P<0.05)。给药剂量5 mg/kg(B1)和10 mg/kg(B2)之间差异有统计学意义(P<0.05),其余各组之间差异均无统计学意义(P>0.05)。从治疗时间窗最大化和用药剂量最小化的角度综合考虑,以A3B2组合最好,即最佳治疗时间窗和剂量分别为缺血2.0 h腹腔注射10 mg/kg。
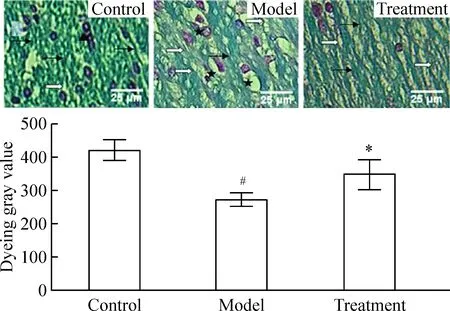
Figure 1. The myelin in parietal white matter of rats (fast green staining,×400).Normal nerve fiber myelin was dark green and cord-like, tightly packed (→), and the nucleus was red (▲). After modeling, myelin fibers were uncolored, loose (white arrows) and vacuolated (★).Mean±SD.n=5.#P<0.05 vs control;*P<0.05 vs model.
2.2免疫组化染色 由图2和表2可见,自变量因素A(时间)的不同水平对髓鞘表达的影响有统计学意义(P<0.05),B(剂量)和时间-剂量交互作用(C)无统计学意义(P>0.05),即给药时间对脑缺血后髓鞘表达有显著影响,而给药剂量以及给药时间和给药剂量的交互作用可以忽略不计。两两比较LSD值显示,给药时间1.0 h(A1)和1.5 h(A2)、1.0 h(A1)和2.0 h(A3)、1.5 h(A2)和2.0 h(A3)、1.5 h(A2)和2.5 h(A4)、2.0 h(A3)和2.5 h(A4)之间差异有统计学意义(P<0.05),其余各组之间差异均无统计学意义(P>0.05)。给药剂量均无显著差异。综合考虑A3B2组合最好,即最佳治疗时间窗和剂量分别为缺血2.0 h和10 mg/kg。
2.3Western blotting定量检测神经细胞MBP表达水平 如图3和表2所示,各组大鼠有不同数量的蛋白表达,且治疗组表达量显著高于模型组。方差分析显示,自变量因素A(时间)的不同水平对MBP蛋白表达的影响均有统计学意义(P<0.05),B(剂量)和时间-剂量交互作用(C)无统计学意义(P>0.05)。两两比较LSD值显示,给药时间1.0 h(A1)和1.5 h(A2)、1.0 h(A1)和2.0 h(A3)、1.5 h(A2)和2.5 h(A4)、2.0 h(A3)和2.5 h(A4)之间差异有统计学意义(P<0.05),其余各组之间差异均无统计学意义(P>0.05)。给药剂量均无显著差异。综合考虑A3B2组合最好,即最佳治疗时间窗和剂量分别为缺血2.0 h和10 mg/kg。
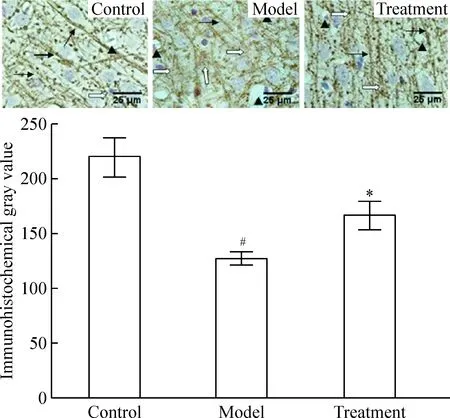
Figure 2. The myelin in parietal white matter of the rats (SABC staining,×400).In control group, myelin packed closely and tidy (→). After modeling, myelin became loose and disordered (white arrows), and the positive cells were unevenly colored and vacuolated (▲). Mean±SD.n=5.#P<0.05 vs control;*P<0.05 vs model.

Figure 3. The effects of picroside Ⅱ on the expression of MBP after cerebral ischemia injury.C: control; M: model; 1~4: intraperitoneal injection of picroside Ⅱ at ischemia 1.0 h; 5~8: intraperitoneal injection of picroside Ⅱ at ischemia 1.5 h; 9~12: intraperitoneal injection of picroside Ⅱ at ischemia 2.0 h; 13~16: intraperitoneal injection of picroside Ⅱ at ischemia 2.5 h; 1, 5, 9 and 13: intraperitoneal injection of 5 mg/kg picroside Ⅱ; 2, 6, 10 and 14: intraperitoneal injection of 10 mg/kg picroside Ⅱ; 3, 7, 11 and 15: intraperitoneal injection of 20 mg/kg picroside Ⅱ; 4, 8, 12 and 16: intraperitoneal injection of 40 mg/kg picroside Ⅱ.Mean±SD.n=3.#P<0.05 vs C;*P<0.05 vs M.
2.4RT-PCR检测脑组织MBP mRNA水平 如图4和表2所示,各组大鼠转录水平不同,治疗组大鼠mRNA较模型组升高。方差分析显示,自变量因素A(时间)的不同水平对MBP mRNA表达的影响均有统计学意义(P<0.05),B(剂量)和时间-剂量交互作用(C)无统计学意义(P>0.05)。两两比较LSD值显示,给药时间1.0 h(A1)和1.5 h(A2)、1.0 h(A1)和2.0 h(A3)、1.5 h(A2)和2.0 h(A3)、1.5 h(A2)和2.5 h(A4)、2.0 h(A3)和2.5 h(A4)之间差异有统计学意义(P<0.05),1.0 h(A1)和2.5 h(A4)之间差异无统计学意义(P>0.05)。给药剂量各组之间差异无统计学意义(P>0.05)。综合考虑A2B3组合最好,即最佳治疗时间窗和剂量分别为缺血1.5 h和20 mg/kg。

Figure 4. The effects of picroside Ⅱ on the mRNA expression of MBP after cerebral ischemia injury.C: control; M: model; 1~4: intraperitoneal injection of picroside Ⅱ at ischemia 1.0 h; 5~8: intraperitoneal injection of picroside Ⅱ at ischemia 1.5 h; 9~12: intraperitoneal injection of picroside Ⅱ at ischemia 2.0 h; 13~16: intraperitoneal injection of picroside Ⅱ at ischemia 2.5 h; 1, 5, 9 and 13: intraperitoneal injection of 5 mg/kg picroside Ⅱ; 2, 6, 10 and 14: intraperitoneal injection of 10 mg/kg picroside Ⅱ; 3, 7, 11 and 15: intraperitoneal injection of 20 mg/kg picroside Ⅱ; 4, 8, 12 and 16: intraperitoneal injection of 40 mg/kg picroside Ⅱ.Mean±SD.n=3.#P<0.05 vs C;*P<0.05 vs M.
讨 论
正交表能够在因素变化范围内均衡抽样,在减少实验次数的同时,使每次实验都具有较强的代表性,是一种高效、经济的实验方法[17]。本实验应用正交表对实验进行整体设计、综合比较、统计分析,实现通过少数的实验次数找到较好的治疗方案,以达到最佳的治疗效果。
MBP有中枢性MBP和周围性MBP两种,脑白质中含量最高,在中枢神经系统中由少突胶质细胞合成,是一种碱性的、不含糖和脂质的膜蛋白。神经纤维必须经过髓鞘化才能发挥传导功能,而MBP是参与髓鞘合成的一种非常重要的结构蛋白,在神经纤维中起绝缘和快速传导作用,对于神经系统功能的发挥扮演着重要的角色。人和鼠MBP基因的转录产物稍有不同,鼠脑中至少有21.5 kD、18.5 kD、17 a、17 b和14 kD 5种产物,而人有21.5 kD、20.2 kD、18.5 kD和17.3 kD 4种,其中18.5 kD MBP是中枢神经系统髓鞘成熟期的主要蛋白。正常情况脑脊液中MBP含量小于6.95 mg/L,缺血性脑损伤发生时由于脑组织缺血缺氧导致少突胶质细胞死亡,髓鞘脱失,使MBP流向脑脊液中,再加上脑损伤本身导致血脑屏障的破坏,使漏入脑脊液中的MBP进入血液,因此,血清MBP的测定能够在一定程度上反映是否发生脑组织损伤,成为判定有无髓鞘脱失的一种特异性蛋白标记物[18-20]。动物实验发现,在脑缺血损伤早期MBP mRNA及蛋白表达都降低,尤其在脑缺血损伤的前24 h,MBP蛋白降低显著[21]。实验发现[4, 22-23],MBP对于预测脑损伤程度、判断预后等方面都具有显著作用。因此,本实验也检测了MBP mRNA及蛋白的表达,以确定脑损伤程度。MBP表达增加能起到脑保护作用[24]。本实验显示,脑缺血损伤后MBP mRNA及蛋白的表达显著降低,固绿染色表明髓鞘纤维同步减少,损伤的阳性细胞显著升高,因此证实,从各个水平检验MBP都可作为检测脑损伤,以及髓鞘损伤的生物学指标。
传统中药的优势已得到证实[25],胡黄连具有清热燥湿、消痞退蒸、凉血利胆等作用[26],且胡黄连苷Ⅱ是其有效成分之一。细胞实验发现,胡黄连苷Ⅱ有较强的抗氧化作用[27],能减轻H2O2诱导的PC12细胞损伤,提高细胞存活率[28]。前期我们也做了大量的动物实验证实,胡黄连苷Ⅱ能够抑制炎症细胞因子Toll样受体4、核因子κB、caspase-3以及肿瘤坏死因子α等的表达,抑制大鼠大脑中动脉闭塞再灌注后缺血半影区相关炎症因子的表达,进而抑制缺血损伤导致的脑细胞凋亡[29-33]。本次实验结果表明,胡黄连苷Ⅱ治疗组较模型组,髓鞘排列有序,空泡细胞减少,MBP蛋白表达以及mRNA反转录水平都有不同程度的升高,从不同的水平证明了胡黄连苷Ⅱ的抗脑缺血损伤的神经保护作用。进一步的时间剂量优化表明,在缺血1.5~2.0 h给予胡黄连苷Ⅱ10~20 mg/kg,抗脑损伤作用显著。
[参 考 文 献]
[1] Kuboyama K, Fujikawa A, Masumura M, et al. Protein tyrosine phosphatase receptor type Z negatively regulates oligodendrocyte differentiation and myelination[J]. PLoS One, 2012, 7(11):e48797.
[2] Wunderlich MT, Wallesch CW, Goertler M. Release of neurobiochemical markers of brain damage is related to the neurovascular status on admission and the site of arterial occlusion in acute ischemic stroke[J]. J Neurol Sci, 2004, 227(1):49-53.
[3] DeBruin LS, Haines JD, Wellhauser LA, et al. Developmental partitioning of myelin basic protein into membrane microdomains[J]. Neurosci Res, 2005, 80(2):211-225.
[4] Lamers KJ, Vos P, Verbeek MM, et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients[J]. Brain Res Bull, 2003, 61(3):261-264.
[5] Bedell MA, Jenkins NA, Copeland NG. Good genes in bad neighbourhoods[J]. Nat Genet, 1996, 12(3):229-232.
[6] Chen YZ, Yi Q, Liu G, et al. Cerebral white matter injury and damage to myelin sheath following whole-brain ischemia[J]. Brain Res, 2013, 1495:11-17.
[7] Tian Y, Shi Z, Yang S, et al. Changes in myelin basic protein and demyelination in the rat brain within 3 months of single 2-, 10-, or 30-Gy whole-brain radiation treatments[J]. J Neurosurg, 2008, 109(5):881-888.
[8] Chu M, Hu X, Lu S,et al. Focal cerebral ischemia activates neurovascular restorative dynamics in mouse brain[J]. Front Biosci (Elite Ed), 2012, 4:1926-1936.
[9] 陈应柱, 鲍 欢, 田 野, 等. 脑缺血后髓鞘基因表达变化的规律[J]. 中华急诊医学杂志, 2007, 16(9):929-932.
[10] 段建刚, 刘 鸣. 针刺对缺血性脑卒中大鼠MBP基因表达的影响[J]. 中国康复医学杂志, 2009, 24(3):240-251.
[11] Meng FJ, Hou ZW, Li Y, et al. The protective effect of picroside 2 against hypoxia/reoxygenation injury in neonatal rat cardiomyocytes[J]. Pharm Biol, 2012, 50(10):1226-1232.
[12] 郭云良, 沈 卫, 杜 芳, 等. 胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤后TLR4及NFκB表达的影响[J]. 中国中西医结合杂志, 2011, 31(1):58-61.
[13] 李红云, 赵 丽, 宿 希, 等. 胡黄连苷Ⅱ治疗脑缺血/再灌注损伤剂量和时间窗的初步探讨[J]. 中国药理学通报, 2012, 28(4):549-553.
[14] Pei HT, Su X, Zhao L, et al. Primary study for the therapeutic dose and time window of picroside II in treating cerebral ischemic injury in rats[J]. Int J Mol Sci, 2012, 13(3):2551-2562.
[15] 伍强军, 赵文元, 刘建民. 慢性血管源性脑缺血动物模型[J]. 中华脑血管病杂志:电子版, 2011, 5(3):216-223.
[16] Márquez-Martín A, Jiménez-Altayó F, Dantas AP, et al. Middle cerebral artery alterations in a rat chronic hypoperfusion model[J]. J Appl Physiol, 2012, 112(3):511-518.
[17] 刘瑞江, 张业旺, 闻崇炜, 等. 正交试验设计和分析方法研究[J]. 实验技术与原理, 2010, 27(9):52-55.
[18] Strand T, Alling C, Karlsson B, et al. Brain and plasma proteins in spinal fluid as markers for brain damage and severity of stroke[J]. Stroke, 1984,15(1):138-144.
[19] 叶 斌, 陈友燕, 谢 伟. 成人臀肌挛缩症微创治疗临床分析[J]. 中华全科医学, 2010,8(4):413-414.
[20] 赵 红, 张拥波, 王得新, 等. 大鼠局灶性脑缺血后少突胶质前体细胞激活及髓鞘再生的实验研究[J]. 中风与神经疾病杂志, 2012, 29(4):332-334.
[21] Gregersen R, Christensen T, Lehrmann E, et al. Focal cerebral ischemia induces increased myelin basic protein and growth-associated protein-43 gene transcription in peri-infarct areas in the rat brain[J]. Exp Brain Res, 2001, 138(3):384-392.
[22] 戚艳红, 刘 刚, 沈 雪, 等. 脑梗死血清髓鞘碱性蛋白水平与TOAST 分型相关性[J]. 中华全科医学, 2012, 10(11):1672-1676.
[23] 陈 俊, 何国厚, 曾少波, 等. 急性脑梗死患者S100B、MBP 动态检测的临床意义[J]. 临床检验杂志, 2005, 23(2):145-146.
[24] Wang LW, Tu YF, Huang CC, et al. JNK signaling is the shared pathway linking neuroinflammation, blood-brain barrier disruption, and oligodendroglial apoptosis in the white matter injury of the immature brain[J]. J Neuroinflammation, 2012, 9(1):175-191.
[25] 刘 瑞, 高维娟, 钱 涛, 等. 黄芪注射液抑制脑缺血再灌注大鼠海马组织Apaf-1表达[J]. 中国病理生理杂志, 2013, 29(5):872-877.
[26] 江苏新医学院中药大辞典编写组. 中药大辞典(下册)[M]. 上海: 上海科学技术出版社, 1996:1548-1550.
[27] Li T, Liu JW, Zhang XD, et al. The neuroprotective effect of picroside 2 from hu-huang-lian against oxidative stress[J]. Am J Chin Med, 2007, 35(4):681-691.
[28] Li P, Matsunaga K, Yamakuni T, et al. PicrosidesⅠand Ⅱ, selective enhancers of the mitogen-activated protein kinase-dependent signaling pathway in the action of neuritogenic substances on PC12D cells [J]. Life Sci, 2002, 71(15):1821-1835.
[29] Guo Y, Xu X, Li Q,et al. Anti-inflammation effects of picroside 2 in cerebral ischemic injury rats[J]. Behav Brain Funct, 2010, 6:43.
[30] Li Q, Li Z, Xu XY, et al. Neuroprotective properties of picroside II in rat model of focal cerebral ischemia[J]. Int J Mol Sci, 2010, 11(11):4580-4590.
[31] 李 震, 徐新颖, 沈 卫, 等. 胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤NF-κB和I-κB的干预作用[J]. 中国药理学通报, 2010, 26(1):52-56.
[32] 李 琴, 郭云良, 李 震, 等. 胡黄连苷II对大鼠脑缺血/再灌注损伤Caspase-3和PARP表达的影响[J]. 中国药理学通报, 2010, 26(3):342-345.
[33] 李 震, 李 琴, 郭云良, 等. 胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤的干预作用[J]. 解剖学报, 2010, 41(1):9-12.

