携带pGRIM-19-si-survivin共表达质粒的减毒沙门菌对前列腺癌移植瘤的体内抑制作用*
赵晓晖, 芦丽莉, 葛 贺, 李 冰, 赵雪俭, 刘艳波△
(1北华大学基础医学院病理生理学教研室,吉林 吉林 132013; 2吉林大学前列腺疾病防治研究中心,吉林 长春 132001)
前列腺癌(prostate cancer,pCa)是美国男性癌症死亡的第二大原因,2010年,估计美国有217 030例前列腺癌患者被确诊,约32 050人死于该病[1]。目前我国前列腺癌发病率也呈逐渐增加趋势。pCa具有侵袭性及耐药性特点[2],而前列腺癌根治术并发症较多,对转移的前列腺癌几乎无作用[3]。存活蛋白(survivin)是1997年确定的一种凋亡抑制蛋白,能抑制细胞凋亡和调节细胞增殖,在大多数恶性肿瘤中高表达,有研究证实survivin表达在前列腺癌中异常升高。GRIM-19蛋白是GRIM家族的一个新成员,为一种新的肿瘤抑制蛋白。研究表明,GRIM-19在许多正常组织中高表达,但在多种癌症中低表达或没有表达,有研究证实在人前列腺癌组织中GRIM-19表达缺失。另一方面,GRIM-19可以增强细胞对干扰素β联合维甲酸诱导的细胞凋亡,同时获得自身死亡活化[4]。本研究在前期工作成功构建pGRIM-19-si-survivin 共表达质粒的基础上,以减毒沙门菌作为运载体,观察其对裸鼠前列腺癌皮下移植瘤的抑瘤效应,并探讨相关机制。
材 料 和 方 法
1 动物
雄性裸鼠,30只,4~6周龄,质量18~20 g,购于中国医学科学院实验动物研究所。
2 主要材料
psi-survivin质粒、psi-scramble质粒、pGRIM-19质粒、pGRIM-19-si-survivin重组质粒和DU145细胞株由吉林大学前列腺疾病防治研究中心馈赠;减毒人伤寒沙门氏菌Ty21a由美国马里兰大学胡嘉娣教授馈赠;JM109大肠杆菌由本研究室保存;兔抗人survivin单克隆抗体购自Santa Cruz;鼠抗人Ki67单克隆抗体购自Abcom;二步法免疫组化检测试剂盒购自北京中杉试剂公司;Trizol试剂为Invitrogen;TUNEL试剂盒购于南京建成生物试剂公司;引物合成及测序由上海生工生物工程技术服务公司完成。
3 方法
3.1重组表达质粒转化减毒人伤寒沙门氏菌 分别将psi-scramble、psi-survivin、pGRIM-19和PGRIM-19-si-survivin质粒转化人减毒沙门菌Ty21a。
3.2裸鼠前列腺癌皮下移植瘤的构建及治疗 将DU-145细胞调整到2.5×1010cells/L,取0.2 mL接种于裸鼠左侧背部皮下。20 d后,在无菌条件下取出瘤组织块,将瘤组织分成直径约2 mm的瘤块植入另外30只裸鼠皮下。待移植瘤长至直径约7 mm时将裸鼠随机分为6组,即mock组(PBS作为对照)、单纯减毒沙门氏菌组、沙门菌携带的psi-scramble组、psi-survivin组、pGRIM-19组和pGRIM-19-si-survivin治疗组,每组5只动物,裸鼠腹腔注射含有上述质粒的减毒沙门菌20 μL (108cfu/100 μL),每周2次监测裸鼠皮下移植瘤体积,直至70 d处死。裸鼠体积按以下公式进行计算:V=L×W2×0.52,L为肿瘤的长径,W为肿瘤的短径。绘制肿瘤的生长曲线并计算抑瘤率(inhibitory rate,IR),IR(%)=(1-治疗组瘤重/对照组瘤重)×100%。
3.3病理学检查及免疫组织化学染色 取10%甲醛固定后的组织,石蜡包埋,组织切片4 μm,进行HE染色,各种动物肿瘤组织进行survivin、GRIM-19和Ki67的免疫组织化学染色,显微镜下观察,拍照并记录实验结果。
3.4肿瘤组织相关蛋白的mRNA表达 利用Trizol试剂提取pCa移植瘤组织内总RNA,RT-PCR扩增survivin、GRIM-19、 caspase-3、Bcl-xL、c-Myc、Stat3、cyclin D1、VEGF和内参照β-actin,引物序列与参考文献[5]相同。
3.5TUNEL法检测肿瘤细胞凋亡 切片常规脱蜡入水,新鲜配制的3% H2O2室温处理10 min,PBS洗3 min×3次,组织用胰蛋白酶37 ℃水浴消化30 min,PBS洗3 min×3次,加TUNEL检测液,每片50 μL,37 ℃避光孵育60 min,PBS洗3 min×3次,滴加 DAB显色,PBS洗3 min×3次,苏木素轻度复染,脱水,透明,封片,显微镜下观察。每个切片观察5个视野,每个视野连续数300个细胞,计数凋亡细胞百分比即为凋亡指数(apoptotic index,AI)。AI(%)=凋亡细胞数/总细胞数×100%。
4 统计学处理
数据用均数±标准误 (mean±SEM) 表示,SPSS 11.0统计软件进行方差分析和SNK-q检验,用Excel作图,以P<0.05为差异有统计学意义。
结 果
1 重组质粒对裸鼠前列腺癌皮下移植瘤的抑制作用
DU145细胞接种裸鼠皮下2周后,可见裸鼠前列腺癌移植瘤模型复制成功。随后将移植块接种裸鼠皮下,连续监测肿瘤的生长情况,并绘制肿瘤生长曲线,见图1、2。从第15天开始腹腔注射携带不同质粒的减毒沙门菌,用游标卡尺测量肿瘤体积,监测肿瘤的生长情况。从第35天开始,共表达质粒组与对照组及单基因质粒组相比,肿瘤体积开始明显缩小,差异有统计学意义(P<0.05);70 d 处死动物时,携带共表达质粒的减毒沙门菌组其肿瘤体积为(284.33±57.33) mm3,携带psi-survivin组肿瘤体积为(671.36±165.11)mm3,携带pGRIM-19组减毒沙门菌肿瘤体积为(857.29±170.07)mm3,前者与后两者比较,肿瘤体积分别减少2.36和3.02倍,治疗效果明显(P<0.05)。
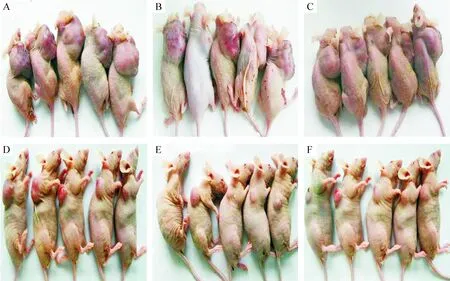
Figure 1. Intraperitoneal injection of S. typhi carrying pGRIM-19, psi-survivin and pGRIM-19-si-survivin plasmids resulted in significant inhibition of DU145 tumor growth in vivo. A: mock; B: S. typhi; C: psi-scramble; D: pGRIM-19; E: psi-survivin; F: pGRIM-19-si-survivin.

Figure 2. Growth curves of DU145 xenografts treated with recombinant plasmids.Arrows: plasmid treatment.Mean±SEM.n=3.*P<0.05, **P<0.01 vs control (mock, S.typhi or psi-scramble); #P<0.05 vs pGRIM-19 or psi-survivin.
2 肿瘤组织survivin和GRIM-19的蛋白免疫组化检测
由图 3 可见,GRIM-19蛋白主要表达于肿瘤细胞的胞浆,少部分表达于胞核。图4表明survivin蛋白主要表达于肿瘤细胞的胞浆,显棕黄色,也有部分位于胞核内。携带pGRIM-19-si-survivin沙门菌治疗组肿瘤细胞内survivin表达明显低于携带psi-scramble减毒沙门菌治疗组;而GRIM-19的表达明显增加(P<0.05),从而说明携带pGRIM-19-si-survivin共表达质粒减毒沙门菌可有效提高肿瘤组织内GRIM-19蛋白含量,同时降低survivin蛋白的表达。
3 肿瘤组织Ki67免疫组化染色
如图5所示,携带psi-scramble减毒沙门菌治疗组Ki67表达呈强阳性,显棕黄色,携带psi-survivin和pGRIM-19质粒的减毒沙门菌治疗组Ki67表达不同程度减弱,而携带pGRIM-19-si-survivin共表达质粒减毒沙门菌组减弱更明显(P<0.05或P<0.01)。
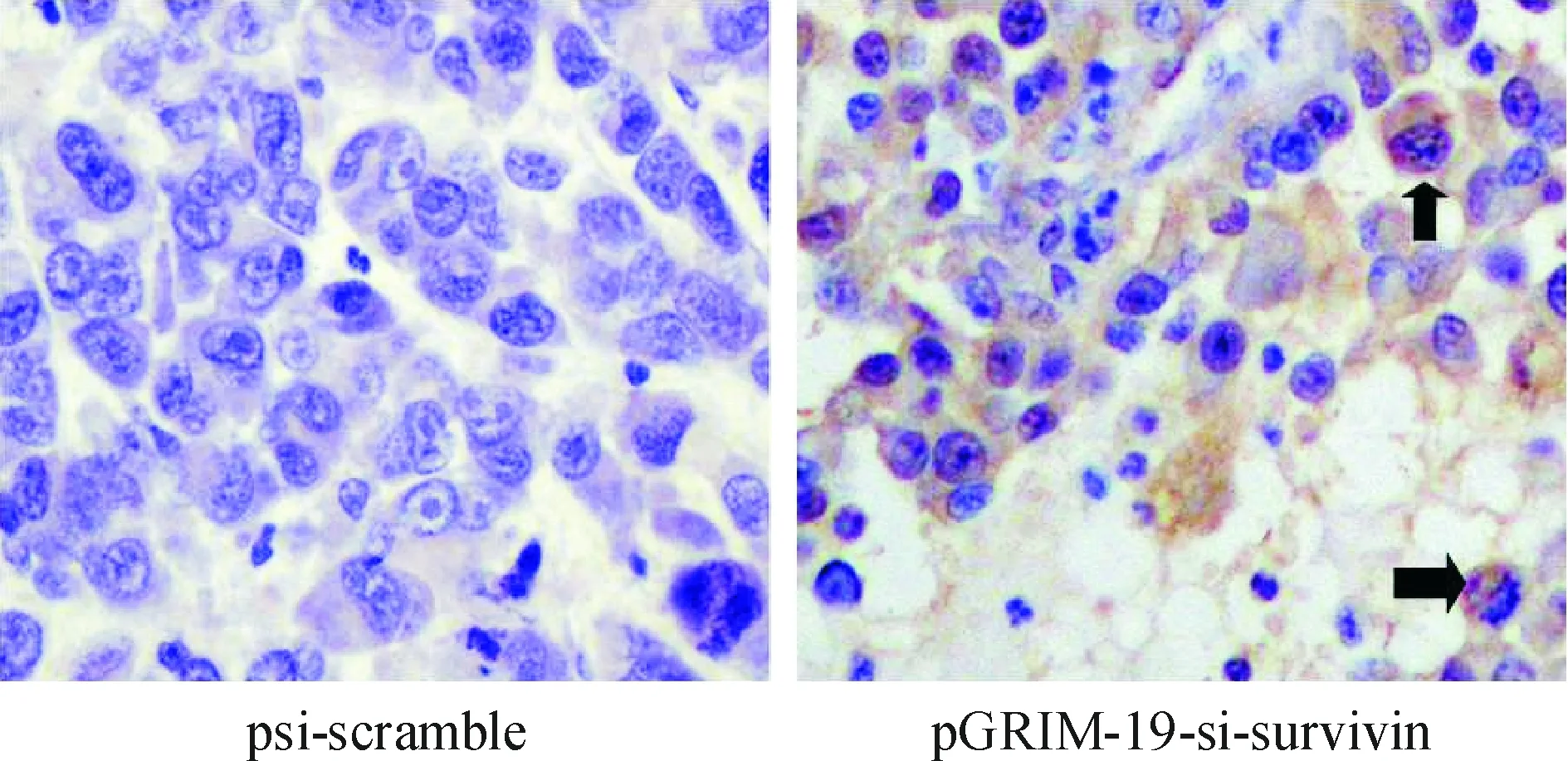
Figure 3. Immunohistochemical analysis of GRIM-19 expression in DU145 xenografts treated with S. typhi carrying psi-scramble and pGRIM-19-si-survivin plasmids(×400).

Figure 4. Immunohistochemical analysis of survivin expression in DU145 xenografts treated with S. typhi carrying psi-scramble and pGRIM-19-si-survivin plasmids(×400). Arrows indicate the positive cells with yellow color.

Figure 5. Immunohistochemical analysis of Ki67 expression in DU145 xenografts treated with S. typhi carrying diffe-rent plasmids (×400).Arrows indicate the positive cells with yellow color.
4 肿瘤组织GRIM-19和survivin mRNA表达分析
RT-PCR显示(图6),survivin mRNA表达在mock组、携带psi-scramble减毒沙门菌组和单纯减毒沙门菌组无显著差异(P>0.05);而携带psi-survivin减毒沙门菌治疗组、pGRIM-19减毒沙门菌治疗组和pGRIM-19-si-survivin减毒沙门菌治疗组survivin mRNA表达减弱,以共表达质粒组降低最明显(P<0.05)。而GRIM-19 mRNA在mock组、携带psi-scramble减毒沙门菌组和单纯减毒沙门菌组表达基本缺失,携带pGRIM-19及共表达质粒组GRIM-19 mRNA表达明显增强。

Figure 6. RT-PCR analysis of survivin and GRIM-19 mRNA in DU145 xenografts.Mean±SEM.n=3.*P<0.05 vs control (mock, S.typhi or psi-scramble); #P<0.05 vs psi-survivin or pGRIM-19.
5 RT-PCR 检测肿瘤组织相关蛋白(caspase-3、Bcl-xL、c-Myc、Stat3、cyclin D1和VEGF)的mRNA表达
RT-PCR检测发现(图7),与其它单基因对照组比较,携带共表达质粒的减毒沙门菌可明显抑制肿瘤组织中Bcl-xL、c-Myc、Stat3、cyclin D1和VEGF mRNA表达,但同时增强caspase-3的表达(P<0.05或P<0.01)。
6 肿瘤组织细胞凋亡的检测
TUNEL结果显示,mock组动物肿瘤组织内鲜见凋亡细胞,而携带psi-survivin、pGRIM-19和pGRIM-19-si-survivin不同质粒的减毒沙门菌组可见TUNEL阳性反应细胞,即凋亡细胞,以pGRIM-19-si-survivin组细胞凋亡更明显。如图8所见,凋亡细胞表现为核固缩浓染,形状不规则,并呈现棕黄色染色,与单基因治疗组比较,差异显著(P<0.05)。

Figure 7. The mRNA expression of apoptosis-related proteins caspase-3, Bcl-xL, c-Myc, Stat3, cyclin D1 and VEGF in the DU145 xenografts after intraperitoneal injection of recombinant bacteria carrying different plasmids.Mean±SEM.n=3.*P<0.05, ** P<0.01 vs control (mock, S.typhi or psi-scramble); #P<0.05,##P<0.01 vs psi-survivin or pGRIM-19.
讨 论
肿瘤的发生是由多个基因共同调控的复杂过程。肿瘤治疗最理想的方法是杀灭肿瘤细胞的同时尽量降低对正常细胞的损伤,通过基因治疗方法可更准确地作用于癌细胞。肿瘤内部的缺氧环境是抵抗放化疗的重要原因。减毒的沙门菌兼性厌氧生长,它作为基因运载体具有靶向传递目的基因的特点,可选择性地在肿瘤组织中复制、表达编码治疗性蛋白效应基因等[6-7]。本文研究以减毒沙门菌为载体,携带si-survivin与GRIM-19共表达质粒对pCa进行治疗。结果证实,减毒沙门菌本身在肿瘤早期阶段具有一定的抗癌效果,与其增强免疫系统的活性有关。但携带pGRIM-19-si-survivin共表达质粒的减毒沙门菌与单一基因治疗组相比,肿瘤体积缩小更加明显,通过免疫组化染色、RT-PCR等法检测survivin表达被明显抑制而GRIM-19表达上调,与体外的实验结果相一致[8],说明沙门菌可将携带的目的基因成功转入细胞内发挥相应的作用。众所周知survivin是凋亡抑制蛋白家族中非常重要的成员,Lim等[4]研究表明,survivin与前列腺癌发生、发展呈正相关,其主要通过抑制caspase活性阻断细胞凋亡过程[9]。而干扰素β和维甲酸联合应用诱导的细胞凋亡基因GRIM-19是新的抑癌基因,它能和Stat3反式激活结构域组合,抑制Stat3活性进而调控细胞的生长分化及凋亡过程[10]。Stat3沉默可使其下游如Bcl-2、Bcl-xL、cyclin D1、survivin和VEGF表达下调,p53和caspases表达上调,从而抑制了细胞的生长及增殖,其发生机制与细胞周期改变、细胞凋亡激活及抑制细胞增殖关系密切。因此本研究检测了Bcl-xL、c-Myc、Stat3、cyclin D1和VEGF表达变化,为探讨其相关机制奠定基础。

Figure 8. Apoptosis in the DU145 xenografts after intraperioneal injection of recombinant bacteria carrying varions plasmids detected by TUNEL assay (×400).Arrows indicate the TUNEL-positive cells.
本研究运用RT-PCR对Bcl-xL表达进行了分析,结果证实与单基因治疗组比较pGRIM-19-si-survivin共表达质粒抑制Bcl-xL表达的功能更强,虽然Bcl-xL与survivin呈相关性,但具体作用途径不明确。c-myc基因是一种原癌基因,被激活后使细胞分裂加速,增殖加快,细胞甚至获得永生化。c-Myc参与细胞凋亡,与多种肿瘤发生发展有关[11],因为c-Myc通过JAK/Stat3信号转导途径激活,进而影响肿瘤的生长过程[12]。本研究表明, pGRIM-19-si-survivin共表达质粒组与单基因组相比较c-Myc表达明显减弱,且pGRIM-19组低于psi-survivin组,说明GRIM-19直接使Stat3沉默,抑制c-Myc的激活,而survivin反向调节Stat3的作用很弱。Cyclin D1是细胞周期调节因子,Stat3抑制剂可抑制cyclin D1启动子活性并使细胞生长停滞[13]。本实验在RT-PCR中检测到pGRIM-19-si-survivin共表达质粒组cyclin D1表达比单基因组低。VEGF是肿瘤血管生成的关键因素之一,对维持肿瘤细胞氧和营养物质供应具有重要意义。阻断VEGF表达,可减少肿瘤组织内血管生成及血液供应,对治疗肿瘤具有重要意义[14]。VEGF在肿瘤组织周围高表达不但直接促使新生血管生成,而且还可诱导survivin表达,产生抗凋亡效应,VEGF又依赖于survivin,两者相互影响,共同促进癌症的发生及发展。本研究结果显示,与单基因治疗组比较,pGRIM-19-si-survivin共表达质粒明显抑制VEGF表达,说明共表达基因可以通过GRIM-19对Stat3的作用控制VEGF,也可以通过survivin与VEGF的相关性来调节VEGF的表达。RT-PCR检测Stat3和caspase-3的表达变化,从结果看出pGRIM-19-si-survivin共表达质粒明显抑制Stat3表达但促进caspase-3的表达。
为了验证pGRIM-19-si-survivin共表达质粒通过促进细胞凋亡达到治疗肿瘤目的,本研究利用TUNEL染色法观察了不同细胞的凋亡情况,结果证实与单基因治疗组比较共表达质粒组促进细胞凋亡作用更明显,凋亡率明显增加,凋亡细胞表现为核固缩,染色质凝集等特点。从而也说明了肿瘤细胞生长的调控不是单一因素作用的,而是多因素共同作用的结果,单独解决某个异常高表达的基因,不一定能完全达到治疗肿瘤的目的[15]。
本研究又利用免疫组织化学染色法观察Ki67的表达变化,结果显示,与单基因治疗组比较,联合基因治疗组前列腺癌细胞增殖能力降低,而与凋亡相关的因子Stat3、Bcl-xL和c-Myc表达降低,caspase-3表达增加,细胞凋亡增加。
终上所述,减毒沙门菌可作为基因治疗的有效运载体,联合基因治疗方法较单基因治疗更加有效,减毒沙门菌携带pGRIM-19-si-survivin共表达质粒对前列腺癌皮下移植瘤的治疗作用通过促进细胞凋亡及抑制细胞增殖过程实现的,具体凋亡信号转导途径还有待于进一步深入研究。
[参 考 文 献]
[1] Jemal A, Siegel R, Xu J, et al. Cancer statistics[J]. CA Cancer J Clin, 2010, 60(5):277-300.
[2] Jeong JH, Bhatia A, Toth Z, et al. TPL2/COT/MAP3K8 (TPL2) activation-promotes androgen depletion-indepen-dent (ADI) prostate cancer growth[J]. PLoS One, 2011, 6(1):e16205.
[3] Graefen M, Schlomm T. Is radical prostatectomy a useful therapeutic option for high risk prostate cancer in older men?[J]. Oncologist, 2012, 17(Suppl 1):4-8.
[4] Lim M, Zhong C, Yang S, et al. Runx2 regulates survivin expression in prostate cancer cells [J]. Lab Invest, 2010, 90(2):222-233.
[5] Liu YB, Zhang L, Guo YX, et al. Plasmid-based Survivin shRNA and GRIM-19 carried by attenuatedSalmonellasuppresses tumor cell growth[J]. Asian J Androl, 2012, 14(4):536-545.
[6] Theys J, Barbe S, Landuyt W, et al. Tumor-specific gene delivery using genetically engineered bacteria[J]. Curr Gene Ther, 2003, 3(3):207-221.
[7] Wen LJ, Gao LF, Jin CS, et al. Small interfering RNA survivin and GRIM-19 co-expressionSalmonellaplasmid inhibited the growth of laryngeal cancer cellsinvitroandinvivo[J]. Int J Clin Exp Pathol, 2013, 6(10):2071-2081.
[8] 沈维高,赵丽晶,盖晓东,等. siRNA-survivin与GRIM-19共表达质粒的构建及其对前列腺癌DU145细胞生长的抑制作用[J]. 中国病理生理杂志, 2012, 28(7):1241-1246.
[9] Li CQ, Wu ZB, Liu M, et al. Chemically synthesized human survivin does not inhibit caspase-3[J]. Protein Sci, 2008, 17(9):1624-1629.
[10] 于 洋,王 洲. JAK-STAT3信号通路与非小细胞肺癌生物学行为相关性的研究进展[J].中国肺癌杂志, 2010, 13(2):160-164.
[11] Meyer N, Penn LZ. Reflecting on 25 years with MYC[J]. Nat Rev Cancer, 2008, 8(12):976-990.
[12] Cha Y, Moon BH, Lee MO, et al. Zap70 functions to maintain stemness of mouse embryonic stem cells by negatively regulating Jak1/Stat3/c-Myc signaling[J]. Stem Cells, 2010, 28(9):1476-1486.
[13] Samsonov A, Zenser N, Zhang F, et al. Tagging of genomic STAT3 and STAT1 with fluorescent proteins and insertion of a luciferase reporter in the cyclin D1 gene provides a modified A549 cell line to screen for selective STAT3 inhibitors[J]. PLoS One, 2013, 8(7):e68391.
[14] Cao Y, E G, Wang E, et al. VEGF exerts an angiogenesis-independent function in cancer cells to promote their malignant progression[J]. Cancer Res, 2012, 72(16):3912-3918.
[15] Pai SI, Lin YY, Macaes B, et al. Prospects of RNA interference therapy for cancer[J]. Gene Ther, 2006, 13(6):464-477.

