mTOR信号通路在克唑替尼诱导的EML4-ALK融合基因阳性肺癌细胞株H2228凋亡中的作用*
戴 辉, 宋向群, 潘星辰, 彭海燕, 韦 江, 周韶璋△
(广西医科大学 1研究生院, 2附属肿瘤医院化疗二科,广西 南宁 530021)
分子靶向药物在基因指导下的个体化治疗已成为当今非小细胞肺癌治疗的共识。棘皮动物微管结合蛋白样蛋白4-间变性淋巴瘤激酶(echinoderm microtubule-associated protein-like 4-anaplastic lymphoma kinase,EML4-ALK)融合基因是近期发现的非小细胞肺癌新的分子亚型,其突变与表皮生长因子受体(epidermal growth factor receptor,EGFR)及Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)突变是不共存的[1],所以其信号通路的靶点研究临床意义极大。人们研究发现,ALK包含许多重要的生物学信号通路,影响着肿瘤细胞增殖、分化与凋亡。克唑替尼(crizotinib)是近来发现针对ALK靶点的小分子抑制剂,它可以抑制ALK磷酸化及抑制细胞内信号转导,从而导致细胞分裂停止于G1/S期。本研究针对含有EML4-ALK融合基因的人非小细胞肺癌细胞株H2228,用crizotinib处理后,观察ALK下游哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的变化,以探讨mTOR信号通路在crizotinib诱导的人非小细胞肺癌细胞株H2228细胞凋亡中的作用。
材 料 和 方 法
1 材料
1.1细胞 人非小细胞肺癌细胞H2228由广东省肺癌研究所赠送,人非小细胞肺癌细胞A549细胞由广西医科大学肿瘤医学院实验部提供。
1.2主要试剂与仪器 Crizotinib粉末制剂购于Selleckchem, RPMI-1640培养基购自HyClone,胎牛血清和胰蛋白酶替代物购自Gibco,MTT购自Amresco,总RNA小量制备试剂盒购自Axygen康宁生命科学有限公司,逆转录试剂盒购自TaKaRa宝生物工程(大连)公司,定量PCR试剂盒购自Roche,RNase-free water购自生工生物工程有限公司,GoldView I型核酸染色剂购自上海索莱宝生物科技有限公司,电泳仪购自北京六一仪器厂(型号为JY-ECPT3000),凝胶成像仪购自Bio-Rad,型号为170-8170,Western blotting仪器设备购于Bio-Rad,ALK Ⅰ抗、p-ALKⅠ抗、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)Ⅰ抗、p-PI3KⅠ抗、AKTⅠ抗、p-AKTⅠ抗、mTORⅠ抗、p-mTORⅠ抗、70 kD核糖体蛋白S6激酶(ribosomal protein S6 kinase, 70-kD, p70S6K)Ⅰ抗、p-p70S6KⅠ抗和荧光Ⅱ抗均购自Cell Signaling,BCA试剂盒购自Merck,Annexin V-FITC细胞凋亡检测试剂盒和细胞周期检测试剂盒购自BD。
2 方法
2.1检测H2228细胞与A549细胞EML4-ALK融合基因 培养H2228细胞与A549细胞到细胞状态稳定后,按总RNA小量制备试剂盒说明提取细胞总RNA,用2%琼脂糖凝胶电泳和凝胶成像系统检测所得总RNA的完整性,用微量分光光度计测定总RNA浓度,EML4-ALK上、下游引物序列分别为:5’-ATCACTGTGCTAAAGGCGGCTT-3’和5’ -GAGCTTGCTCAGCTTGTACTCA-3’。按定量PCR试剂盒说明书进行PCR扩增,将PCR扩增产物送华大生物科技有限公司进行基因测序。
2.2MTT法检测细胞增殖率 按照肿瘤贴壁细胞常规培养方法培养H2228细胞和A549细胞至对数生长期,按(6~10)×103cells/well的细胞密度接种于96孔板,预设置6个浓度,每个浓度设置4个复孔,置于细胞培养箱中培养24 h后,按浓度梯度加入药物,把细胞置于培养箱中继续培养72 h后,吸净孔内液体,加入MTT继续培养4 h后再加入二甲基亚砜(dimethyl sulfoxide,DMSO),充分振荡10 min,在492 nm波长下测量吸光度,分别计算出crizotinib对H2228细胞和A549细胞的IC50,实验重复3次。
2.3流式细胞术检测细胞凋亡和周期分布情况 取生长状态良好的对数生长期H2228细胞与A549细胞,以4×105、5×105和7×105cells/well的细胞数量分别接种于6孔板中(2种细胞各接种8个孔),培养24 h,加入crizotinib浓度为300 nmol/L的血清培养液,将按4×105cells/well接种的细胞培养72 h,按5×105cells/well接种的细胞培养48 h,按7×105cells/well接种的细胞培养24 h,以细胞凋亡试剂盒和周期试剂盒说明书收集细胞并染色后用流式细胞术测定细胞凋亡率和周期分布,实验重复4次。
2.4Western blotting检测crizotinib对ALK/PI3K/AKT/mTOR信号通路相关信号蛋白表达的影响 收集长满瓶的H2228细胞和A549细胞,用RIPA裂解液提取细胞总蛋白,所得总蛋白经10%聚丙烯酰胺凝胶电泳转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,ALKⅠ抗稀释度1∶1 000,p-ALKⅠ抗稀释度1∶1 500,PI3KⅠ抗稀释度1∶1 000,p-PI3KⅠ抗稀释度1∶1 500,AKTⅠ抗稀释度1∶2 000,p-AKTⅠ抗稀释度1∶1 500,mTORⅠ抗稀释度1∶1 000,p-mTOR稀释度1∶1 500,p70S6K稀释度1∶1 000,p-p70S6K稀释度1∶1 500,兔、鼠Ⅱ抗稀释度1∶15 000,以β-肌动蛋白(β-actin)作内参照,红外荧光Ⅱ抗(DyLight 680 conjugate)显色,扫描分析条带,以条带灰度确定蛋白表达,实验重复3次。
3 统计学处理
用SPSS 16.0 统计软件分析。数据用均数±标准差(mean±SD)表示,两组数据比较采用t检验,多组数据比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 H2228细胞与A549细胞的EML4-ALK基因测序结果
H2228细胞和A549细胞分别提取mRNA,提取产物通过反转录PCR扩增后电泳,发现在633 bp的位置有亮带即EML4-ALK的位置,测序得出H2228细胞包含的EML4-ALK融合基因是变异体3(variant 3, V3)而且检测到a亚型和b亚型。A549细胞由于不含有该融合基因故无法通过RT-PCR扩增出目的DNA,见图1。
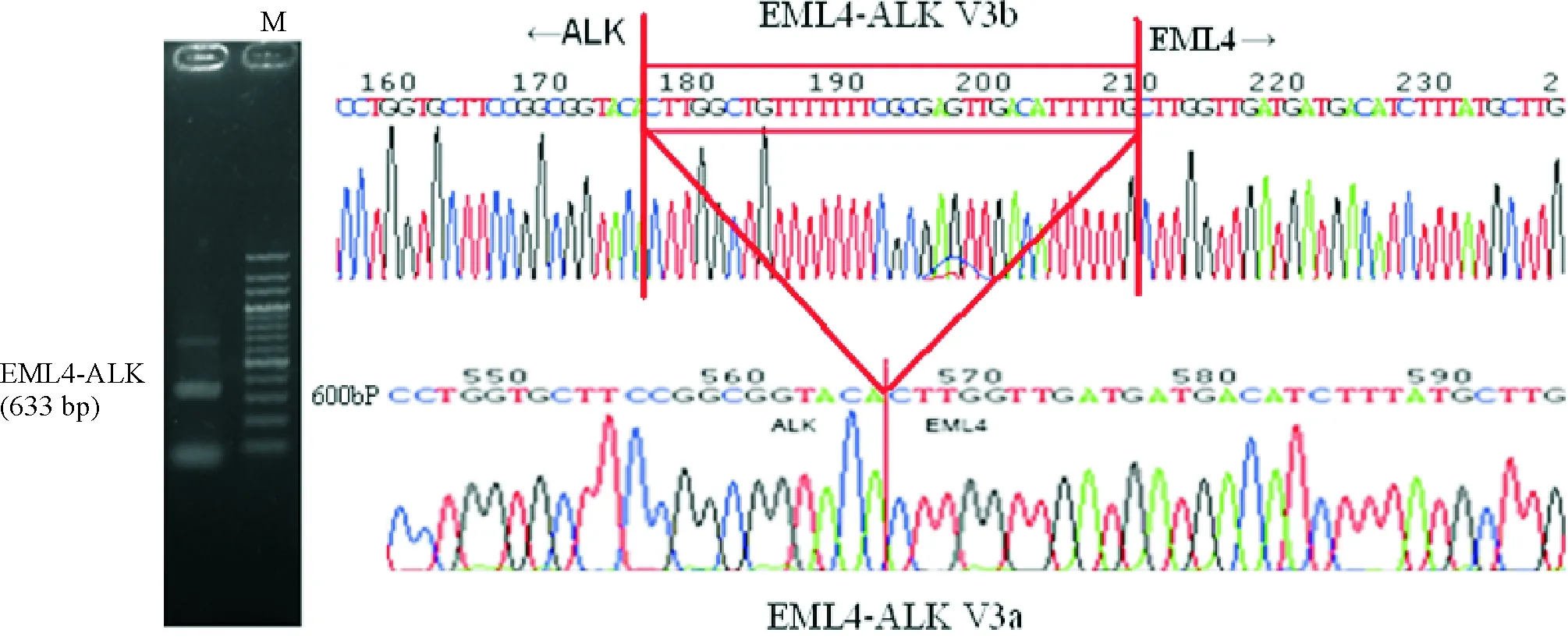
Figure 1. The DNA sequencing result of H2228 cells.The sequence in red box is the extra sequence of V3b compared with V3a.
2 MTT比色法检测crizotinib对H2228细胞和A549细胞株生长的影响
MTT实验计算得出H2228细胞的IC50为334.51 nmol/L。A549细胞对crizotinib的处理不敏感,给予10倍于H2228细胞的IC50后抑制率未及36%,见表1。
3 流式细胞术检测细胞凋亡及周期分布
根据MTT所得H2228细胞的IC50,以300 nmol/L作为实验的药物浓度,在光镜下观察经药物处理后细胞形态学变化(见图2)。3组细胞未经过处理时凋亡率无显著差异(P>0.05),经crizotinib处理的H2228细胞24 h、48 h和72 h凋亡率较A549组和未加药处理组明显增加(P<0.05),且随时间延长凋亡率增大,见图3。经药物处理的H2228细胞G2/G1:(96.26±0.80)%/(1.55±0.57)%,未经过药物处理的H2228细胞G2/G1:(14.49±2.16)%/(70.22±2.77)%,药物处理使细胞明显抑制在G1期,见图4。

表1 细胞抑制率

Figure 2. Morphological changes of H2228 cells treated by crizotinib.The number of apoptotic cells was increased with the time of crizotinib treatment; even a blank area can be found after crizotinib treated for 72 h (the red circle).
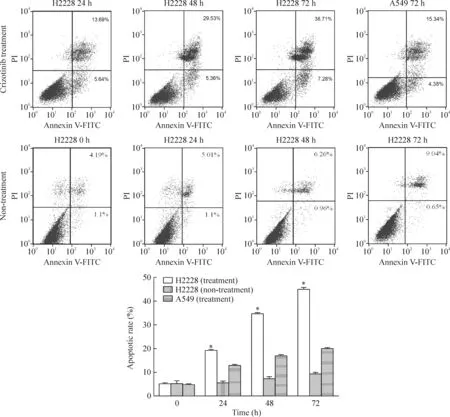
Figure 3. Apoptotic rates of H2228 and A549 cells after treated with 300 nmol/L crizotinib at different time points.Mean±SD.n=4.*P<0.05 vs other groups.
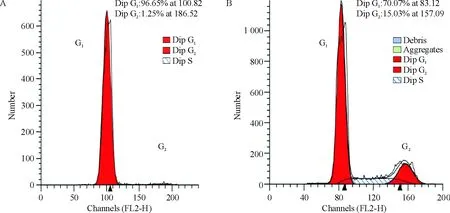
Figure 4. Cell cycle distribution of H2228 cells after treaded with (A) or without (B) 300 nmol/L crizotinib for 72 h.
4 Western blotting检测crizotinib对mTOR信号通路相关信号蛋白表达的影响
300 nmol/L crizotinib处理EML4-ALK阳性肺癌细胞株H2228 72 h发现磷脂酰肌醇激酶相关激酶(phosphatidylinositol kinase-related kinases,PIKKs)蛋白家族成员中p-mTOR分子表达降低,其上游信号p-AKT、p-PI3K、p-ALK及下游信号分子p-p70S6K表达均降低,而在相对不敏感的EML4-ALK阴性细胞株A549中表达变化不明显,见图5。

Figure 5. Western blotting results of the protein expression levels in H2228 and A549 cells after treated with 300 nmol/L crizotinib for 72 h.
讨 论
mTOR是PIKKs蛋白家族成员,可通过多条信号通路实现对细胞生长的调节作用,一条是生长因子激活通路经PI3K/AKT途径,另一条是细胞外氨基酸通路,再一条是经肝激酶 B1(liver kinase B1,LKB1)/AMP激活蛋白激酶[adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPK]途径。有研究显示PI3K/AKT/mTOR信号通路的活化与多种肿瘤发生密切相关,它能够加速细胞复制周期、减少细胞凋亡,并促进肿瘤细胞的迁移,在脑胶质瘤、乳腺癌、卵巢癌等疾病的发生发展中发挥重要作用[2-4],也有文献证实PI3K可以被ALK信号所激活[5-7],但具体机制尚未完明阐明。Crizotinib为针对ALK/c-Met双靶点的小分子酪氨酸激酶抑制剂,进入胞浆后与位于细胞膜内侧的酪氨酸激酶ATP结合域相结合,通过阻断该通路的信号传导来实现细胞的生长抑制和促进凋亡[8],然而crizotinib诱导细胞凋亡的机制复杂,许多环节仍不清楚,有待进一步研究。
我们的研究发现H2228细胞中含有EML4-ALK融合基因V3,且发现V3有2个亚型V3a和V3b,这与Martelli等[9]的研究结果相一致,该研究发现V3b比V3a多出的33 bp是来自于EML4的内含子6,本实验结果中也得到证实,但是否不同的亚型存在其它方面的差异仍需要进一步实验求证。在使用crizotinib作用EML4-ALK阳性细胞株H2228时, 其凋亡细胞百分率在早期即与对照细胞株A549有明显差异,且随着培养时间延长和浓度的增加而增大,crizotinib处理的H2228细胞各时点和各浓度值凋亡细胞比例均大于坏死细胞,呈时间依赖性和浓度依赖性,在用crizotinib处理细胞后细胞的凋亡率显著增加并且检测出mTOR蛋白的活化形式p-mTOR水平降低,推测mTOR在调控肿瘤细胞的生长方面有重要作用。目前认为,在含有EML4-ALK融合基因的肿瘤细胞中持续活化的ALK通过依次磷酸化其底物蛋白,以聚集PI3K的p85亚基,并将信号传递给p110亚基,导致PI3K的激活;活化的PI3K 催化磷脂酰肌醇P2(phosphatidylinositol P2,PtdIinsP2)变成PtdIinsP3,两者仍留在膜上,可以募集下游分子AKT到细胞膜上,PtdIinsP3可激活磷脂酰肌醇依赖性激酶1,后者可使AKT激活, 活化AKT的可直接激活mTOR,也可通过抑制结节性硬化复合物2(tuberous sclerosis complex 2,TSC2)与TSC1 形成复合物来激活mTOR信号,活化的mTOR可以磷酸化并激活P70S6K,使核糖体40S小亚基易于结合翻译复合物,并提高5’-mTOR mRNA的翻译效率[10]。为进一步阐明mTOR在crizotinib诱导的EML4-ALK阳性细胞凋亡中的分子机制,我们采用Western blotting法对PI3K/AKT/mTOR信号通路进行检测,实验结果显示H2228细胞在crizotinib的作用下EML4-ALK V3融合蛋白的表达量未受影响,但其活化形式p-ALK明显受到抑制,这与Kim等[11]的研究结果相一致。Crizotinib靶向作用于ALK蛋白,抑制其酪氨酸激酶域的磷酸化,使其不能活化[12],而且下游信号蛋白PI3K、AKT和mTOR的活化形式p-PI3K、p-AKT和p-mTOR的表达水平都受到抑制,这与Tanizaki等[13]的实验结果中所示的p-AKT不受ALK抑制剂的影响不符,而与Kim等[11]的研究结果相同。在不含有EML4-ALK的A549细胞中由于不含有EML4-ALK融合蛋白,未见ALK蛋白的表达,这与Katayama等[14]的实验结果相一致;而且在A549细胞中未见到p-AKT和p-mTOR蛋白的表达水平受crizotinib的影响而下降,提示在含有EML4-ALK融合基因的H2228细胞中PI3K/AKT/mTOR通路的激活与ALK的活化密切相关[15-17]。在crizotinib处理的H2228细胞中mTOR下游蛋白p70S6K的活化形式p-p70S6K蛋白水平也降低,提示mTOR可能是通过下游蛋白p70S6K对细胞的生长进行调控;而在A549细胞中虽然p-mTOR水平很高,但下游蛋白p70S6K的活化水平却很低,提示在A549细胞中mTOR可能是通过细胞外氨基酸通路,或者是经LKB1/AMPK途径对细胞的生长进行调控[10],但还需要进一步实验去证实。同时在对经过crizotinib处理的H2228细胞进行细胞周期检测时发现大量细胞停留在G1期,与Tumati等[18]所得研究结果一致。由于mTOR信号通路在调节细胞周期方面有关键作用[19-20],提示mTOR信号通路可能在G1/S期转换过程中起重要作用。
本研究表明了PIKK蛋白家族成员mTOR在crizotinib诱导的EML4-ALK阳性细胞株H2228凋亡中发挥了重要作用。由于crizotinib等酪氨酸激酶抑制剂类药物作用于靶细胞后,通常会引发多通路、多分子的后继变化,通过对其诱导细胞凋亡的分子机制研究,有助于遴选关键分子,采用有效的刺激诱导上调肿瘤细胞中相关促凋亡分子的表达水平或联合“沉默”降低相关抗凋亡分子的表达,为肺癌治疗探索的新方法,也为今后深入研究靶向耐药机制提供分子生物学基础。本实验仍有一些不足,在以后的研究中可以进一步追进,如可以对mTOR信号通路关键基因进行敲除,培养敲除关键基因后的细胞,检测mTOR信号通路上各关键蛋白的表达水平和活化水平,进一步明确通路上各蛋白之间的关系,敲除关键基因的细胞用同样条件的药物处理,检测此时的IC50和流式细胞周期和凋亡率是否发生变化,进一步阐明mTOR信号通路在H2228细胞凋亡中所起的作用。
[参 考 文 献]
[1] 林小梅,莫娟梅,邹 敏,等.EGFR突变的非小细胞肺癌患者EML4-ALK融合基因的检测及其临床特征分析[J].中国病理生理杂志,2012,28(6): 1135-1139.
[2] Choe G, Horvath S, Cloughesy TF, et al. Analysis of the phosphatidylinositol 3’-kinase signaling pathway in glioblastoma patientsinvivo[J].Cancer Res, 2003, 63(11): 2742-2746.
[3] Philp AJ, Campbell IG, Leet C, et al.The phosphatidylinositol 3’-kinase p85α gene is an oncogene in human ova-rian and colon tumors[J].Cancer Res, 2001, 61(20): 7426-7429.
[4] Phillips RJ, Mestas J, Gharaee-Kermani M, et al. Epidermal growth factor and hypoxia-induced expression of CXC chemokine receptor 4 on non-small cell lung cancer cells is regulated by the phosphatidylinositol 3-kinase/PTEN/AKT/mammalian target of rapamycin signaling pathway and activation of hypoxia inducible factor-1 alpha[J].J Biol Chem, 2005, 280(23): 22473-22481.
[5] Shaw RJ, Cantley LC. Ras,PI(3)K and mTOR signalling controls tumour cell growth[J].Nature,2006,441(7092):424-430.
[6] Kozma SC, Thomas G. Regulation of cell size in growth development and human disease:PI3K,PKB and S6K[J].Bioessays,2002,24(1): 65-71.
[7] Hay N, Sonenberg N. Upstream and downstream of mTOR[J].Genes Dev, 2004, 18(16): 1926-1945.
[8] Kwak EL, Bang YJ, Camidge DR,et al.Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer[J].N Engl J Med, 2010, 363(18):1693-1703.
[9] Martelli MP, Sozzi G, Hernandez L, et al. EML4-ALK rearrangement in non-small cell lung cancer and non-tumor lung tissues[J].Am J Pathol,2009,174(2):661-670.
[10] Morgan TM, Koreckij TD, Corey E,et al.Targeted therapy for advanced prostate cancer: inhibition of the PI3K/AKT/mTOR pathway[J].Curr Cancer Drug Targets, 2009,9(2): 237-249.
[11] Kim HR, Kim WS, Choi YJ, et al.Epithelial-mesenchymal transition leads to crizotinib resistance in H2228 lung cancer cells with EML4-ALK translocation[J].Mol Oncol, 2013,7(6):1093-1102.
[12] Ou SH.Crizotinib: a novel and first-in-class multitargeted tyrosine kinase inhibitor for the treatment of anaplastic lymphoma kinase rearranged non-small cell lung cancer and beyond[J].Drug Des Devel Ther, 2011,5:471-485.
[13] Tanizaki J,Okamoto I,Takezawa K,et al.Combined effect of ALK and MEK inhibitors in EML4-ALK-positive non-small-cell lung cancer cells[J].Br J Cancer, 2012 ,106(4):763-767.
[14] Katayama R, Khan TM, Benes C,et al.Therapeutic strategies to overcome crizotinib resistance in non-small cell lung cancers harboring the fusiononcogene EML4-ALK[J].Proc Natl Acad Sci U S A, 2011,108(18):7535-7540.
[15] Gaughan EM, Costa DB.Genotype-driven therapies for non-small cell lung cancer: focus onEGFR,KRASandALKgene abnormalities[J].Ther Adv Med Oncol, 2011,3(3):113-125.
[16] Shaw AT, Solomon B.Targeting anaplastic lymphoma kinase in lung cancer[J].Clin Cancer Res, 2011,17(8):2081-2086.
[17] Weickhardt, Andrew J,Camidge, et al.The therapeutic potential of anaplastic lymphoma kinase inhibitors in lung cancer: rationale and clinical evidence[J].Clin Invest, 2011,1(8):1119-1126.
[18] Tumati V, Kumar S, Yu L,et al.Effect of PF-02341066 and radiation on non-small cell lung cancer cells[J].Oncol Rep, 2013,29(3):1094-1100.
[19] Fingar DC, Salama S, Tsou C,et al.Mammalian cell size is controlled by mTOR and its downstream targets S6K1 and 4EBP1/eIF4E[J].Genes Dev, 2002,16(12):1472-1487.
[20] Jain P,Bhalla US.Signaling logic of activity-triggered dendritic protein synthesis: an mTOR gate but not a feedback switch[J].PLoS Comput Biol,2009,5(2): e1000287.

