橙汁中总糖和果肉的δ13C测定及应用
钟其顶,王道兵,,郑 淼,仇 凯,武竹英,熊正河,黄占斌
(1. 中国食品发酵工业研究院,北京 100027;2. 全国食品发酵标准化中心,北京 100027;3. 中国矿业大学(北京)化学与环境工程学院,北京 100083)
橙汁是一种广受全球消费者钟爱的果汁品种,其销量占全球果汁的一半以上。其中,中高档的复原橙汁和非复原橙汁(以下统称100%橙汁)以其天然、健康、纯净的特色备受消费者青睐。然而由于国内柑橘主要是鲜食品种,大量100%橙汁的生产原料需从巴西、美国、以色列等地进口。在供应短缺的情况下,不法人员受利益驱使向橙汁中加入廉价原材料,如甘蔗糖、甜菜糖或高果玉米糖浆,来冒充100%橙汁。虽然国家标准中对果汁含量有明确要求,但由于国内相关研究起步较晚,当前对橙汁质量的检测主要集中在理化、农残、微生物和重金属等方面[1-7],缺乏有效地鉴别100%橙汁的技术方法。
国外有研究表明,稳定碳同位素技术在食品质量评估中具有重要作用[8-16]。在橙汁质量鉴别和产地溯源领域,稳定同位素的应用研究也取得了一些突破性进展[17-22],其中根据碳同位素组成检测橙汁的C4植物糖的方法已被采纳为国际方法。然而,目前国际上通用的测定果汁中总糖和果肉δ13C的方法[23]存在劳动强度大、对实验人员要求高的特点,难以推广实施。
本研究拟建立元素分析-稳定同位素比值质谱(EA-IRMS)测定橙汁中总糖和果肉δ13C的方法。通过调查天然橙汁中碳同位素特征,并对掺入C4和C3 植物糖浆的橙汁检测进行研究,希望为我国有关部门进一步开展橙汁掺假鉴别研究及监管工作提供科学根据和数据基础。
1 实验部分
1.1 主要装置与仪器
元素分析-稳定同位素比值质谱仪:美国Thermo Fisher公司产品;Flash 2000 EA,Delta V Advantage IRMS,离心机:美国Sigma 公司产品;冷冻干燥机:北京亚泰科隆仪器技术有限公司产品;电热恒温水浴箱:北京中慧天诚科技有限公司产品;磁力搅拌器:北京世纪华科实验仪器有限公司产品;十万分之一天平:瑞士Mettler-Toledo公司产品。
1.2 主要试剂与材料
丙酮、氢氧化钙和硫酸(分析纯):北京化学试剂厂产品;锡杯:Element Microanalysis公司产品;EA-IRMS标准物质:IAEA 600(δ13CPDB=-27.771±0.043‰)和IAEA-CH-6(δ13CPDB=-10.40 ± 0.2‰),由国际原子能机构提供。
6种脐橙样品:产地分别为中国、菲律宾和美国;甜菜糖和甘蔗糖:均购自家乐福超市。
1.3 样品处理
样品处理过程参照文献[23]进行。选取新鲜、饱满、无病斑、无划痕的脐橙,去除果皮和果核后榨汁,经3层纱布过滤后,取滤液待用。
1.3.1分离橙汁中总糖和果肉 取40 mL橙汁于50 mL离心管中,在相对离心力(RCF)为1 400 g 条件下离心10 min,将上清液和沉淀分别保存待用。
1.3.2纯化分离总糖 将1.3.1中得到的上清液转移至100 mL小烧杯中,加入1.6 g氢氧化钙粉末,搅拌均匀后于90 ℃水浴中静置3 min;将上述热溶液转移至50 mL离心管中,在RCF为1 400 g条件下离心3 min,去除沉淀,用0.1 mol/L硫酸溶液调整上清液至pH 5.0;将酸化后的上清液置于4 ℃冰箱静置约15 h,去除沉淀,将溶液冷冻干燥,并均质成粉末。
1.3.3纯化分离果肉 用蒸馏水复溶1.3.1中的沉淀至40 mL,在RCF为1 400 g条件下离心10 min后,去除上清液,重复操作1次;取10 mL丙酮复溶沉淀并离心,去除上清液后,再用丙酮洗涤沉淀2次;去除沉淀中残留的丙酮,将沉淀进行冷冻干燥,并均质成粉末。
1.4 实验条件
氧化管温度980 ℃,还原管温度680 ℃,柱温60 ℃,氦气流速100 mL/min。称取约0.1 mg粉末于锡杯中,包好后待测;每个样品平行测定2次,得出样品的δ13C。
样品测定序列中同时测定2个参考物质,依据Stephen等[24]报道的校正法进行校正,得出样品的δ13CPDB。
2 结果与讨论
2.1 前处理步骤的影响
样品前处理过程涉及多次洗涤、离心,对于分子质量较小的葡萄糖、果糖和蔗糖,若提取时糖的回收率不能达到100%,可能导致碳同位素出现动力学分馏。为验证前处理过程中的碳同位素分馏现象,以葡萄糖为研究对象(EA-IRMS测得其δ13CPDB=-10.92±0.08‰,n=5),配制100 g/L葡萄糖水溶液,按照1.3中步骤进行处理后,测定其δ13CPDB,结果列于表1。其中标准偏差最大为0.18‰,结果表明,该样品处理过程分离纯化橙汁总糖时不会导致碳同位素分馏。

表1 葡萄糖δ13CPDB分馏实验Table 1 Carbon isotope fractionation test
注: *表示3次测定的标准偏差;
**表示2份糖的测定偏差
2.2 稳定性分析
以一种橙汁为研究对象,分离、干燥并测定其总糖和果肉的δ13CPDB值,重复测定4次,结果列于表2。其中最大的标准偏差仅为0.1‰,说明使用该方法测定橙汁中总糖和果肉的δ13CPDB符合重复性测定要求。

表2 橙汁中总糖和果肉的δ13CPDB测定重复性Table 2 Repeatabilities of δ13CPDB of sugar and pulp from orange juice
2.3 果肉中残糖验证
为验证该方法能够得到完全不含糖分的果肉样品,即验证果肉粉末中是否会有糖分残留,需选择一种橙汁为研究对象,分别加入50 g/L、100 g/L葡萄糖(δ13CPDB=-10.92)水溶液,制备为样品1和样品2,然后按照1.3中的方法进行前处理,并测定果肉的δ13CPDB值,结果列于表3。
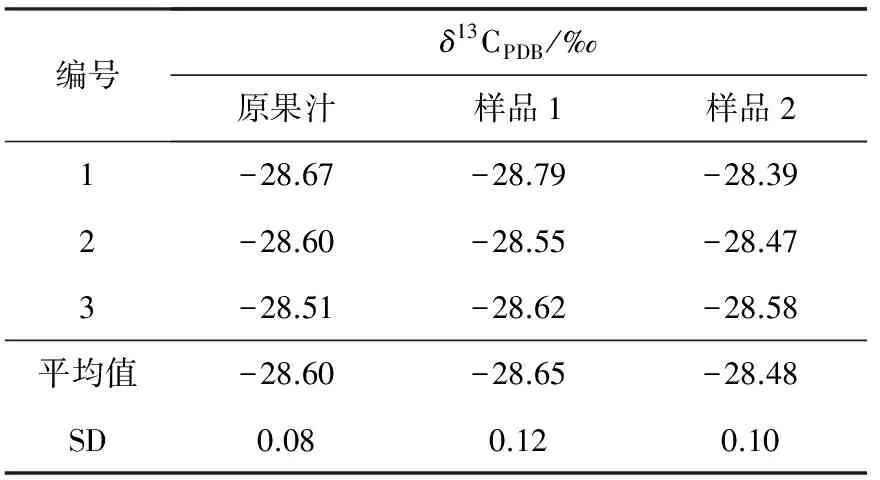
表3 不同掺糖果汁中果肉的δ13CPDBTable 3 δ13CPDB of pulp from fake orange juices
由表3中数据可知,加入不同浓度的葡萄糖溶液,尽管葡萄糖的δ13CPDB与目标橙汁相差悬殊,但结果表明,该处理方式下得到的果肉粉末中并无糖残留,说明前处理方法能够有效地分离果肉和总糖。
2.4 方法再现性
为验证方法的再现性,本研究按照GB 6379.2 《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》的有关规定对本方法进行了对比分析,各实验室测定的平均结果列于表4。结果表明,该方法的重现性整体优于CEN标准中认定的重现性要求。
2.5 橙汁中δ13CPDB的特征
将不同产地的脐橙榨汁后测定其总糖和果肉的δ13CPDB值,结果示于图1。
初步研究表明,产自中国、菲律宾和美国的脐橙中总糖与果肉的δ13CPDB均显现出C3植物的碳同位素特征,波动范围为-25.40‰~-27.21‰,并且糖和果肉的δ13CPDB显示出良好的相关性,线性相关系数R2为0.996。
2.6 橙汁中δ13CPDB与外源糖含量的关系
为确定橙汁总糖和果肉δ13CPDB与外源糖含量的关系,以某产地橙汁为研究对象,按5%、10%、15%、30%和40%的比例向橙汁中加入同等浓度的甘蔗糖水溶液(δ13CPDB=-12.38‰),处理后测定上述模拟“橙汁”的总糖和果肉的δ13CPDB值,结果示于图2。
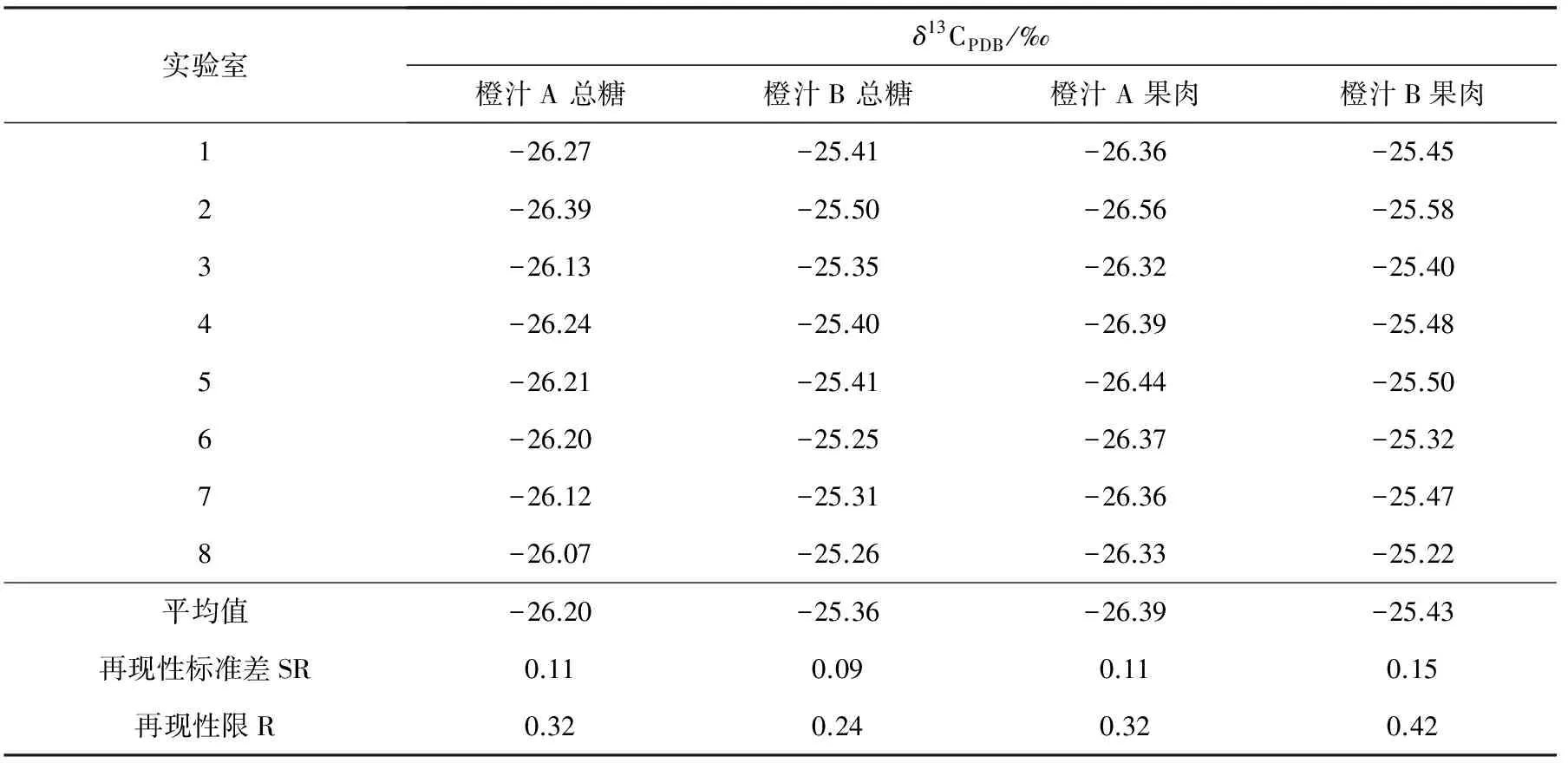
表4 橙汁中总糖和果肉δ13CPDB的实验室协同实验测定值Table 4 Repeatability and reproducibility of δ13CPDB of sugar and pulp from orange juice

图1 橙汁中总糖与果肉δ13CPDB的关系Fig.1 Correlation between the δ13CPDB of sugar and pulp recovered from orange juice
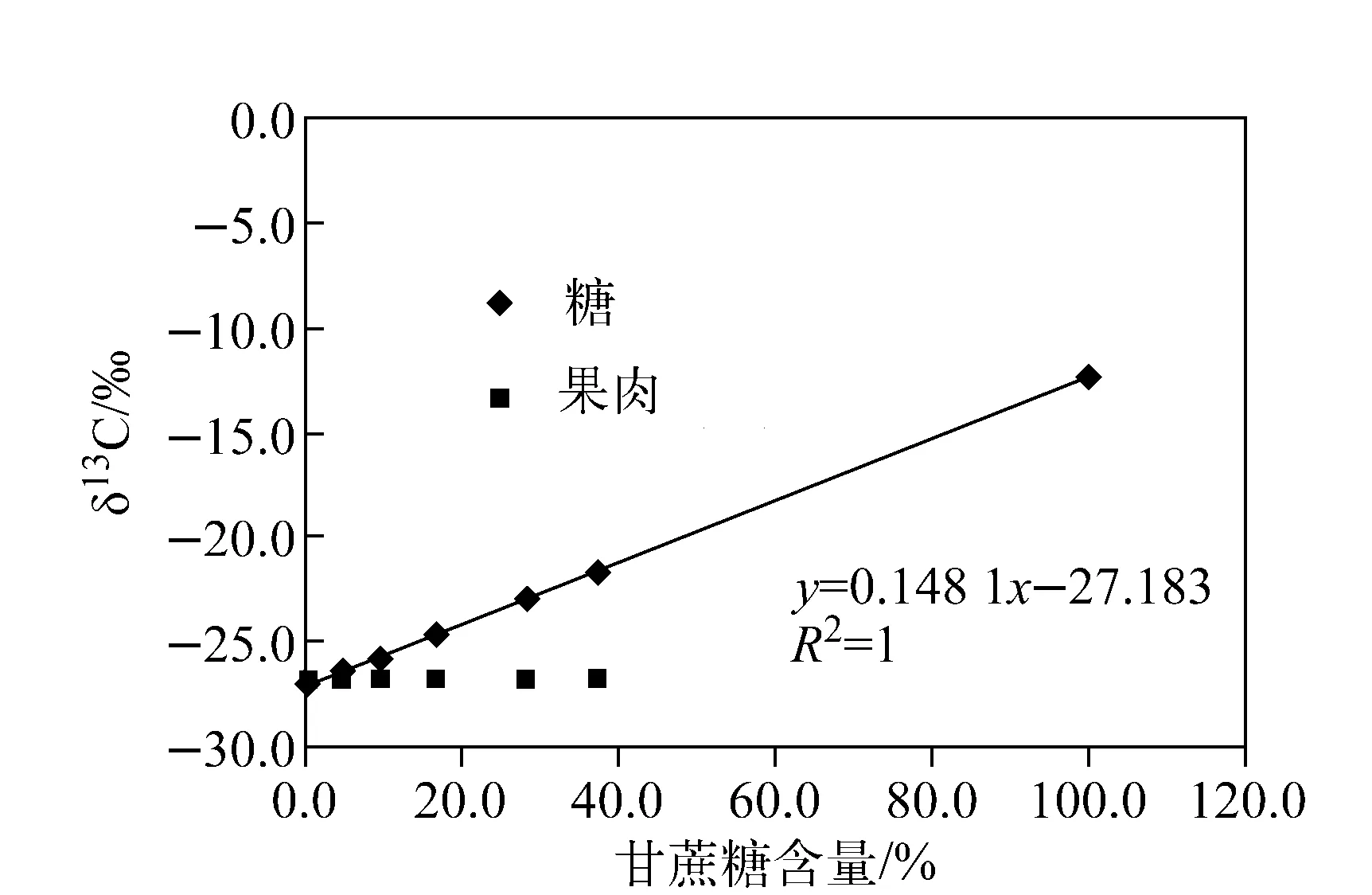
图2 δ13CPDB与甘蔗糖含量的相关性分析Fig.2 Plot of δ13CPDB values of sugars and pulp, versus percentage of cane sugar addition
由图2可见,由于甘蔗糖来源于C4植物甘蔗,其δ13CPDB与橙汁总糖和果肉差异显著,上述样品中总糖的δ13CPDB随甘蔗糖溶液含量的增大而上升,且δ13CPDB与甘蔗糖溶液比例呈显著正相关。然而,无论甘蔗糖溶液含量多少,样品果肉中δ13CPDB始终恒定,利用此关系,可以以橙汁样品的果肉为内标,计算样品中甘蔗糖含量,橙汁中甘蔗糖含量的计算公式为:
式中,W为产品中甘蔗糖含量;δ13C果肉为产品的果肉中δ13CPDB值;δ13C糖为产品的糖中δ13CPDB测定值。根据表3,自然状态下糖中δ13CPDB比果肉偏正最大值为0.13‰;本研究中甘蔗糖的δ13CPDB值为-12.38。
然而向橙汁中掺入同等浓度的甜菜糖溶液时,由于甜菜与脐橙同属C3植物,尽管掺入量接近40%,但糖中δ13CPDB依然在本实验所得到的橙汁δ13CPDB的波动范围内,结果列于表5。这表明本方法难以检出橙汁中混入的其他C3植物糖。

表5 掺入甜菜糖后橙汁糖中δ13CPDBTable 5 δ13CPDB of sugar from faked samples
3 讨论
植物因光合作用途径差异而被分为C3植物、C4植物和CAM植物,相应的有机质稳定碳同位素组成也呈现明显差异,这是稳定碳同位素分析技术用于鉴别100%果汁真实性的基础。需要说明的是,尽管有机质中碳同位素组成主要受光合作用途径影响,但气候条件、生长环境、水分胁迫作用,肥料中C/N比均会导致同种植物有机质的碳同位素组成差异,本实验的研究结果也证实了这一点;同时,本实验所建立的鉴别C4植物糖的技术只是以单一的干蔗糖为例,未研究其他C4植物,如玉米等的碳同位素组成,亦未深入调查不同地区同一种C4植物的碳同位素组成差异,尤为重要的是在建立鉴别公式时所依据的橙汁样本也仅有6个,这在应用稳定同位素技术进行鉴别时是远远不够的,因此,本实验只是以少量的数据揭示橙汁自有的碳同位素特征,简单介绍本技术对100%橙汁真实性鉴别中的应用潜力,而真正的推广应用还需建立在系统的回归关系分析和详尽的鉴别精度研究的基础之上。
4 结论
本研究建立了离心干燥法结合EA-IRMS测定橙汁中总糖和果肉δ13CPDB的方法,该方法的前处理过程中无同位素分馏产生,能够完全分离总糖和果肉,重复性良好,再现性结果也符合CEN的要求。 针对不同橙汁中总糖和果肉的实验研究表明:同一来源的两种物质的δ13CPDB呈良好相关性,而模拟实验表明总糖δ13CPDB与外加的甘蔗糖含量显著相关,但果肉δ13CPDB保持恒定,因此该技术可用于橙汁样品中C4植物糖含量检测。
参考文献:
[1] 陈爱华, 焦必宁. 常见果汁掺假检测技术的研究进展 [J].中国食品添加剂, 2007,(5):153-156.
CHEN Aihua, JIAO Bining. Detection technique for discovering fruit juice adulteration [J]. China Food Additives, 2007, (5):153-156 (in Chinese).
[2] 吴建中, 唐书泽, 孙 唏, 等. 果汁饮料中原果汁含量检测技术的现状 [J]. 食品与发酵工业, 2006,32(2):78-82.
WU Jianzhong, TANG Shuze, SUN Xi, et al. Review on detection techniques about primary fruit juice content in fruit drinks[J]. Food and Fermentation Industries, 2006,32(2):78-82 (in Chinese).
[3] 牛丽影,胡小松,赵 镭, 等.橙汁主要矿质元素含量的特征分析[J]. 光谱学与光谱分析, 2009,29(1):259-262.
NIU Liying, HU Xiaosong, ZHAO Lei, et al. The characteristic analysis of several mineral contents in Chinese orange juice[J]. Spectroscopy and Spectral Analysis, 2009,(29)(1):259-262(in Chinese).
[4] 赵 镭,牛丽影,汪厚银,等. 橙汁感官品质指标重要性调查分析[J]. 食品科学,2008,29(9):62-65.
ZHAO Lei, NIU Liying, WANG Houyin, et al. Importance and preference investigation of orange juice sensory properties[J]. Food Science, 2008, 29(9):62-65(in Chinese).
[5] 贾 恺,牛丽影,赵 镭,等.橙汁品质评价国内外研究现状[J]. 饮料工业, 2009,12(3):4-7.
JIA Kai, NIU Liying, ZHAO Lei, et al. Status quo of research on quality evaluation of orange juice[J]. Beverage Industry, 2009, 12(3):4-7 (in Chinese).
[6] 牛丽影,吴继红,廖小军,等.不同类型橙汁挥发性风味成分的测定与比较[J]. 中国食品学报, 2008,(1):119-124.
NIU Liying, WU Jihong, LIAO Xiaojun, et al. Determination and comparison of the volatile flavor constituents from different types of orange juice[J]. Journal of Chinese Institute of Food Science and Technology, 2008, (1):119-124 (in Chinese).
[7] 姚艳玲,倪炜华,顾 益. LC-MS快速检测橙汁中苯并咪唑类农药[J]. 中国卫生检验杂志, 2013,23(1):33-35.
YAO Yanling, NI Weihua, GU Yi. Rapid determination of benzimidazole pesticide in orange juice by liquid chromatography-mass spectrometry[J]. Chinese Journal of Health Laboratory Technology, 2013, 23(1):33-35(in Chinese).
[8] REID L M, O'DONNELL C P, DOWNEY G. Recent technological advances for the determination of food authenticity[J]. Trends in Food Science & Technology, 2006, 17(7): 344-353.
[10] JORGE E, SPANGENBERG. Authentication of vegetable oils by bulk and molecular carbon isotope analyses with emphasis on olive oil and pumpkin seed oil[J]. J Agric Food Chem, 2001, 49 (3):1 534-1 540.
[11] 费晓庆,吴 斌,沈崇钰,等. 液相色谱/元素分析-同位素比值质谱联用法鉴定蜂蜜掺假[J]. 色谱,2012, 30(1):15-19.
FEI Xiaoqing, WU Bin, SHEN Chongyu, et al. Honey adulteration detection using liquid chromatography/elemental analysis-isotope ratio mass spectrometry[J]. Chinese Journal of Chromatography, 2012, 30(1):15-19(in Chinese).
[12] AGUILAR-CISNEROS B O, LPEZ M G, RIC-
HLING E, et al. Tequila authenticity assessment by headspace SPME-HRGC-IRMS analysis of13C/12C and18O/16O ratios of ethanol[J]. J Agric Food Chem, 2002, 50(26):7 520-7 523.
[13] FÖRSTEL H. The natural fingerprint of stable isotopes—use of IRMS to test food authenticity[J]. Anal Bioanal Chem, 2007, 388(3):541-544.
[14] CAMIN F, BONTEMPO L, PERINI M, et al. Control of wine vinegar authenticity through δ18O analysis[J]. Food Control, 2013, 29 (1): 107-111.
[15] MOLKENTIN J, GIESEMANN A. Differentiation of organically and conventionally produced milk by stable isotope and fatty acid analysis[J]. Anal Bioanal Chem, 2007 ,388(1):297-305.
[16] THOMAS F, RANDET C, GILBERT A, et al.
Improved characterization of the botanical origin of sugar by carbon-13 SNIF-NMR applied to ethanol[J]. J Agric Food Chem,2010, 58(22): 11 580-11 585.
[17] SIMPKINS W A, PATEL G, COLLINS P, et al.
Oxygen isotope ratios of juice water in Australian oranges and concentrates[J]. J Agric Food Chem, 1999 ,47(7):2 606-2 612.
[18] HOUEROU G, KELLY S D, DENNIS M J. Determination of the oxygen-18/oxygen-16 isotope ratios of sugar, citric acid and water from single strength orange juice[J]. Rapid Commun Mass Spectrom, 1999,13(13):1 257-1 262.
[19] MICHAEL A, XIA LI, KEVIN R. Detection of adulteration in Australian orange juices by stable carbon isotope ratio analysis (SCIRA) [J]. J Agric Food Chem, 2001, 49 (5): 2 623-2 626.
[20] WAYNE A S, GORDHAN P, MARK H, et al. Stable carbon isotope ratio analysis of Australian orange juices[J]. Food Chemistry, 2000, 3(15): 385-390.
[21] BRICOUT J, KOZIET J. Control of the authenticity of orange juice by isotopic analysis[J]. J Agric Food Chem, 1987, 35 (5): 758-760.
[22] LANDIS W D, DONALD D B. Stable carbon is-
otope ratios in orange juice [J]. Journal of Agricultural and Food Chemistry, 1981, 29(4):803-804.
[23] KOZIET J, ROSSMANN A, MARTIN G J, et al.
Determination of carbon-13 content of sugars of fruit and vegetable juices A European inter-laboratory comparison[J]. Analytica Chimica Acta, 1993, 1(8):31-38.
[24] STEPHEN T, NELSON A. Simple, practical me-
thodology for routine VSMOW/SLAP normalization of water samples analyzed by continuous flow methods[J]. Rapid Commun Mass Spectrom, 2000, 12(14): 1 044-1 046.

