腹腔镜超声在腹腔镜解剖性肝切除术中的应用*
汪 磊 李 宏
(宁波市医疗中心李惠利医院微创外科,宁波 315040)
·临床论著·
腹腔镜超声在腹腔镜解剖性肝切除术中的应用*
汪 磊①李 宏**
(宁波市医疗中心李惠利医院微创外科,宁波 315040)
目的探讨腹腔镜超声(laparoscopic ultrasonography,LUS)在腹腔镜解剖性肝切除术(laparoscopic anatomical hepatectomy,LAH)中的应用价值。方法回顾性分析李惠利医院微创外科2008年9月~2011年9月腹腔镜解剖性肝切除32例临床资料。肝内胆管结石14例,原发性肝癌6例,肝血管瘤4例,肝局灶性增生2例,结直肠癌肝转移6例。术中使用LUS检查,帮助了解腹腔镜解剖性肝切除的手术解剖入路,确定肿瘤分期、切缘,良、恶病灶和周围肝内管道之间的关系。结果27例(84%)按原定手术计划完成手术,2例(6%)根据LUS发现及时更改了手术计划(1例为左肝内胆管结石遗漏胆总管小结石,1例Ⅴ段原发性肝癌患者遗漏肝脏Ⅵ段直径6 mm卫星灶),3例(9%)因LUS发现肿瘤无法切除终止手术。结论LUS提高手术的精准性、安全性和彻底性,发现术前影像检查的漏诊或误诊以指导手术,避免不必要的剖腹探查,值得推广。
腹腔镜; 腹腔镜超声; 解剖性肝切除
随着对肝脏解剖认识的不断深入,肝脏外科经历了局部肝切除、不规则肝切除、规则肝切除,演变到如今依据肝段的解剖性肝切除。腹腔镜解剖性肝切除(laparoscopic anatomical hepatectomy,LAH)很好地解决了腹腔镜肝切除术中有效控制出血、预防CO2气栓、彻底治疗疾病、避免健侧肝脏的缺血再灌注损伤、减少肝门阻断后肠管淤血、肠道内毒素吸收等诸多问题,成为目前肝脏良、恶性疾病的微创治疗方式,而腹腔镜超声(laparoscopic ultrasonography,LUS)在LAH术中起到至关重要的作用。2008年9月~2011年9月,我院行LAH术32例,术中使用LUS检查肝脏,确定肿瘤切缘及肝切除线,利用LUS发现术前检查遗漏,指导手术和改变手术方式,现总结报道如下。
1 临床资料与方法
1.1 一般资料
本组32例,男15例,女17例。年龄32~70岁,平均56.6岁。①14例肝内胆管结石,其中8例有上腹部和胸背部胀痛不适(2例伴畏寒、发热,入院体温38.5、38.7 ℃),6例无明显不适症状(体检B超发现左或右一侧肝内胆管多发结石,伴左肝外叶或右肝后叶肝实质萎缩)。入院后均行腹部B超、上腹部CT、MRCP等检查,诊断肝内胆管多发结石,并排除胆管细胞癌。4例伴胆囊结石,3例伴胆总管结石。②18例肝占位病变,其中上腹部饱胀不适6例,肝区疼痛、消瘦、乏力4例,2例体检B超发现肝内实质性占位,6例因结直肠腺癌术前B超提示肝内转移性占位,腹部增强CT、MRI等检查提示肝内良性占位6例(其中肝血管瘤4例,直径6.4~10.2 cm,平均7.8 cm),原发性肝癌6例(1.8~5.0 cm,平均2.8 cm,未发现门静脉及胆管内癌栓),肝转移瘤6例。5例AFP>400 μg/L。
纳入标准:符合腹腔镜肝切除手术适应证。①肝内结石:结石范围局限于左肝外叶、右肝后叶或左右半肝内,排除左右肝内胆管广泛结石;②肝内良性占位:病变局限于左或右半肝内,行半肝切除可完整切除肿块。③肝内恶性占位:肿瘤直径<6.0 cm,排除门静脉、胆管内癌栓、肿瘤肝内及远处广泛转移。④肝功能Child分级B级以上,吲哚菁绿排泄试验评估肝脏储备功能在相对正常范围。
排除标准:除与开腹肝切除禁忌证相同外,还包括不能耐受气腹及全身麻醉;腹腔内粘连难以分离暴露病灶;病变紧邻或直接侵犯大血管;病变紧邻第一、第二或第三肝门,影响暴露和分离;肝门被侵犯或病变本身需要大范围的肝门淋巴结清扫者[1]。
1.2 方法
1.2.1 LUS检查方法 使用日本阿洛卡Prosound SSD-α5超声机,探头为末端可屈曲软质探头(UST-5536 7.5 MHz),通过直径10 mm、30°腹腔镜的屏幕监视超声扫描全过程(图1)。平卧位,头高脚低30°,左倾或右倾30°体位。建立人工气腹,压力13 mm Hg(1 mm Hg=0.133 kPa),采用五孔法切肝,切肝时气腹压力调整为10 mm Hg预防气栓。恶性肿瘤先行腹腔镜探查,随后LUS检查肝脏。LUS检查肝脏常规的腹部戳孔位置可分为剑突下,左、右上腹肋缘下,脐平面左、右腹直肌外侧缘等几个通道(图2),术者根据操作习惯和肝切除部位选择相应通道,通道之间可以相互转换探头和腹腔镜器械,完成对整个肝脏的扫描。LUS扫描顺序为先膈面再脏面,先扫描无病灶一叶,再扫描病灶叶。对于第Ⅰ、Ⅶ、Ⅷ段等位置较高或较深在的肝段,可采用切断肝脏周围韧带,如肝三角韧带、镰状韧带、肝圆韧带等,使肝脏游离,辅以腹腔镜器械牵拉,借助末端可屈曲式超声探头,可以伸入“肝裸区”,扫描第二肝门肝静脉起始部位,以探查第Ⅶ、Ⅷ肝段;游离肝脏各韧带后,借助腹腔镜器械向上牵拉肝脏,可在脏面扫描第Ⅰ肝段。扫描应细致、全面,从脏、膈两面进行扫描,避免疏漏肝内细小的病灶。带有彩色多普勒(Color doppler flow imaging,CDFI)的探头还可显示病灶内血供、周边滋养血管及病灶与周围血管、胆管之间的关系(图3~6)。
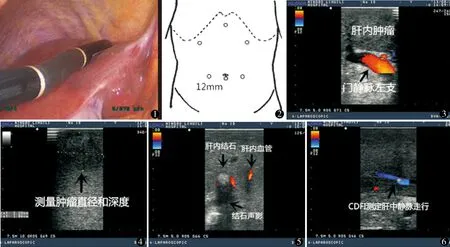
图1 LUS检查肝脏 图2 LUS trocar穿刺点体表定位 图3 肝内肿瘤与门静脉关系 图4 LUS测量肿瘤直径和深度 图5 LUS检查肝内结石分布范围 图6 LUS测定肝中静脉位置及走行
1.2.2 LAH手术关键步骤 使用超声刀、LigaSure等设备切肝,LigaSure可直接闭合肝脏大部分血管及胆管,代替常规的结扎、缝扎方法,具有安全、止血可靠、体内无异物存留等特点[2]。首先游离肝圆韧带、镰状韧带、左右冠状韧带、左右三角韧带,使肝脏游离便于操作。
左、右半肝切除术:预先处理第一、二肝门部血管,阻断相应左、右半肝血供,再行半肝切除术,可以有效控制出血,减少气栓发生[1]。超声刀解剖第一肝门,分离肝动脉、门静脉和胆管左右支,Hem-o-lok夹闭患侧半肝入肝血管、胆管后离断,解剖第二肝门,仔细分离肝左、肝中、肝右静脉,钛夹夹闭后切断,如术中发现解剖第二肝门困难,可不必强行游离,LUS确定肝中静脉后使用超声刀、LigaSure切肝。右半肝切除还必须注意肝短血管处理。
左肝外叶、右肝后叶、单独或联合肝段切除术:游离对应肝叶,第一肝门预留自制腹腔镜下肝门阻断装置[3],切肝时通过LUS查找主供血管,距主供血管最近的肝表面用超声刀切开,夹闭切断主供血管后切除肝叶(段)。
2 结果
27例(84%)LUS与术前影像学检查结果一致,按原定计划完成手术。5例发现术前影像学检查遗漏病灶:1例为左肝内胆管结石患者遗漏胆总管小结石,1例Ⅴ段原发性肝癌患者遗漏肝脏Ⅵ段卫星灶(直径6 mm),1例原发性肝癌术中超声发现门静脉分支内癌栓,2例直肠癌肝转移患者术中超声发现肝内多发小转移灶(直径<6 mm)。5例均根据LUS结果改变手术方式:1例胆总管结石腹腔镜胆总管切开取石T管引流术(laparoscopic choledocholithotomy T tube drainage,LCTD),1例Ⅴ段肝癌合并Ⅵ段卫星灶行Ⅴ+Ⅵ段联合切除,1例原发性肝癌及2例直肠癌肝转移因无法手术根治而放弃剖腹探查。
全组行左肝外叶(Ⅱ+Ⅲ段)切除7例,左半肝(Ⅱ+Ⅲ+Ⅳ段)切除10例,右肝后叶(Ⅵ+Ⅶ段)切除5例,右半肝(Ⅴ+Ⅵ+Ⅶ+Ⅷ段)切除3例,Ⅴ+Ⅵ段联合切除2例,肝方叶ⅣB段、第Ⅵ段单独肝段切除各1例,3例腹腔镜探查发现肿瘤无法根治性切除,活检后终止手术。其中4例合并胆囊结石者行腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC),4例合并胆总管结石者行LCTD。术中使用LUS时间12~28 min,(14.2±9.4)min。21例单纯解剖性肝切除术手术时间112~355 min,(220.5±98.2) min;4例联合LC手术时间22~41 min,4例联合LCTD手术时间34~58 min。全组术中出血200~1100 ml,(425.5±184.2) ml。全组住院时间7~14 d,(8.2±2.2)d。29例完成肝切除术的术后病理诊断结果均明确,肝内胆管结石伴胆管扩张14例,肝血管瘤4例,肝局灶性增生2例,原发性肝癌5例(其中1例Ⅵ段含肝癌卫星灶),结直肠腺癌肝脏转移4例(术后病理分期均为Ⅳ期,2例T3N1M1,1例T3N2M1,1例T2N1M1)。5例可根治性切除肝癌患者标本切缘均阴性。术后胆漏4例,膈下感染1例,给予通畅引流10~14 d均痊愈。4例原发性肝癌病人术后中等量腹水。所有病人无术后出血、肝功能衰竭等其他并发症。4例LCTD放置T管者带管出院,60 d T管造影未发现残余结石。3例终止手术患者予姑息治疗。29例手术病人随访6~18个月,平均16.5月。1例原发性肝癌患者11个月后因肝癌复发、肝功能衰竭死亡;1例直肠癌肝转移患者术后16个月发现直肠癌全身广泛转移;其余7例恶性肿瘤病人定期复查未发现肿瘤复发、转移。14例肝内外胆管结石、4例肝血管瘤、2例肝局灶性增生均未再发。
3 讨论
自1991年妇科医师Reich等使用腹腔镜切除了肝脏边缘的良性肿瘤,完成世界首例腹腔镜肝切除术(laparoscopic hepatectomy,LH)以来,腹腔镜肝脏外科在短短20年内获得了迅猛发展。但由于腹腔镜本身的“触觉反馈丧失”及无法观察肝脏内部情况等缺陷[4],腹腔镜肝切除手术风险较开腹手术高,限制其进一步发展。随着腹腔镜超声设备的发展和应用,腔镜外科医师既能通过腔镜设备检查器官表面,又能通过超声观察病变器官内部情况,克服了腹腔镜手术的缺陷,减少了术中大出血和气栓发生率,使腹腔镜肝切除变得安全、可靠。肿瘤位于肝脏实质内无法触诊时,如何定位肿瘤边缘和确定手术切缘成为棘手的问题。以往根据CT、MRI等术前影像结果判定切缘,由于腔镜下的“触觉丧失”和二维手术视野的偏差可能引起的肿瘤“次全”切除,甚至遗漏病变。LUS不仅显示肝实质内肿瘤的大小、位置、范围、肿瘤深度,而且给出具体测量数据,指导完整切除肿瘤及荷瘤肝段内门静脉支。这样不仅保证了足够的切缘,而且联合肝段内门静脉切除更符合无瘤手术原则,降低了肿瘤在肝内沿着荷瘤肝段门静脉转移的风险。手术按照无瘤原则操作,避免或减少对瘤体接触和挤压,保证肿瘤的切除范围,减少术中及围手术期出血,这都有利于降低肿瘤的术后复发率[5,6]。对肿瘤晚期病人,术前B超、CT、MRI等检查不能判定肿瘤能否根治性切除,传统开腹探查切口巨大,给病人生理和心理带来巨大痛苦。LUS可发现肝内“毫米”级别的小病灶,彩色多普勒显像易于发现门静脉、胆管内癌栓,提高了病灶的检出率,避免遗漏病变,同时可对肿瘤进行准确的分期,避免了不必要的剖腹探查[7~9]。本组2例(6%)更改手术方式,3例(9%)避免无效的剖腹探查,均证实了LUS检查结果的重要性。
腹腔镜解剖性肝叶切除已经成为治疗肝胆管结石的重要手术方式之一,也是确保肝胆管结石治愈、减少结石残留复发的有效手段[10],而随着近年观念的发展,肝内胆管结石肝切除治疗已趋向肝段化和亚肝段化[11]。在我国,肝内胆管结石病人因肝实质的萎缩、纤维化及代偿性增生等原因使肝脏的形态发生变化,单从肝脏形态变化无法判断肝内结石的具体分布,依靠术前各种影像学检查进行肝脏分段、分叶不够精准,容易遗漏“变形”肝段内结石。LUS通过扫描对应的门、肝静脉,可准确划分肝段,利于行解剖性肝切除。本组14例肝内胆管结石病人中4例合并不同程度的肝叶萎缩、肝纤维化导致肝叶“变形”,均通过LUS扫描显示出肝叶、段间胆管,明确肝内结石位置、范围,保证病变肝脏切除干净,此14例术后随访12~18个月肝内结石无复发。
左、右半肝切除术要求以肝中静脉为分界进行切除,传统上我们将阻断半肝血流后出现的缺血线作为左右半肝的分界标记,或者以下腔静脉的左缘与胆囊底中点连线(Cantlie线)作为切除线,但存在以下情况:①实际操作中镜下观察肝缺血线困难,难以准确定位;②半肝阻断法只是阻断第一肝门内入肝血供,并未考虑到残存肝叶的静脉回流,而肝静脉的变异情况较多;③肝动脉和门静脉常存在交通支和侧支血管,阻断效果不理想等[12]。因此,缺血线或Cantlie线与肝中静脉的实际走行可能不一致,特别是受到腔镜下“二维视野”的影响,在切割入肝实质后可能会与实际切线发生偏差,损伤肝中静脉或肝静脉分支,造成大出血,增加手术风险。本组左半肝切除10例,右半肝切除3例,均使用LUS确定肝切线,CDFI探头扫描出肝中静脉,在肝脏膈面氩气刀喷凝出“标记线”,在此“标记线”的边缘1 cm处切割,边切割边超声扫描“导航”[13],保证完全避让肝中静脉,同时提供了肝切面内管道的影像,增加手术的可“预见性”和安全性。本组13例均无肝中静脉损伤。
Våpenstad等[14]报道:43%的外科医师会在腹腔镜手术中使用超声技术,67%的肝脏外科医生会在术中使用腹腔镜超声。腹腔镜超声大大增加了手术的精准性、安全性和彻底性,成为腹腔镜解剖性肝切除手术中不可缺少的一部分[15]。但腹腔镜超声的学习是一个曲线的过程,只有外科医生熟练掌握LUS设备的操作和准确判断超声图像才能做出正确的诊断,指导手术。经过系统的学习掌握LUS技术,对腹腔镜肝切除手术有重要指导意义,值得在临床中推广。
1 中华医学会外科学分会肝脏学组.腹腔镜肝切除术专家共识(2013版).中国肿瘤临床,2013,40(6):303-306.
2 鲍鸿斌,赵向前,张文智.结扎束血管闭合系统(LigaSure)在腹腔镜肝切除术中的应用价值.中国微创外科杂志,2011,11(3):227-228.
3 周新华,李 宏,俞丹松,等.腹腔镜规则性左半肝切除治疗左肝内胆管结石.中国微创外科杂志,2010,10(9):819-820.
4 陈训如.腹腔镜超声——安全实施腹腔镜手术的重要辅助工具.中国微创外科杂志,2007,7(2): 89-90.
5 Ribero D,Curley SA,Imamura H,et al.Selection for resection of hepatocellular carcinoma and surgical strategy:indications for resection,evaluation of 1iver function,portal vein embolization,and resection.Ann Surg Oncol,2008,15(4):986-992.
6 吴孟超.关于降低肝癌术后复发率之我见.中国实用外科杂志,2012,32(10):793-795.
7 Soliman HO,Gad ZS,Mahmoud AM,et al.Laparoscopy with laparoscopic ultrasound for pretreatment staging of hepatic focal lesions: a prospective study.J Egypt Natl Canc Inst,2011,23(4):141-145.
8 Lai EC,Tang CN,Ha JP,et al.The evolving influence of laparoscopy and laparoscopic ultrasonography on patients with hepatocellular carcinoma.Am J Surg,2008,196(5):736-740.
9 Rethy A,Langø T,Mårvik R.Laparoscopic ultrasound for hepatocellular carcinoma and colorectal liver metastasis: an overview.Surg Laparosc Endosc Percutan Tech,2013,23(2):135-144.
10 李建军,卢榜裕,蔡小勇,等.腹腔镜肝切除术在肝内胆管结石治疗中的应用.中国普外基础与临床杂志,2013,20(4):362-366.
11 黄志强.肝内胆管结石治疗演变和发展.中国实用外科杂志,2009,29(7):537-539.
12 耿小平.遵循肝中静脉解剖学特点的精准半肝切除术.中国实用外科杂志,2010,30(8):717-718.
13 Langø T,Vijayan S,Rethy A,et al.Navigated laparoscopic ultrasound in abdominal soft tissue surgery: technological overview and perspectives.Int J Comput Assist Radiol Surg,2012,7(4):585-599.
14 Våpenstad C,Rethy A,Langø T,et al.Laparoscopic ultrasound:a survey of its current and future use,requirements,and integration with navigation technology.Surg Endosc,2010,24(12):2944-2953.
15 陈焕伟,刘允怡,甄作均,等.超声引导下以肝段为本的解剖性肝切除术.中华肝胆外科杂志,2006,22(6):378-380.
(修回日期:2014-03-26)
(责任编辑:王惠群)
ApplicationofLaparoscopicUltrasonographyinLaparoscopicAnatomicalHepatectomy
WangLei,LiHong*.
*DepartmentofMinimallyInvasiveSurgery,LihuiliHospital,NingboMedicalCentre,Ningbo315040,China
ObjectiveTo evaluate the role of laparoscopic ultrasonography (LUS) in laparoscopic anatomical hepatectomy.MethodsThe data of 32 patients undergoing laparoscopic anatomical hepatectomy in Minimally Invasive Surgery Department of Lihuili Hospital between September 2008 and September 2011 were retrospectively analyzed. Of all the patients, there were 14 cases of calculus in intrahepatic duct, 6 cases of hepatocellular carcinoma, 4 cases of liver hemangioma, 2 cases of liver focal hyperplasia, and 6 cases of liver metastases from colorectal cancer. LUS was used during all the operations in order to investigate the anatomy of the operations, determine the tumor stage and guide the incision margin of tumor. It was conventionally used to detect the relationship between the lesions and peripheral intrahepatic vessels and ducts.ResultsIn the 32 cases, 27 cases (84%) completed the operations on schedule, two cases (6%) altered the planned surgical procedures owing to the findings of LUS, including one case of left hepatolithiasis found a small stone in the common bile duct, and one case of hepatocellular carcinoma located in the V segment found a satellite lesion in Ⅵ segment (6 mm in diameter). The other three cases (9%) terminated the operation because LUS indicated the tumors were unresectable.ConclusionsLUS can improve the accuracy, safety and thoroughness of the surgery. It gives accurate guidance to the surgeons by detecting missed or wrong diagnosis and avoids unnecessary exploratory laparotomy.
Laparoscopy; Laparoscopic ultrasonography; Anatomical hepatectomy
宁波市医学科技计划项目(A类)(2009A03)
R657.3
:A
:1009-6604(2014)05-0385-04
10.3969/j.issn.1009-6604.2014.05.001
2014-01-21)
**通讯作者,E-mail:lancet2010@aliyun.com
①(宁波大学医学院研究生院,宁波 315211)

