辐射致组织损伤凋亡机制的研究概况
杨 宏,倪 敏,赵心彬,陶 霞 (第二军医大学附属长征医院药学部,上海 200003)
1 背景
辐射是指具有能量的粒子或波通过媒介在空间传导的过程,按照辐射与常见化学物质的相互作用,辐射通常分为电离辐射与非电离辐射。人们常说的辐射是指电离辐射,它能将电子从外壳剥离,使原子整体带正电[1]。整体而言,能量大于10 eV(electric volta,电子伏特)的光子与粒子具有上述电离能力(如α射线、β射线、宇宙射线、γ射线与X射线)。电离辐射对生物体的损伤主要体现在对细胞的损伤上,胞内DNA尤其易受损伤,这也是辐射致癌的原因。研究辐射时最常用的单位为:吸收剂量(absorbed dose),其物理意义是单位质量物质接收电离辐射的平均能量(国际基本单位:戈瑞,Gy)。
电离辐射可诱导细胞凋亡。凋亡(apoptosis)也称为固缩坏死或程序性细胞死亡(programmed cell death),是由基因介导的一系列生化反应,细胞依靠它来主动引起自身的破坏。凋亡的细胞通常会核固缩、质膜发泡、细胞器紧缩,形成凋亡小体,进而被邻近实质性细胞或吞噬细胞吞噬[2]。辐射诱导的凋亡大致可分为3个阶段:① 引发性刺激:对于辐射诱导的凋亡而言,最初刺激元件是通过作用于细胞表面受体,进而作用于DNA分子或其他非核靶点。② 滞后阶段的调节:在辐射和细胞凋亡之间存在一个滞后阶段。③死亡反应:细胞开始发生一系列特征性生物形态学的改变以及生物化学变化。
2 辐射致凋亡的机制
辐射致组织损伤的凋亡机制常被认为与DNA损伤与神经酰胺有关(图1)。辐射因其电离能力可使生物体产生自由基,从而造成DNA损伤。DNA损伤可激活p53致凋亡通路,也可激活聚ADP核糖基聚合酶(PARP)抑制凋亡;同时也能激活神经酰胺合酶(ceramide synthase),产生神经酰胺。辐射还能作用于膜上,产生膜变构(membrane alteration),进而激活酸性鞘磷脂酶(acid sphingomyelinase),分解鞘磷脂产生神经酰胺(鞘磷脂通路,sphingomyeline pathway)。神经酰胺作为第二信使激活p38等促凋亡通路。
2.1DNA损伤
2.1.1自由基 电离辐射照射生物体,可诱发DNA链断裂,染色体异常、变异和细胞凋亡。已有足够证据表明:细胞核及其核内DNA,是辐射致损伤的主要靶点。普遍认为DNA双链断裂(DSBs)是电离辐射所造成的最严重DNA损伤类型[3]。Slade等[4]的研究表明,名为Deinococcusradiodurans的菌能耐受高剂量的辐射,同时可耐受高浓度的活性氧(reactive oxygen species, ROS)。在该菌的基因组受到高达2 000 UDSB的情况下,仍不造成致命的蛋白损伤,从而间接证明了活性氧自由基与辐射损伤的关系。其他研究[5-8]通过皮肤纤维化的产生、细胞外基质分子(如胶原蛋白)证明了ROS在辐射损伤方面的重要性。
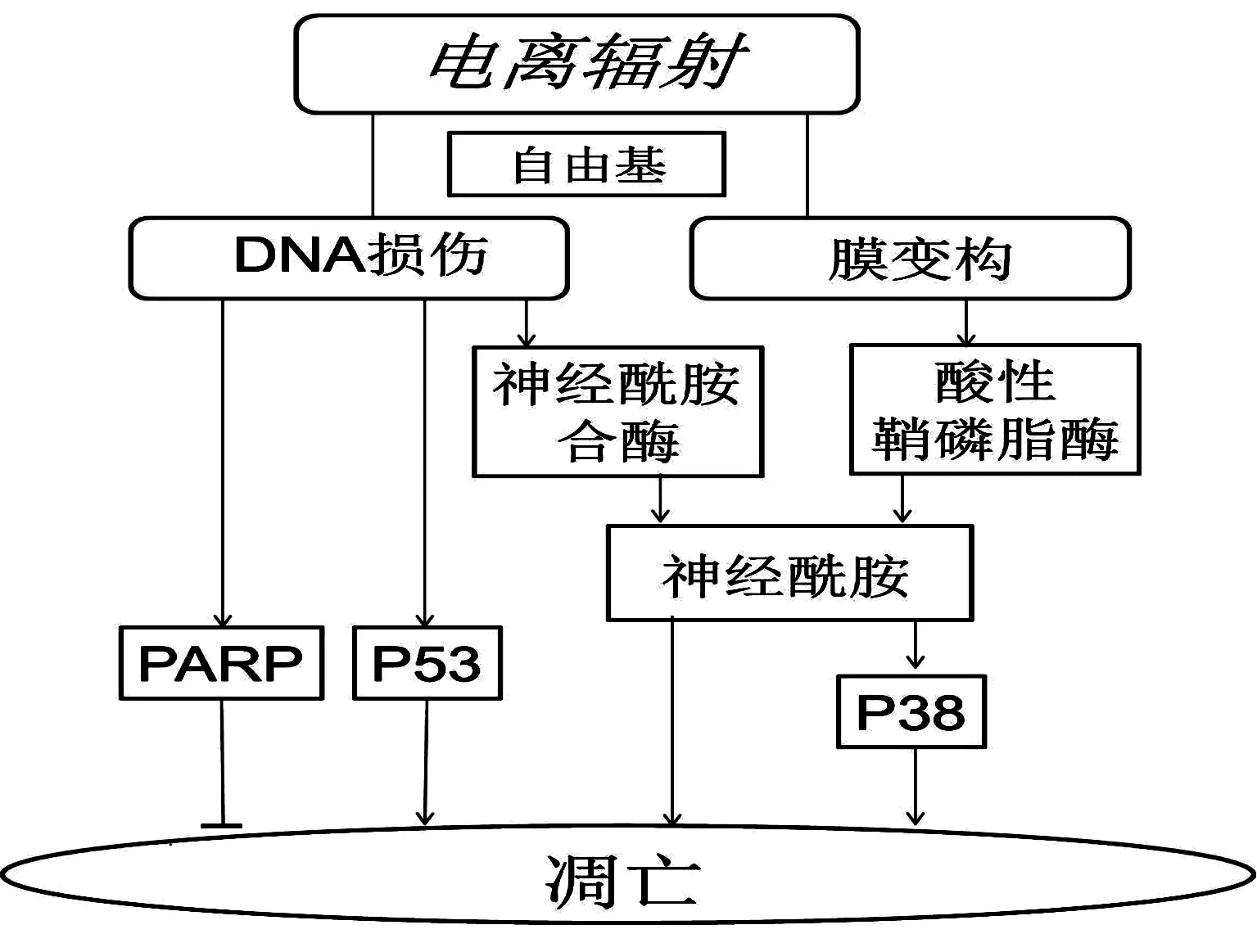
图1 辐射致组织损伤的凋亡机制示意图
2.1.2PARP 聚ADP核糖聚合酶 [poly (ADP-ribose) polymerase, PARP]是一类主要与DNA修复与凋亡相关细胞应激反应有关的蛋白。PARP包含4个重要的结构域:DNA结合域,半胱氨酸蛋白酶(caspase)切割域,自修饰域和催化域。PARP被激活的机制为:发生DNA的单链断裂时,断裂的DNA链与PARP上的DNA结合域结合,引发PARP上各结构域发生构象变化,开始合成聚ADP核糖链,PAR链可作为其他DNA修复酶的信使,修复完成时PAR链降解。DNA结合域包含2个锌指结构模块(zinc finger motifs)。其在辐射方面的应用主要在于,PARP抑制剂作为化疗联用药以增加癌细胞选择性,并改善预后。Mueller等[9]在辐照治疗的同时给予PARP抑制剂MK-4827,有效地抑制了成神经细胞瘤的生长。其他最新研究[10,11]也阐述了PARP抑制剂在辐射方面的重要作用。
2.1.3P53蛋白 被称为protein 53或者肿瘤蛋白(tumor protein) 53,是由p53基因编码的抑癌蛋白。P53蛋白对多种器官都可调控细胞周期,从而起到抑癌作用。p53基因因其阻止基因突变,保存稳定性,被称为“基因的守护者”。向已失去内源性p53功能的细胞中注入野生型P53蛋白,能诱导细胞发生凋亡[12]。p53通路是辐射致凋亡通路中最为人们所接受的机制[13]。Burger等[14]考察了生殖细胞肿瘤细胞(testicular germ cell tumors,TGCTs)的辐射凋亡过程中p53的表达,证明了p53在辐射凋亡中起到的重要作用。Wakatsuki等[15]利用p53的肿瘤抑制基因家族的P73蛋白与P53蛋白的类似性,发现了它可以替代P53蛋白缺失后的功能恢复,从侧面证明了P53蛋白在辐射致凋亡过程中的重要性。
2.2神经酰胺
2.2.1 神经酰胺 神经酰胺是普遍存在的、进化保留的信号转导系统第二信使,主要以下列3种方式参与辐射致凋亡的调控:①辐射直接作用于数种细胞的质膜,激活酸性鞘磷脂酶,通过酶水解鞘磷脂产生神经酰胺。神经酰胺作为第二信使通过线粒体系统启动凋亡反应。②辐射诱导的DNA损伤通过激活线粒体神经酰胺合酶启动神经酰胺合成或再生。③一些细胞、组织中,神经酰胺可激活下游凋亡蛋白BAX,通过线粒体细胞色素,调节凋亡过程。Deng等[16]利用线虫菌株证明了神经酰胺在辐射致凋亡机制中的重要作用。Adria等[17]利用牛主动脉内皮细胞(bovine aortic endothelial cells)证明了鞘磷脂代谢途径通过TNF-α对凋亡的重要作用。Rotolo等[18]的研究表明神经酰胺的抗体能够减轻小鼠辐射所致的胃肠道损伤。Kolesnick等[19]的研究也证明神经酰胺在辐射致凋亡机制中起到重要作用。
2.2.2P38蛋白 P38蛋白是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK),因其与细胞应激因子有关,故被称为应激MAPK。Niaudet 等[20]利用微血管内皮细胞HMEC1证明了P38蛋白在膜变构的神经酰胺凋亡通路中起重要作用。P38蛋白起作用的方式与其他分子靶点不同,并非独立影响最终的细胞行为,需要借助神经酰胺代谢通路[21]。Blirando K等[22]在肥大细胞上检测到了辐射诱导的P38蛋白相关激酶的表达,进一步证明了P38蛋白在辐射致损伤凋亡机制中的重要作用。
3 总结
综上所述,辐射可产生自由基,造成DNA损伤,从而激活p53基因致凋亡通路,也可激活PARP抑制凋亡;同时辐射也能激活神经酰胺合酶,产生神经酰胺。另外辐射也能够作用于膜上,产生膜变构,进而激活酸性鞘磷脂酶,分解鞘磷脂产生神经酰胺(鞘磷脂通路)。神经酰胺作为第二信使激活p38基因等促凋亡通路。对辐射致组织损伤凋亡机制的探讨不仅有助于加深对辐射的了解,还对抗辐射方面药物的研发产生深远的意义。
【参考文献】
[1] 周平坤,霍艳英,吴德昌. 辐射致癌效应与机制[J].辐射防护通讯,2007,27(1):7.
[2] 童 新,孙志贤. 辐射所致程序性细胞死亡的机制[J].国外医学·分子生物学分册,1995,l7(3): 131.
[3] Tomita M. Involvement of DNA-PK and ATM in radiation-and heat-induced DNA damage recognition and apoptotic cell death[J].J Radiat Res, 2010,51: 493.
[4] Slade D, Radman M. Oxidative stress resistance in Deinococcus radiodurans[J].Microbiol Mol Biol Rev,2011,75(1):133.
[5] Nguyen TD, Maquart FX, Monboisse JC. Ionizing radiations and collagen metabolism: from oxygen free radicals to radio-induced late fibrosis[J].Radiat Phys Chem,2005, 72: 381.
[6] Orlowski R Z, Baldwin AS. NF-kappaB as a therapeutic target in cancer[J].Trends Mol Med,2002:385.
[7] Reuter S, Gupta SC, Chaturvedi MM. Oxidative stress, inflammation, and cancer: how are they linked[J].Free Radical Biol Med, 2010, 49: 1603.
[8] Moeller BJ, Cao YT, Li CY. Radiation activates HIF-1 to regulate vascular radiosensitivity in tumors: role of reoxygenation, free radicals, and stress granules[J].Cancer Cell, 2004, 5: 429.
[9] Mueller S, Bhargava S, Molinaro AM. Poly (ADP-Ribose) polymerase inhibitor MK-4827 together with radiation as a novel therapy for metastatic neuroblastoma[J].Anticancer Res, 2013, 33(3): 755.
[10] Liu XS. PARP inhibition as a prototype for synthetic lethal screens[J].Mol Biol, 2013, 986: 123..
[11] Shunkwiler L, Ferris G, Kunos C. Inhibition of poly(ADP-Ribose) polymerase enhances radiochemosensitivity in cancers proficient in DNA double-strand break repair[J].Int J Mol Sci, 2013, 14(2): 3773.
[12] Lowe SW. Renewing the debate over the p53 apoptotic response[J].Nature,1993:352.
[13] Han JQ, Xu XJ, Qin HZ. The molecular mechanism and potential role of heat shock-induced P53 protein accumulation[J].Mol Cellul Biochem, 2013, 3: 1.
[14] Burger H, Nooter K, Boersma AW. Expression of p53, p21/waf/cip, bcl-2, bax, bcl-x, and bak in radiation-induced apoptosis in testicular germ cell tumor lines[J].Int J Radiat Oncol,1998, 41(2): 415.
[15] Wakatsuki M, Ohno T, Iwakawa M. P73 protein expression correlates with radiation-induced apoptosis in the lack of p53 response to radiation therapy for cervical cancer[J].Int J Radiat Oncol,2008, 70(4):1189.
[16] Deng XZ, Yin XL, Allan R. Ceramide biogenesis is required for radiation-induced apoptosis in the germ line ofC.elegans[J].Science,2008, 322(5898): 110.
[17] Adriana HF, Chu CK, Ehleiter D. Ionizing radiation acts on cellular membranes to generate ceramide and initiate apoptosis[J].J Exp Med,1994, 180: 525.
[18] Rotolo J, Stancevic B, Zhang JJ, Anti-ceramide antibody prevents the radiation gastrointestinal syndrome in mice[J].J Clin Invest,2012, Brief report: 1.
[19] Kolesnick R, Fuks Z. Radiation and ceramide-induced apoptosis[J].Oncogene,2003, 22: 5897.
[20] Niaudet C, Bonnaud S, Gouard S. Radiation induces p38-mediated endothelial cell death through ceramide generation and menbrane remodeling[J].Radioprotection, 2008, 43: 140.
[21] Chakravarti A, Noll E, Black PM. The anti-epidermal growth factor receptor monoclonal antibody, c225, enhances radiation-induced apoptosis in primary glioma cell lines through mediation of MAPK/JNK/p38 signaling pathways[J].Int J Radiat Oncol,2001, 51(3): 102.
[22] Blirando K, Hneino M, Martelly I. Mast cells and ionizing radiation induce a synergistic expression of inflammatory genes in endothelial cells by a mechanism involving p38α MAP kinase and (p65) NF-κB activation[J].Radiat Res,2012, 178(6): 556.

