通过调节高迁移率族蛋白B1治疗相关疾病的药物研究进展
贺 欣,贺 丹,储小飞,王海潮,樊赛军*
(1.中国医学科学院和北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室,天津 300192;2.北京大学医学部心血管研究所,教育部分子心血管学重点实验室, 北京100191;3.美国北岸大学医院急诊医学部,纽约11030)
高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种存在于真核生物细胞内的非组蛋白染色体结合蛋白,是一种危险相关分子模式分子,在细胞的生存和死亡过程中发挥了重要的调节作用,并参与了包括免疫系统疾病、肿瘤、糖尿病、阿尔茨海默病以及辐射损伤修复等多种病理状态的发生和进展[1]。鉴于HMGB1的作用广泛性和基础性,研究调节和干扰HMGB1的特异性抑制剂将是基础和临床研究都非常感兴趣的研究领域。
1 HMGB1的生理和病理功能
人类HMGB1由215个氨基酸组成,相对分子质量为25 ku,含有3个不同的结构域:两个结构相似但是功能不同的串联同源结构域Box A和Box B,以及一个酸性C末端。
1999年,Wang等[2]首次发现HMGB1是炎症进展过程中一种重要的细胞外介质。随后大量研究揭示,HMGB1可通过简单扩散、被动释放和主动分泌的形式释放到胞外基质,并且可与多种受体高亲和力结合,如DNA、核小体、IL-1β、脂多糖(lypopolysaccharide)和磷脂壁酸等,从而介导多种生理功能或病理的进展(图1),参与了多种慢性炎症和自身免疫性疾病的发病机制,在多数炎症性疾病,如脓毒症、类风湿性关节炎、动脉粥样硬化、慢性肾病、系统性红斑狼疮(systemic lupus erythematosus,SLE),以及肿瘤的发展、侵袭和转移中都可以检测到血清HMGB1高水平表达。此外,HMGB1也参与了一些以细胞死亡和损伤为主要特征的疾病,如糖尿病和阿尔茨海默病。
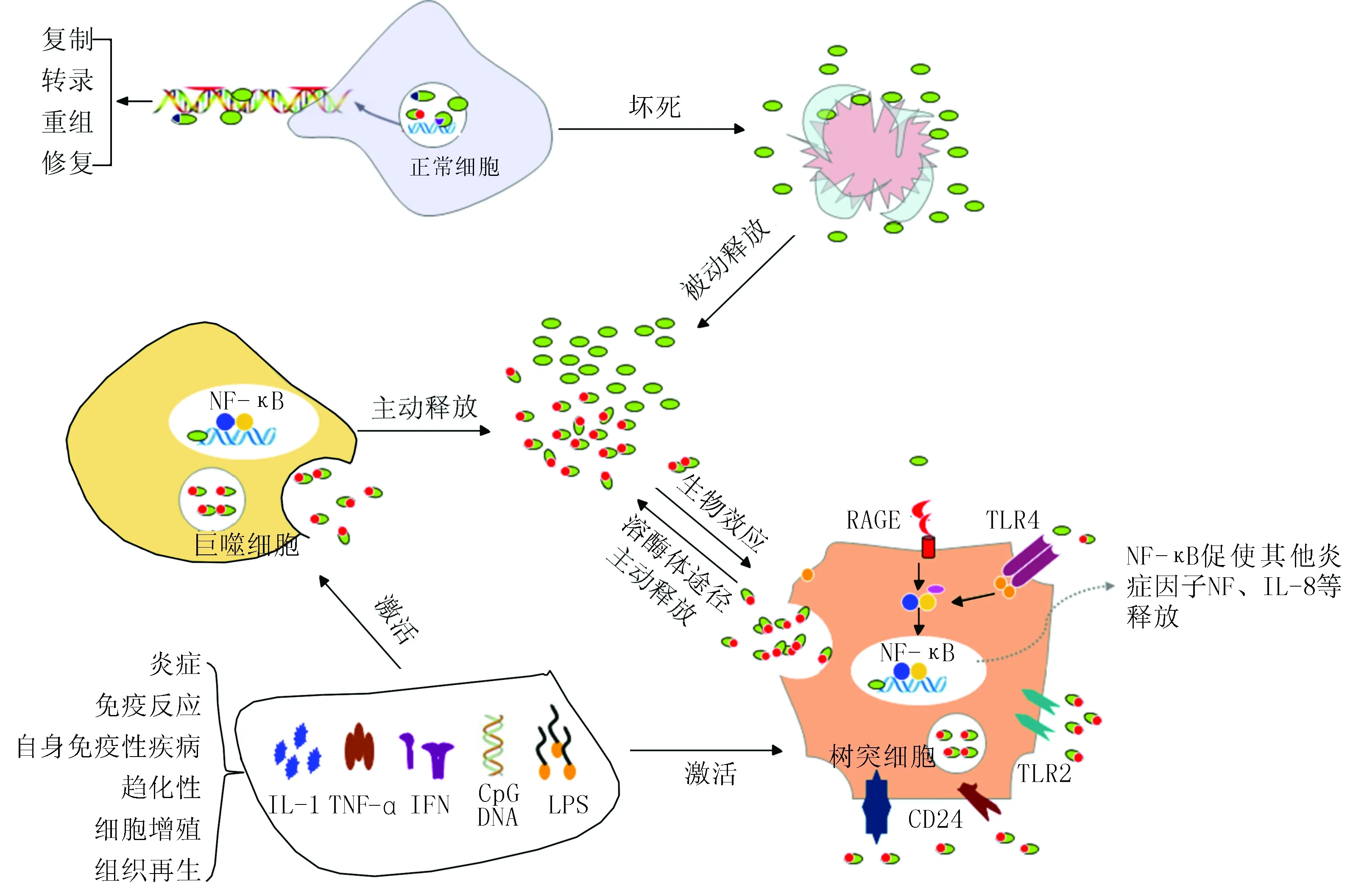
图1 HMGB1是一种多功能调节因子

2 调节HMGB1的药物及对相关疾病的疗效
2.1 可与糖化终末产物受体相互作用的HMGB1拮抗剂 糖化终末产物受体(receptor for advanced glycation end products,RAGE)是一个模式识别受体(pattern recognition receptor, PRR),类似于天然免疫受体,如Toll样受体(Toll-like receptors,TLRs)。HMGB1活化的RAGE参与了包括脓毒症、糖尿病、阿尔茨海默病和肿瘤在内的多种病理进展。抑制HMGB1-RAGE相互作用是一个调节炎症、控制肿瘤进展和转移的可行方案。有研究表明,抑制HMGB1-RAGE通路能有效地抑制肺癌的生长和转移。抑制HMGB1-RAGE信号传导的有效方法之一是利用HMGB1的拮抗剂发挥作用。重组Box A是HMGB1的特异性拮抗剂,可以有效地与RAGE相互作用,竞争性抑制HMGB1与RAGE的相互作用(图2)。同时,Box A由于缺乏位于Box B的促炎细胞因子活性,可不激活RAGE受体而发挥抗炎作用。体内和体外实验证实,将Box A通过(Gly4Ser)3序列与酸性的羧基端融合,能增强其抗炎活性。
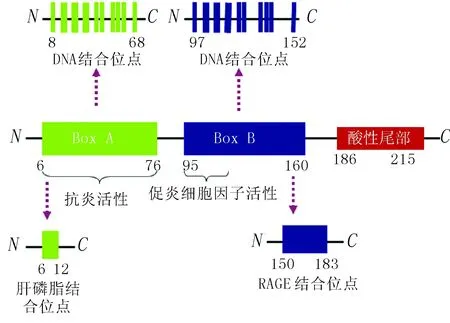
图2 HMGB1的结构及相关功能区域示意图
此外,有3种S100P来源的短肽通过抑制NF-κB的活性,也可阻断RAGE介导的信号传导。其中最有效的短肽在微摩尔浓度下即可抑制S100P、S100A4和HMGB-1与RAGE的相互作用,进而在体内及体外水平上降低癌细胞内NF-κB的活化。在体内实验中,这种短肽有抑制神经胶质瘤生长、抑制胰腺肿瘤细胞生长及转移的作用[3]。
2.2 HMGB1的小分子抑制剂
2.2.1 天然来源的HMGB1的小分子抑制剂 一种来源于光果甘草根茎部的三萜烯——甘草皂苷具有抗炎症和抗病毒的特性。甘草皂苷可以直接与两个HMG Box结构域结合[解离常数(Kd)≈150 μmol/L],抑制它的化学诱导物和促有丝分裂的活性。对甘草皂苷在一系列HMGB1相关疾病中发挥活性的机制研究表明,甘草皂苷可通过抑制细胞外的HMGB1细胞因子活性,从而降低动物脊髓、肝脏、大脑和心肌的缺血-再灌注损伤[4,5]。甘草皂苷也有助于脑内出血的治疗[6],减轻皮层损伤。在急性脑缺血损伤中,HMGB1对脑缺血损伤进展发挥了关键作用。甘草皂苷可通过抑制HMGB1的分泌发挥抗炎和神经保护作用。进一步研究表明,甘草皂苷可以在脑缺血后及脂多糖处理的巨噬细胞中浓度依赖性地抑制HMGB1磷酸化(促HMGB1分泌信号之一)来阻断HMGB1的分泌[7]。甘草皂苷可通过降低炎症细胞因子水平、抑制HMGB1的释放来发挥对大鼠脊髓缺血性损伤的保护作用,可通过直接抑制细胞外HMGB1细胞因子活性、阻断磷酸化JNK/Bax信号通路,减轻大鼠缺血-再灌注导致的心肌细胞损伤[8]。
在抗癌治疗中,甘草皂苷与其他药物合用可显著提高治疗效果。由于HMGB1可刺激癌细胞生长、促进内皮细胞增殖、促进血管新生及细胞运动、诱导炎症反应,因此HMGB1的释放不利于肿瘤的治疗,且能促进肿瘤细胞再生长。甘草皂苷可以阻断HMGB1诱导的细胞增殖和迁移过程,抑制HMGB1诱导的血管新生,降低炎症水平(降低TNF-α水平),抑制小鼠肿瘤再生长。因此,将甘草皂苷与促进肿瘤细胞坏死的药物或其他HMGB1抑制剂联合给药,有望产生更理想的治疗效果。
甘草皂苷对败血症也有一定的改善作用。它可维持体循环血流动力学的稳定性,保护重要器官不受脂多糖诱导的内毒素血症所侵害。这一作用主要是通过降低血清中HMGB1及其他促炎细胞因子水平及其基因表达,进而调控系统性炎症反应[9]。
此外,5%甘草皂苷及其共聚物(乙二醇或丙二醇)制备的溶液型滴眼剂在健康志愿者的临床试验中耐受性良好,未发现有毒性作用。在中度到重度睑炎感染的病人中,应用此悬浮滴剂后抗炎效果明显[10]。近期发现,一些新型的具有甘草皂苷C-30残基的衍生物具有HMGB1抑制剂特性,在提高慢性和急性心力衰竭小鼠生存率方面具有与甘草皂苷复合物类似的效应[11]。作为另一种人工合成的甘草皂苷衍生物,甘珀酸(carbenoxolone)可以剂量依赖性地阻断内毒素诱导的巨噬细胞HMGB1释放,这一过程可能是通过抑制蛋白激酶R(protein kinase R,PKR)的激活而实现的,同时也支持了PKR参与HMGB1释放的假说[12]。
黄芪甲苷(astragaloside Ⅳ,AST Ⅳ)作为中药黄芪的主要有效成分,已证实具有抗炎和增强免疫力等作用。体外实验表明,不同剂量AST Ⅳ对HMGB1介导的小鼠调节性T细胞免疫功能具有剂量依赖性的拮抗作用,对HMGB1介导的促炎效应有显著抑制作用[13]。
一些类固醇类似物,如丹参酮(tanshinone)Ⅰ、丹参酮ⅡA和隐丹参酮等是从中药丹参中提取出来的色素成分,也可剂量依赖性地降低巨噬/单核细胞中内毒素诱导的HMGB1的释放。其中,丹参酮ⅡA的水溶性磺酸钠衍生物可以通过选择性地阻断内毒素诱导的HMGB1胞质易位和释放,对致死性内毒素血症和败血症小鼠产生保护作用。该衍生物可刺激外源的HMGB1蛋白通过巨噬细胞胞质囊泡转移进入细胞内,继而通过将其转移至LC3阳性液泡中进行降解,这一过程有溶酶体的参与[14]。
一些天然复合物,如儿茶素-3-五倍子酸盐、槲皮黄酮和番茄红素也可以降低内毒素血症引起的致死性系统性炎症。从植物山茶花叶子中提取的儿茶素-3-五倍子酸盐是绿茶的主要成分,对患致死性内毒素血症和败血症小鼠有保护作用。该保护作用主要通过以下机制实现:(1) 降低巨噬/单核细胞中HMGB1的累积和释放;(2) 对HMGB1介导的炎症反应关键环节之一的外源性HMGB1在巨噬细胞表面聚集,产生阻止作用。槲皮黄酮是在水果、蔬菜、叶子和谷物中广泛存在的一种植物类黄酮,可降低患内毒素血症动物体内的HMGB1水平。在巨噬细胞中,槲皮黄酮可以抑制HMGB1的释放和细胞因子活性,抑制促分裂原活化蛋白激酶的活性[15]。番茄红素(lycopene)是在番茄和红果中发现的一种类胡萝卜素,具有抗氧化、抗癌和抗炎特性,可抑制内皮细胞中LPS介导的HMGB1的释放,HMGB1介导的TNF促分泌的磷脂酶A2的表达,以及HMGB1介导的促炎信号传导过程。这些效应是通过下调细胞黏附分子(cell adhesion molecules,CAMs)和HMGB1受体,TLR-2、TLR-4和RAGE等在细胞表面的表达来实现的[16]。小檗碱通过抑制HMGB1基因表达抑制巨噬细胞释放HMGB1[17]。中药复方的研究发现,清热化瘀中药复方——清肝方能降低急性肝衰竭大鼠肝组织中HMGB1的表达,对急性肝衰竭大鼠起到保护作用[18]。
2.2.2 人工合成的HMGB1的小分子抑制剂 几种合成分子,如甲磺酸萘莫司他、甲磺酸加贝酯(gabexate mesilate)和西维来司钠可通过抑制HMGB1来部分降低脂多糖诱导的肺部损伤。甲磺酸萘莫司他、甲磺酸加贝酯是两种合成的蛋白酶抑制剂,可通过阻断脂多糖诱导后细胞因子的释放来抑制HMGB1的表达[19]。西维来司钠是中性白细胞弹性蛋白酶高度特异性的合成抑制剂,在急性肺损伤中可抑制NF-κB的活化。
两种他汀类药物分子阿托伐他汀和辛伐他汀,可以下调HMGB1-RAGE水平。在大鼠大脑中动脉闭塞之后,阿托伐他汀可通过抑制HMGB1、RAGE、TLR-4和NF-κB的过表达而保护大鼠免受缺血性损伤[20]。在ApoE-/-基因敲除小鼠中,辛伐他汀可显著降低血管炎症及动脉粥样硬化病变面积,降低主动脉中HMGB1、RAGE、血管内皮细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的表达。瑞舒伐他汀能降低高血脂病人血清HMGB1水平[21]。
有研究结果表明,丙酮酸乙酯在慢性结肠炎中可作为HMGB1的有效抑制剂发挥良好的治疗效果。此外在胃癌治疗中其也可发挥抗肿瘤的作用。在患有慢性结肠炎的IL-10基因敲除小鼠中,小肠的HMGB1的表达量升高,丙酮酸乙酯可抑制结肠炎症和肠道细胞因子的产生,进而降低HMGB1的水平。丙酮酸乙酯可抑制重症急性胰腺炎大鼠HMGB1的表达。此外,丙酮酸乙酯还可抑制HMGB1从细胞核到细胞质的易位过程。丙酮酸乙酯亦可通过下调HMGB1基因并抑制蛋白质表达,对大鼠局灶性脑缺血-再灌注损伤发挥保护作用[22]。其他研究表明,丙酮酸乙酯可通过下调HMGB1-RAGE表达水平抑制胆囊肿瘤细胞的生长和侵袭。丙酮酸乙酯可降低HMGB1、RAGE、增生细胞核抗原(proliferating cell nuclear antigen,PCNA)和基质金属蛋白酶-9的表达,抑制胆囊癌细胞增殖和迁移,诱导体内胆囊癌细胞的凋亡和S期细胞周期停滞[23]。此外,丙酮酸乙酯对胃癌细胞生长也有抑制作用,主要通过调节HMGB1-RAGE和Akt信号通路实现。以上研究结果表明,丙酮酸乙酯和其他治疗药物联合治疗癌症有良好的应用前景[24]。
顺铂是临床抗肿瘤的重要化学治疗药物,最新研究发现,无论在体外还是体内实验,顺铂可增加细胞核HMGB1水平,降低细胞质HMGB1水平,抑制HMGB1从细胞核到细胞质的转运和向细胞外环境释放。顺铂可有效防止急性肝衰竭,其作用机制目前了解不多,有推测认为顺铂与DNA和HMGB1形成螯合物,阻止HMGB1的移位和释放[25]。
一氧化碳(CO)是重要气体信使,参与了脓毒症相关的炎症反应、脂质过氧化损伤、缺血-再灌注损伤、脓毒症性休克等生理病理过程,介导抗炎、抗氧化和抗凋亡的作用。外源性一氧化碳释放分子(extrinsic carbon monoxide releasing molecule 2, CORM-2)能够下调脓毒症大鼠肺组织中HMGB1的表达,减轻脓毒症肺损伤[26]。
此外,有研究表明,HMGB1与甲氨蝶呤有直接的相互作用。甲氨蝶呤是临床上用于肿瘤化疗和治疗包括类风湿性关节炎在内的一些自身免疫性疾病的具有抗炎特性的药物。甲氨蝶呤在HMGB1上有两个独立的结合位点,即Al区(G1-K87)和Bj区(F88-K181)。甲氨蝶呤在Al区和Bj区的解离常数分别是0.50 μmol/L和0.24 μmol/L。甲氨蝶呤在Bj区的结合域包含了RAGE在HMGB1上的结合域(K149-V175),从而可在分子和细胞水平上抑制HMGB1-RAGE 的相互作用,这一结构特征对甲氨蝶呤发挥抗炎特性尤为重要[27]。
2.3 HMGB1抗体 抗HMGB1的抗体主要用于确认HMGB1是否参与到了某些疾病的病理过程中,也用于衡量HMGB1抑制剂的功效。抗HMGB-1(或抗Box A蛋白)的多克隆抗体经过全身用药可以显著抑制胶原诱导的关节炎的炎症和组织破坏,这提示HMGB1抑制剂或可成为治疗关节炎的有效药物。此外,有研究发现,抗HMGB1的单克隆抗体(2G7, 鼠源IgG2b)可在DBA/1小鼠Ⅱ型胶原诱导型关节炎,以及由特定基因缺陷产生的慢性、自发性、多发性关节炎这两种不同类型的关节炎中发挥良好的缓解病情效果。通过组织学检查发现,抗HMGB1的单克隆抗体治疗方法可在一定程度上预防关节破坏。抗HMGB1的单克隆抗体对于这两种关节炎的良好治疗效果也进一步印证了HMGB1可能成为相关疾病临床治疗中一个有效的分子靶点[28]。
完全人源化的单克隆抗体(IA-4,可同时识别鼠源和人源的HMGB1)可抑制重组HMGB1诱导的IL-6在外周单个核细胞中的分泌,表明HMGB1是狼疮性肾炎中一个关键的效应分子,抗HMGB1的治疗方法对于SLE的治疗同样有良好的应用前景[29]。
2.4 HMGB1的多肽和蛋白质抑制剂 一些内源性神经多肽具有抑制HMGB1的活性,能够提高内毒素血症动物生存率,特别是血管活性肠肽(vasoactive intestinal peptide, VIP)和尿皮素(urocortin)两个广为人知的抗炎多肽,体内外实验均证实,它们可广泛调节炎症因子,下调HMGB1从细胞核向细胞质易位,阻止其向胞外释放。VIP和尿皮素分别可以提高致死性脓毒症动物生存率,但重组HMGB1可完全逆转该作用。此外,垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase-activating polypeptide, PACAP)是一种内源性神经肽,它能显著减少血液HMGB1水平并提高致死性内毒素血症动物的生存率。体外实验证实,PACAP可抑制脂多糖诱导的巨噬细胞/单核细胞的HMGB1释放,以及TNF-α和IFN-γ诱导的HMGB1释放。此外,体内外实验证实,PACAP可抑制HMGB1诱导的细胞因子的释放。
由于凝血级联反应在炎症过程中发挥关键作用,许多研究小组研究了重组血栓调节蛋白对内毒素血症的治疗效果。可溶性重组人血栓调节蛋白(recombinant human thrombomodulin,rTM)在脂多糖诱导的内毒素血症大鼠模型中表现出抑制炎性因子表达,降低血浆HMGB1水平,即使延迟给药,也能显著减少肝功能障碍,降低死亡率[30]。另一项研究报道了rTM在啮齿动物脓毒症模型中的体内和体外效果[31]。在脂多糖诱导的大鼠全身炎症反应模型,rTM抑制肺组织的促炎因子和HMGB1的释放,明显减轻肺损伤,如间隙充血、水肿、炎症和出血。此外,体外实验显示,rTM可通过抑制I-κB磷酸化而抑制NF-κB活化。因此,抗凝血药物rTM可作为全身性、炎症性疾病的有效治疗药物。
蝎素组分Ⅲ是从河南马氏钳蝎素中分离纯化出来的一种活性成分[32],它可以刺激或抑制THP1细胞HMGB1的表达,其作用效果与剂量密切相关。
2.5 HMGB1的寡核苷酸抑制剂 由于细胞核内的HMGB1可结合并导致DNA双链弯曲,同时,HMGB1能够识别DNA结构扭曲并与之高亲和力结合。因此,DNA可以作为HMGB1活性的有效调节配体。设计合成扭曲的DNA,提高其与HMGB1的结合活性。在初步研究中,Chim2A显著降低内毒素血症小鼠死亡率。但是,所有DNA类HMGB1抑制剂的热稳定性差[熔点(Tm)约37 ℃],限制了对此类药物的进一步研究。为了提高扭结双链DNA的酶耐受能力和热稳定性,Musumeci等[33]合成一个发夹环双链DNA,类似Chim2A的单分子双螺旋。该化合物含有未成对腺嘌呤扭结,同时由额外的3个腺嘌呤连接两个互补链形成环状。
使用天然核苷酸形成发夹环,可以避免化学修饰的潜在毒性。化合物1比2A双体的热稳定性和酶耐受能力大幅度提高,与HMGB1蛋白质的作用效果也通过BIA实验得到证实。进而,DNA双螺旋类似物能够剂量依赖性抑制蛋白诱导的细胞迁徙,IC50<1 nmol/L,比已知的HMGB1抑制剂甘草酸降低3个数量级。另一种较为成功的改造是:在自然发夹结构DNA的5′端和成环的位置插入寡聚乙二醇间隔物,以提高酶的稳定性、热稳定性,以及它的整体药动学性质。热稳定性数据(Tm=66 ℃)和活性(IC50在nmol/L级)证实ODN可能是目前已知的HMGB1抑制剂的最优候选。生物稳定性分析为进一步的体内实验研究提供了积极的结果[33]。
3 展 望
HMGB1参与包括败血症、风湿性关节炎、动脉粥样硬化、慢性肾病、SLE、癌症等慢性炎症与自身免疫性疾病的发病机制。目前通过采用RAGE结合的HMGB1竞争性拮抗剂(如重组的HMGB1的Box A功能域或S100P衍生的RAGE肽),天然/合成的小分子HMGB1特异性抑制剂(如甘草皂苷或甲磺酸加贝酯),以及生物来源物质(如HMGB1的特异性抗体、多肽、蛋白质或弯曲的DNA based双链)等多种策略,在控制HMGB1及其诱导的相关疾病都已取得了令人鼓舞的研究结果。另外,目前关于HMGB1抑制剂的最新研究进展不包括Selex方法筛选出的抗HMGB1适体(aptamers),此类适体具有高度活性和优异的选择性,这一新兴研究领域将会被深入研究。
由于HMGB1本身参与了基本上所有病理生理过程,已发现众多活性物质通过阻止HMGB1的合成、释放并降低其活性等,从多种层面发挥HMGB1抑制剂的功能[34],因此,HMGB1抑制剂的临床应用范围也非常广泛。将HMGB1作为靶蛋白的抑制剂的深入研究也为HMGB1相关疾病和炎症损伤的防治提供了新的研究方向,特别是在肿瘤治疗方面,阻断HMGB1的释放抑制剂与放化疗的联合应用是否可以更有效地提高肿瘤放化疗的疗效? 是否出现肿瘤类型的差异?抑制剂是否通过阻断HMGB1诱导的炎症,降低放化疗所产生的正常组织和器官损伤,从而达到保护正常组织和器官的效果?这些问题的深入研究势必为HMGB1在临床上作为重要的靶点提供全新的研究领域和课题。
【参考文献】
[1]Musumeci D,Roviello G N,Montesarchio D. An overview on HMGB1 inhibitors as potential therapeutic agents in HMGB1-related pathologies[J]. Parmacol Ther,2014,141(3):347-357.
[2]Wang HaiChao,Bloom O,Zhang MingHuang,etal. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science,1999,285(5425):248-251.
[3]Arumugam T,Ramachandran V,Gomez S B,etal. S100P-derived RAGE antagonistic peptide(RAP) reduces tumor growth and metastasis[J].Clin Cancer Res,2012,18(16):4356-4364.
[4]Ogiku M,Kono H,Hara M,etal. Glycyrrhizin prevents liver injury by inhibition of high-mobility group box 1 production by Kupffer cells after ischemia-reperfusion in rats[J]. J Pharmacol Exp Ther,2011,339(1):93-98.
[5]Gwak G Y,Moon T G,Lee D H,etal.Glycyrrhizin attenuates HMGB1-induced hepatocyte apoptosis by inhibiting the p38-dependent mitochondrial pathway[J]. World J Gastroenterol,2012,18(7):679-684.
[6]Vitali R,Palone F,Cucchiara S,etal. Dipotassium glycyrrhizate inhibits HMGB1-dependent inflammation and ameliorates colitis in mice[J]. PLoS One,2013,8(6):e66527.
[7]Kim S W,Jin YinChuan,Shin J H,etal. Glycyrrhizic acid affords robust neuroprotection in the postischemic brainviaanti-inflammatory effect by inhibiting HMGB1 phosphorylation and secretion[J]. Neurobiol Dis,2012,46(1):147-156.
[8]Zhai ChangLin,Zhang MeiQi,Zhang Yun,etal. Glycyrrhizin protects rat heart against ischemia-reperfusion injury through blockade of HMGB1-dependent phospho-JNK/Bax pathway[J]. Acta Pharmacol Sin,2012,33(12),1477-1487.
[9]Wang Wei,Zhao Feng,Fang Yong,etal. Glycyrrhizin protects against porcine endotoxemia through modulation of systemic inflammatory response[J]. Crit Care,2013,17(2):R44.
[10]Mencucci R,Favuzza E,Meschini U. Assessment of the tolerability profile of an ophthalmic solution of 5% glycyrrhizin and copolymer PEG/PPG on healthy volunteers and evaluation of its efficacy in the treatment of moderate to severe blepharitis[J]. Clin Ophtalmol,2013,7:1403-1410.
[11]Du Dan,Yan Jun,Ren JinHong,etal.Synthesis,biological evaluation,and molecular modeling of glycyrrhizin derivatives as potent high-mobility group box-1 inhibitors with anti-heart-failure activityinvivo[J]. J Med Chem,2013,56(1):97-108.
[12]Li Wei,Li JianHua,Sama A E,etal. Carbenoxolone blocks endotoxin-induced protein kinase R (PKR) activation and high mobility group box1 (HMGB1) release[J]. Mol Med,2013,19:203-211.
[13]李金凤, 姚咏明,黄立锋,等.黄芪甲苷对高迁移率族蛋白B1介导小鼠调节性T细胞免疫功能的拮抗作用[J]. 中华创伤杂志,2013,29(10):919-923.
Li JinFeng,Yao YongMing,Huang LiFeng,etal. Antagonistic effect of astragaloside on immune response of regulatory T cells mediated by high mobility group box-1 protein in rats[J]. Chin J Trauma,2013,29(10):919-923. In Chinese with English abstract.
[14]Zhang YuSong,Li Wei,Zhu Shu,etal. Tanshinone ⅡAsodium sulfonate facilitates endocytic HMGB1 uptake[J]. Biochem Pharmacol,2012,84(11):1492-1500.
[15]Tang DaoLin,Kang Rui,Xiao WeiMin,etal.Quercetin prevents LPS-induced high-mobility group box 1 release and proinflammatory function[J]. Am J Respir Cell Mol Biol,2009,41(6):651-660.
[16]Lee W,Ku S K,Bae J W,etal. Inhibitory effects of lycopene on HMGB1-mediated pro-inflammatory responses in both cellular and animal models[J]. Food Chem Toxicol,2012,50(6):1826-1833.
[17]陈国千,王婷婷,胡志刚,等.小檗碱抑制巨噬细胞HMGB1释放及机理研究[J].国际中医中药杂志,2009,31(2):103-104.
Chen GuoQian,Wang TingTing,Hu ZhiGang,etal. Effect of berberine on HMGB1 release from macrophages and its mechanism[J]. Int J Trad Chin Med,2009,31(2):103-104. In Chinese with English abstract.
[18]扈晓宇, 张 扬. 清热化瘀中药复方对急性肝衰竭大鼠肝组织HMGB1表达的干预研究[J]. 中国实验方剂学杂志,2013,19(2):172-177.
Hu XiaoYun,Zhang Yang.Inhibitory effects of Chinese materia medica compound Qingrehuayu on HMGB1 expression of liver in acute liver failure of rats[J].Chin J Exp Trandit Med Form,2013,19(2):172-177. In Chinese.
[19]Hidaka S,Iwasaka H,Hagiwara S,etal.Gabexate mesilate inhibits the expression of HMGB1 in lipopolysaccharide-induced acute lung injury[J]. J Surg Res,2011,165(1):142-150.
[20]Wang LiNa,Zhang XiangJian,Liu LingLing,etal.Atorvastatin protects rat brains against permanent focal ischemia and downregulates HMGB1,HMGB1 receptors (RAGE and TLR4),NF-κB expression[J]. Neurosci Lett,2010,471(3):152-156.
[21]Liu Ming,Yu Ying,Jiang Hong,etal. Simvastatin suppresses vascular inflammation and atherosclerosis in ApoE-/-mice by downregulating the HMGB1-RAGE axis[J]. Acta Pharmacol Sin,2013,34(6):830-836.
[22]童秋玲, 周瑞瑞,张 旭,等.丙酮酸乙酯对大鼠局灶性脑缺血再灌注后不同脑区HMGB1、NF-κB表达的影响[J]. 医学研究杂志,2013,42(2):140-144.
Tong QiuLing,Zhou RuiRui,Zhang Xu,etal. Effects of ethyl pyruvate on expression of HMGB1 and NF-κB in different brain regions following focal cerebral ischemia-reperfusion in rats[J].J Med Res,2013,42(2):140-144. In Chinese with English abstract.
[23]Li M L,Wang X F,Tan Z J,etal. Ethyl pyruvate administration suppresses growth and invasion of gallbladder cancer cellsviadownregulation of HMGB1-RAGE axis[J]. Int J Immunopathol Pharmacol,2012,25(4):955-965.
[24]Zhang Jing,Zhu JinShui,Zhou Zhou,etal.Inhibitory effects of ethyl pyruvate administration on human gastric cancer growthviaregulation of the HMGB1-RAGE and Akt pathwaysinvitroandinvivo[J].Oncol Rep,2012,27(5):1511-1519.
[25]Li Xun,Wang LiKun,Wang LuWen,etal. Cisplatin protects against acute liver failure by inhibiting nuclear HMGB1 release[J]. Int J Mol Sci,2013,14(6):11224-11237.
[26]徐 丽,鲍红光,张 勇,等.外源性一氧化碳释放分子对脓毒症大鼠肺组织高迁移率族蛋白B1表达的影响[J]. 中华临床医师杂志(电子版),2013,7(7):2981-2985.
Xu Li,Bao HongGuang,Zhang Yong,etal. Effect of extrinsic carbon monoxide releasing-molecule-2 on the expression of high mobility group box 1 in rats with sepsis-induced lung injury[J]. Chin J Clinicians (Elect Ed),2013,7(7):2981-2985. In Chinese with English abstract.
[27]Kuroiwa Y,Takakusagi Y,Kusayanagi T,etal. Identification and characterization of the direct interaction between methotrexate (MTX) and high-mobility group box 1 (HMGB1) protein[J]. PLoS One,2013,8(5):e63073.
[28]Schierbeck H,Lundbäck P,Palmblad K,etal. Monoclonal anti-HMGB1 (high mobility group box chromosomal protein 1) antibody protection in two experimental arthritis models[J]. Mol Med,2011,17(9-10):1039-1044.
[29]Zickert A,Palmblad K,Sundelin B,etal. Renal expression and serum levels of high mobility group box 1 protein in lupus nephritis[J]. Arthritis Res Ther,2012,14(1):R36.
[30]Nagato M,Okamoto K,Abe Y,etal. Recombinant human soluble thrombomodulin decreases the plasma high-mobility group box-1 protein levels,whereas improving the acute liver injury and survival rates in experimental endotoxemia[J]. Crit Care Med,2009,37(7):2181-2186.
[31]Hagiwara S,Iwasaka H,Matsumoto S,etal.Invivoandinvitroeffects of the anticoagulant,thrombomodulin,on the inflammatory response in rodent models[J]. Shock,2010,33(3):282-288.
[32]朱琳琳, 牛志国,宋向凤,等.蝎素组分Ⅲ对THP1细胞HMGB1表达的影响[J].中国免疫学杂志,2012,28(1):38-40.
Zhu LinLin,Niu ZhiGuo,Song XiangFeng,etal. The effect of SVC-Ⅲ on the expression of HMGB1 in THP1 cells[J]. Chin J Immunol,2012,28(1):38-40. In Chinese with English abstract.
[33]Musumeci D,Roviello G N,Montesarchio D,etal. Hairpin ODN-based ligands as potential inhibitors of HMGB1 cytokine activity[J]. RSC Adv,2013,3(1):12176-12184.
[34]Kang Rui,Chen RuoChan,Zhang QiuHong,etal. HMGB1 in health and disease[J]. Mol Aspects Med,2014,pii:S0098-2997(14)00037-5. [Epub ahead of print].

