6,6’-取代1,1’-联二萘酚衍生的手性磷酸的合成
(1.西南民族大学化学与环境保护工程学院,四川成都 610041;2.西南交通大学地球科学与环境工程学院,四川成都 610031)
(1.西南民族大学化学与环境保护工程学院,四川成都 610041;2.西南交通大学地球科学与环境工程学院,四川成都 610031)
1,1'-联二萘酚(1)经溴代反应制得6,6'-二溴-1,1'-联二萘酚(2);2经苄基保护羟基制得2,2'-二苄氧基-6,6'-二溴-1,1'-联二萘(3);3经Ullmann缩合在6,6'-位引入甲氧基制得2,2'-二苄氧基-6,6'-二甲氧基-1,1'-联二萘(4b);3经Kumada偶联反应在6,6'-位引入正己基制得2,2'-二苄氧基-6,6'-二正己基-1,1'-联二萘(4c);4b和4c经还原脱去苄基制得6,6'-位取代1,1'-联二萘酚(5b和5c);2,5b和5c分别与三氯氧磷反应合成了3种1的6,6'-位取代手性磷酸(6a~6c),其结构经1H NMR和31P NMR表征。其中6c为新化合物。
1,1'-联二萘酚;手性磷酸;Ullmann缩合;Kumada偶联;手性配体;合成
1,1'-联二萘酚(1)衍生的手性磷酸是一种高效的有机小分子催化剂[1]。自2004年 Akiyama[2]和Terada小组[3]报道手性磷酸催化的亚胺的不对称Mannich反应以来,手性磷酸在亚胺参与的碳碳键形成[2-3]、碳氮键形成[4]、碳氧键形成[5]等反应中均表现出优良的选择性,制备了一系列具有生物活性的手性胺化合物。早期研究表明在很多反应中,只有在1的3,3'-位引入位阻较大的9-蒽基和2,4,6-三异丙基苯基时,手性磷酸才能具有优异的对映选择性。虽然大位阻基团的引入取得了高对映选择性,但这些基团的位阻同时给手性磷酸的制备带来一定的困扰。在1的3,3'-位引入取代基时,需要预先在其3,3'-位引入两个碘原子,而该反应通常获得的是极性相近的单双碘取代混合物,给产物纯化带来难度。
基于以上考虑,本文尝试利用经典的合成方法,在1的6,6'-位引入取代基,制备1的6,6'-位取代手性磷酸。即1经溴代反应合成了6,6'-二溴-1,1'-联二萘酚(2);2经苄基保护羟基制得2,2'-二苄氧基-6,6'-二溴-1,1'-联二萘(3);3经Ullmann缩合在其6,6'-位引入甲氧基制得2,2'-二苄氧基-6,6'-二甲氧基-1,1'-联二萘(4b);3经Kumada偶联反应在其6,6'-位引入正己基制得2,2'-二苄氧基-6,6'-二正己基-1,1'-联二萘(4c);4b和4c经还原脱去苄基制得6,6'-位取代1,1'-联二萘酚(5b和5c);2,5b和5c分别与三氯氧磷反应合成了三种1的6,6'-位取代手性磷酸(6a~6c),其结构经1H NMR和31P NMR表征。其中6c为新化合物。
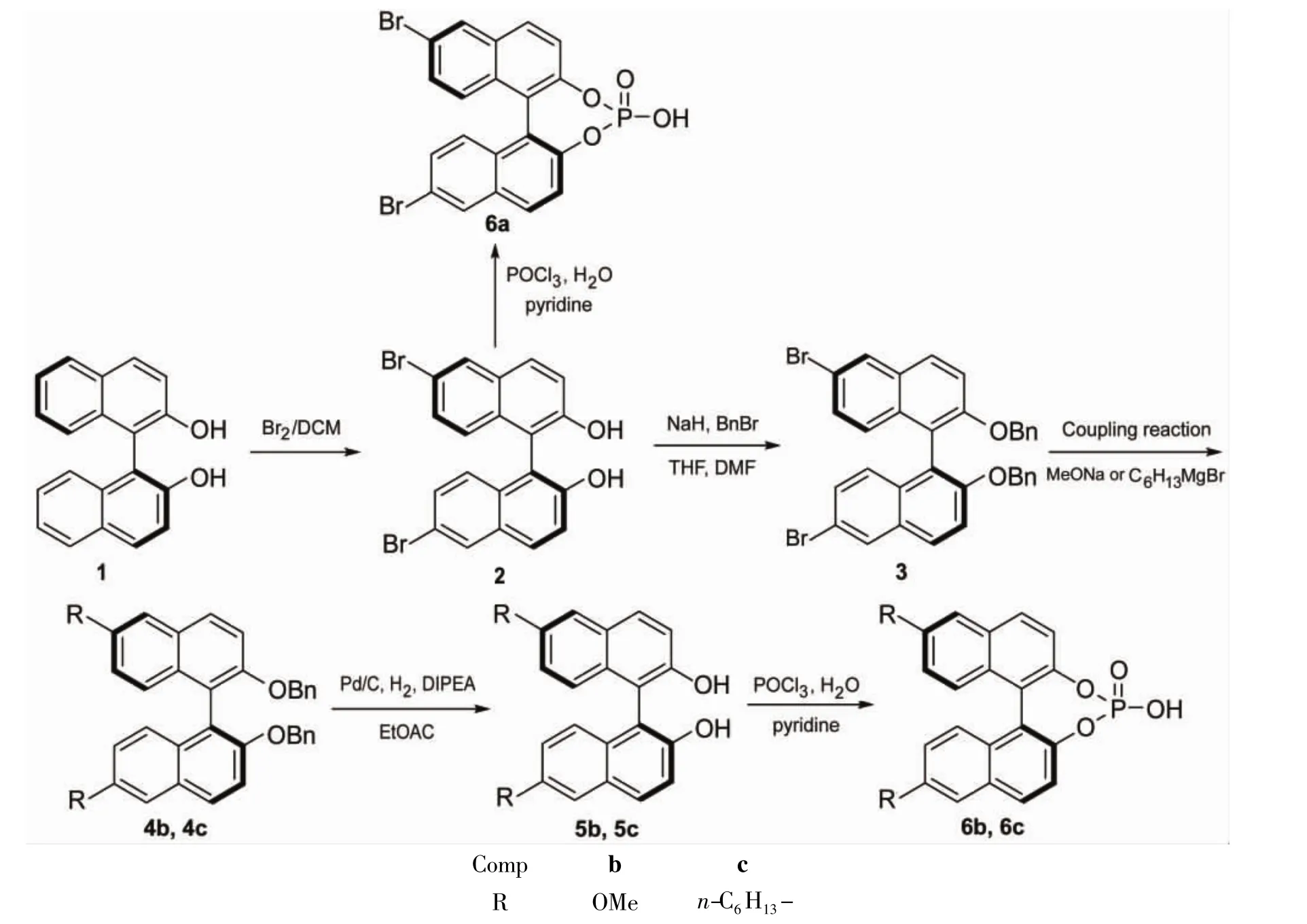
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker 300 MHz型或400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标)。
1,连云港手性化学公司;氯化亚铜和1,3-双(二苯基膦丙烷)二氯化镍,Merck公司;钯碳和甲醇钠,国药集团化学试剂公司;液溴、三氯氧磷、氢化钠、苄溴、二异丙基乙基胺(DIPEA)和碳酸钠,成都科龙试剂公司;其余所用试剂均为分析纯,其中四氢呋喃、吡啶、乙醚和N,N'-二甲基甲酰胺用前经干燥蒸馏处理。
1.2 合成
(1)2的合成[6]
在反应瓶中依次加入二氯甲烷50 mL和1 2.86 g(10 mmol),搅拌使其溶解;置于丙酮-干冰中冷却至-78℃,缓慢滴加液溴1.4 mL(27 mmol),滴毕,反应3 h;自然升至室温,反应30 min。加饱和Na2S2O3溶液50 mL淬灭过量溴,过滤,分液,水相用二氯甲烷(3×50 mL)萃取,合并有机相,用饱和食盐水(3×50 mL)洗涤,无水Na2SO4干燥,浓缩后经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得白色粉末2 3.65 g,产率82%;1H NMR δ:7.98(d,J=2.2 Hz,2H),7.80 (d,J=8.8 Hz,2H),7.31(dd,J=8.8 Hz,2.2 Hz,2H),7.30(d,J=9.2 Hz,2H),6.90(d,J= 8.8 Hz,2H),4.69(br,2H)。
(2)3的合成
在反应瓶中加入 60%NaH 648 mg(16.2 mmol),氩气置换并保护反应,加入干燥THF 10 mL,冰浴冷却,搅拌下缓慢滴加 2 3 g(6.75 mmol)的THF(20 mL)和DMF(25 mL)溶液,滴毕,反应1 h;缓慢滴加苄溴1.9 mL(16 mmol),自然升至室温,反应过夜(TLC检测)。用饱和食盐水淬灭反应,分液,水相用二氯甲烷(3×10 mL)萃取,合并萃取液,用无水Na2SO4干燥,浓缩后经硅胶柱层析(洗脱剂:A=20∶1)纯化得无色晶体3 4.1 g,产率98%;1H NMR δ:8.02(d,J=2.0 Hz,2H),7.82(d,J=9.0 Hz,2H),7.41(d,J= 9.2 Hz,2H),7.28(d,J=2.0 Hz,1H),7.18~7.08(m,7H),7.09~6.93(m,6H),5.03(s,4H)。
(3)4b的合成[6]
在干燥Schlenk反应管中加入3 312 mg(0.5 mmol),氯化亚铜25 mg(0.25 mmol)和甲醇钠270 mg(5 mmol),氩气置换并保护反应。加入干燥DMF 5 mL和干燥甲醇5 mL,搅拌下回流反应过夜。加水淬灭反应,分液,水相用二氯甲烷(3×10 mL)萃取,合并有机层和萃取液,用无水Na2SO4干燥,浓缩后经硅胶柱层析(洗脱剂:A= 20∶1)纯化得无色晶体4b 237 g,产率90%;1H NMR δ:7.77(d,J=9.1 Hz,2H),7.34(d,J=9.2 Hz,2H),7.15~7.06(m,10H),6.99~6.89(m,6H),4.98(s,4H),3.98(s,6H)。
(4)4c的合成[6]
在干燥 Schlenk反应管中加入 3 468 mg (0.75 mmol)和1,3-双(二苯基膦丙烷)二氯化镍4 mg(7.5 μmol),置换为氩气氛并保护反应。加入干燥脱气乙醚5 mL,搅拌使其溶解;冰浴冷却,缓慢滴加正己基溴化镁(2.25 mL)的THF(2.25 mL)溶液,滴毕,回流反应18 h。冷却至0℃,加入H2O 5 mL淬灭反应,缓慢加入2 mol·L-1盐酸10 mL,分液,有机相用二氯甲烷(3×10 mL)萃取,合并有机层和萃取液,用饱和食盐水(3×10 mL)洗涤,无水Na2SO4干燥,浓缩得白色粉末4c 409 mg,产率86%,直接进行下步反应。
(5)5b的合成
在反应瓶中依次加入乙酸乙酯2 mL,4b 237 mg(0.45 mmol)和10%Pd/C 24 mg,搅拌使其溶解;加入DIPEA 78 μL(0.45 mmol),置换为氢气氛并保护反应。于室温反应24 h(TLC检测)。硅藻土过滤,滤液浓缩得白色粉末5b 155.9 mg,产率>99%;1H NMR δ:7.83(d,J=9.1 Hz,2H),7.34(d,J=9.2 Hz,2H),7.20(d,J=2.6 Hz,2H),7.07~6.95(m,4H),4.92(br,2H),3.90(s,6H)。
用4c代替4b,用类似方法合成5c。
(6)6a的合成
在25 mL干燥Schlenk反应管中加入2 444 mg(1 mmol),氩气保护,搅拌下加入吡啶2.5 mL,冰水浴冷却下加入三氯氧磷186 μL(2.0 mmol),升温至70℃反应3 h;冰水浴冷却下缓慢加入水1.5 mL,升温至70℃,反应3 h。冷却至室温,加二氯甲烷50 mL,用6 mol·L-1盐酸(3× 10 mL)洗涤除去吡啶,分液,有机相用无水Na2SO4干燥,浓缩后经硅胶柱层析[洗脱剂:V (二氯甲烷)∶V(甲醇)=30∶1]纯化得棕色固体6a 466 mg,产率92%;1H NMR(CD3OD)δ:8.06 (s,2H),7.88(d,J=8.8 Hz,2H),7.50(d,J=8.8 Hz,2H),7.30(d,J=9.2 Hz,2H),7.08(d,J=9.2 Hz,2H);31P NMR(CD3OD)δ: 3.44。
分别用5b和5c代替2,用类似方法合成6b和6c。
6b:白色固体158 mg,产率86%;1H NMR (CD3OD)δ:7.99(d,J=8.8 Hz,2H),7.49(d,J=9.2 Hz,2H),7.38(d,J=2.4 Hz,2H),7.19(d,J=9.2 Hz,2H),6.99~6.96(m,2H),3.92(s,6H);31P NMR(CD3OD)δ:7.76。
6c:白色粉末316 mg,产率95%;1H NMR δ: 10.5~9.5(br,1H),7.69~7.64(m,4H),7.44 (d,J=8.4 Hz,2H),7.33(d,J=8.8 Hz,2H),7.15(d,J=8.8 Hz,2H),2.76(t,J=7.6 Hz,4H),1.74~1.66(m,4H),1.40~1.32(m,12H),0.89(t,J=6.6 Hz,6H);31P NMR δ:4.73。
2 结果与讨论
(1)2的合成
由于羟基本身是活化基团,1进行溴代反应时羟基所在苯环的α-H很容易被溴取代;同时由于在反应中加入了过量溴,产物2很容易进一步发生溴代反应生成副产物。为避免以上情况,该步反应需注意以下几点:(1)在1溶液冷却至-78℃后再滴加溴;(2)缓慢滴加液溴,同时在滴加过程中要充分搅拌,不能让液溴局部浓度过大;(3)恢复至室温后反应30 min即停止反应。最终以82%的产率获得2。
(2)6的合成
通过Ullmann缩合反应在萘环的6,6'-位引入甲氧基合成6b;通过Kumada偶联反应在萘环的6,6'-位引入正己基合成6c。需要注意的是,为避免酚羟基的干扰,在进行偶联反应前对羟基进行了保护。在偶联反应完成后脱去苄基时,实验发现传统的氢化方法转化率不高,经过一系列尝试后,我们发现4b和4c在10%Pd/C催化下,加入1 eq DIPEA时,能顺利脱去苄基游离出酚羟基而获得5b和5c。
6a~6c不仅可作为有机小分子催化剂,而且还是有用的手性配体。以6a为原料,与醋酸铑在氯苯中回流反应12 h制得手性铑络合物7(Scheme 2),产率92%;1H NMR δ:8.06(s,2 H),7.76 (d,J=8.8 Hz,2H),7.55(d,J=8.8 Hz,2H),7.4~7.39(m,2H),7.26~7.24(m,2H);31P NMR δ:20.22。

Scheme 2
3 结论
1,1'-联二萘酚经两步反应,高产率合成了6,6'-二溴-1,1'-联二萘酚衍生的手性磷酸(6a);经5步反应,成功合成了6,6'-二甲氧基和6,6'-二正己基取代的手性磷酸(6b和6c)。所涉反应均为经典反应,产率高且产物易纯化,是一种实用的合成方法。
手性磷酸6a~6c不仅是一种有效的小分子催化剂,有望在不对称合成中表现出优良的催化活性和选择性,而且是有用的手性配体,可用以合成一系列有用的手性络合物。
[1]Akiyama T.Stronger Brφnsted acids[J].Chem Rev,2007,107(12):5744-5758.
[2]Terada M.Binaphthol-derived phosphoric acid as a versatile catalyst for enantioselective carbon-carbon bond forming reactions[J].Chem Commun,2008,(35): 4097-4112.
[3]Akiyama T,Itoh J,Yokota K,et al.Enantioselective Mannich-type reaction catalyzed by a chiral Brφnsted acid[J].Angew Chem Int Ed,2004,43(12): 1566-1568.
[4]Uraguchi D,Terada M.Chiral Brφnsted acid-catalyzed direct Mannich reactions via electrophilic activation[J].J Am Chem Soc,2004,126(17):5356-5357.
[5]Rowland Gerald B,Zhang H,Rowland Emily B,et al.Brφnsted acid-catalyzed imine amidation[J].J Am Chem Soc,2005,127(45):15696-15697.
[6]Zheng W,Wojtas L,Antilla J C.Chiral phosphoric acid catalyzed peroxidation of imines[J].Angew Chem Int Ed,2010,49(37):6589-6591.
[7]Hamada T,Fukuda T,Imanishi H,et al.Mechanism of one oxygen atom transfer from oxo(Salen)manganese(Ⅴ)complex to oiefins[J].Telrahedron,1996,52(2):515-530.
[8]Hodgson D M,Stupple P A,Pierard F Y T M,et al.Development of dirhodium(ii)-catalyzed generation and enantioselective 1,3-dipolar cycloaddition of carbonyl ylides[J].Chem Eur J,2001,7(20):4465-4476.
6,6'-取代1,1'-联二萘酚衍生的手性磷酸的合成*
王稚京1,郑远勤1,叶 玲2,杨学军1,李雪锋1
Synthesis of Chiral Phosphoric Acids Derivated from 6,6ˊ-Disubsituted BINOL
WANG Zhi-jing1, ZHENG Yuan-qin1, YE Ling2, YANG Xue-jun1, LI Xue-feng1
(1.College of Chemistry and Environment Protection Engineering,Southwest University for Nationalities,Chengdu 610041,China;2.Faculty of Geosciences and Environmental Engineering,Southwest Jiaotong University,Chengdu 610031,China)
The methoxyl group or hexyl group were successfully introduced to 6,6'-position of the BINOL scaffold to get 2,2'-bis(benzyloxy)-6,6'-dimethoxy-1,1'-binaphthalene(4b)and 2,2'-bis (benzyloxy)-6,6'-dihexyl-1,1'-binaphthalene(4c)through Ullmann condensation and Kumada coupling,respectively.(6,6'-Dibromo-1,1'-binaphthyl-2,2'-yl)-phosphoric acids(6a)was efficiently obtained by a two-step reaction from BINOL.(6,6'-Dimethoxy-1,1'-binaphthyl-2,2'-yl)-phosphoric acid(6b)and(6,6'-dihexyl-1,1'-binaphthyl-2,2'-yl)-phosphoric acid(6c)were synthesized by deprotection of 4b or 4c then condensation with phosphoryl trichloride.The structures were characterized by1H NMR and31P NMR.6c was a new compound.
BINOL;chrial phosphoric acid;Ullmann condensation;Kumada coupling;chiral ligand;synthesis
O625.3;O627.5
A
1005-1511(2014)01-0081-04
2013-08-27;
2013-12-08
中央高校基本科研业务费专项基金资助项目(11NZYBS05);西南民族大学研究生创新型科研项目(CX2013SZ24)
王稚京(1988-),男,汉族,内蒙古巴彦淖尔人,硕士研究生,主要从事不对称合成与催化的研究。
李雪锋,副教授,E-mail:coolorganic@163.com

