环糊精相转移催化水相高效合成糖基三氮唑
(1.安徽中医药大学药学院,合肥 230031;2.安徽省药物研究所,安徽合肥 230022)
(1.安徽中医药大学药学院,合肥 230031;2.安徽省药物研究所,安徽合肥 230022)
以水为溶剂,β-环糊精为相转移催化剂,β-D-葡萄炔丙苷(或木糖炔丙苷)和叠氮化物在一价铜催化下经CuAAC反应合成了一系列糖基三氮唑衍生物(4a~4d或5a~5d),收率78% ~95%,其结构经1H NMR,13C NMR,2D NOESY和ESI-MS表征。其中4b,4c和5a~5d为新化合物。该反应具有高度的立体专一性和区域选择性。
环糊精;炔丙苷;CuAAC反应;1,2,3-三氮唑;合成
自2002年Meldal[1]和Sharpless[2]等人以铜(Ⅰ)催化改进了Huisgen环加成反应以来,CuAAC反应(即一价铜催化叠氮炔基环加成反应)备受关注,并广泛应用于新药发现[3]和生物传感[4]等领域,作为点击化学最具代表性的反应而成为有机化学家们的有力工具。近年来,CuAAC反应与前沿的合成技术如负载法[5-6]、微波促进[7]、离子液体[8]、相转移催化[9]等紧密结合成为合成方法学研究的热点之一。
水无毒易得、环境友好,是有机反应中最为理想的溶剂;然而,CuAAC反应以纯水为溶剂的报道较少[10],多为水-水溶性有机溶剂如THF,DMSO和t-BuOH的混合溶剂。环糊精外表面具有亲水性、中央空腔具有疏水性,此“空穴”包合有机分子可有效提高其水溶性,环糊精及其衍生物已经被广泛用作相转移催化剂[11]。
从分子设计的角度考虑,在杂环中引入糖基可提高母核的水溶性、降低毒性、提高生物利用度。基于此,本文设 计 并 优 化 以 水 为 溶 剂,β-环 糊精为相转移催化剂,β-D-葡萄糖炔丙苷(1)和苄基叠氮(3a)为原料,经CuAAC法构建(1-N-苄基)-1,2,3-三氮唑-4-基-亚甲基-β-D-葡萄糖苷(4a)的模型反应,经结构确认发现该反应具有高度的立体专一性和区域选择性。为进一步考察反应的适用性,对底物进行扩展,合成了7个糖基三氮唑衍生物(4b~4d和5a~5d,Scheme 1),收率78% ~95%,其结构经1H NMR,13C NMR,2D NOESY和ESI-MS表征。其中4b,4c和5a~5d为新化合物。
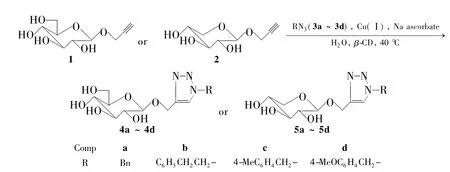
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker DRX400型核磁共振仪(D2O为溶剂,TMS为内标);LCQ DECA Plus型HPLC-ESI-MS高效液相色谱-质谱联用仪。
1[12],β-D-木糖炔丙苷(2)[12](收率约65%)和叠氮化物(3a~3d)[13](收率70% ~85%)按文献方法合成;薄层分析硅胶板,HSGF254,烟台市芝罘黄务硅胶开发试验厂;其余所用试剂均为分析纯。
1.2 合成
(1)4和5的合成(以4a为例)
在反应瓶中依次加入1 2.4 g(11 mmol),3a 1.6 g(12 mmol),抗坏血酸钠(VcNa)0.2 g(1.1 mmol),CuSO40.14 g(0.55 mmol),β-环糊精(β-CD)0.39 g(0.33 mmol),CuCl 0.01 g(0.1 mmol)及蒸馏水50 mL,搅拌下于40℃反应16 h[TLC跟踪,展开剂:A=V(乙酸乙酯)∶V(甲醇)= 2∶1]。浓缩后经硅胶柱层析(洗脱剂:A=4∶1)纯化得无色糖浆状物4a 3.5 g。
分别以3b,3c和3d代替3a,用类似方法合成无色糖浆状物4b~4d。
(1-N-苄基)-1,2,3-三氮唑-4-基-亚甲基-β-D-葡萄糖苷(4a):收率91%;1H NMR δ:7.97(s,1H,ArH),7.26~7.37(m,5H,PhH),5.50(s,2H,PhCH2),4.88(d,J=12.0 Hz,1H,OCH2),4.74(d,J=12.0 Hz,1H,OCH2),4.43 (d,J=8.0 Hz,1H,1-H),3.76(dd,J=12.4 Hz,8.0 Hz,1H,2-H),3.62(dd,J=12.0 Hz,2.0 Hz,1H,4-H),3.34~3.42(m,3H,3,6-H),3.21(m,1H,5-H);13C NMR δ:54.9,62.7,63.0,71.6,75.0,77.8,78.0,103.6,125.3,129.1,129.6,130.0,136.7,146.1;ESI-MS m/z:352.12{[M+H]+}。
(1-N-苯乙基)-1,2,3-三氮唑-4-基-亚甲基-β-D-葡萄糖苷(4b):收率88%;1H NMR δ:7.89 (s,1H,ArH),7.02~7.18(m,5H,PhH),5.04 (s,2H,PhCH2),4.83(d,J=12.0 Hz,1H,OCH2),4.65(d,J=12.0 Hz,1H,OCH2),4.43 (d,J=8.0 Hz,1H,1-H),3.76(dd,J=12.4 Hz,8.0 Hz,1H,2-H),3.62(dd,J=12.0 Hz,2.0 Hz,1H,4-H),3.38~3.42(m,3H,3,6-H),3.34(d,2H,NCH2),3.15(m,1H,5-H);ESI-MS m/z:366.18{[M+H]+}。
(1-N-对甲基苄基)-1,2,3-三氮唑-4-基-亚甲基-β-D-葡萄糖苷(4c):收率90%;1H NMR δ: 7.85(s,1H,ArH),7.15~7.19(m,5H,PhH),5.42(s,2H,PhCH2),4.83(d,J=12.0 Hz,1H,OCH2),4.71(d,J=12.0 Hz,1H,OCH2),4.41(d,J=8.0 Hz,1H,1-H),3.83(dd,J= 12.4 Hz,8.0 Hz,1H,2-H),3.62(dd,J=12.0 Hz,2.0 Hz,1H,4-H),3.34~3.42(m,3H,3,6-H),3.18(m,1H,5-H),2.35(s,3H,CH3);ESI-MS m/z:366.18{[M+H]+}。
(1-N-对甲氧基苄基)-1,2,3-三氮唑-4-基-亚甲基-β-D-葡萄糖苷(4d):收率83%;1H NMR δ: 7.95(s,1H,ArH),6.95~7.17(m,5H,Ph),5.43(s,2H,PhCH2),4.82(d,J=12.0 Hz,1H,OCH2),4.72(d,J=12.0 Hz,1H,OCH2),4.43(d,J=8.0 Hz,1H,1-H),3.82(dd,J= 12.4 Hz,8.0 Hz,1H,2-H),3.75(s,3H,OCH3),3.59(dd,J=12.0 Hz,2.0 Hz,1H,2-H),3.36~3.43(m,3H,3,6-H),3.13(m,1H,5-H);ESI-MS m/z:382.2{[M+H]+}。
以2代替1,用类似方法合成5a~5d。
(1-N-苄基)-1,2,3-三氮唑-4-基-亚甲基-β-D-木糖苷(5a):淡黄色糖浆状物,收率 85%;1H NMR δ:7.87(s,1H,ArH),7.11~7.28(m,5H,PhH),5.35(s,2H,PhCH2),4.78(d,J= 5.2 Hz,1H,OCH2),4.62(d,J=5.2 Hz,1H,OCH2),4.35(d,J=8 Hz,1H,1-H),3.82(m,1H),3.55(m,2H),3.32(m,1H),3.11(m,1H);ESI-MS m/z:322.15{[M+H]+}。
(1-N-苯乙基)-1,2,3-三氮唑-4-基-亚甲基-β-D-木糖苷(5b):无色糖浆状物,收率 85%;1H NMR δ:7.93(s,1H,ArH),7.15~7.28(m,5H,PhH),4.95(m,2H,PhCH2),4.68(d,J= 5.2 Hz,1H,OCH2),4.59(d,J=5.2 Hz,1H,OCH2),4.28(d,J=8 Hz,1H,1-H),3.87(m,1H),3.65(m,2H),3.41(m,2H),3.32(m,1H),3.23(m,1H);ESI-MS m/z:336.18{[M+ H]+}。
(1-N-对甲基苄基)-1,2,3-三氮唑-4-基-亚甲基-β-D-木糖苷(5c):淡黄色糖浆状物,收率78%;1H NMR δ:7.85(s,1H,ArH),7.01~7.10(m,5H,PhH),5.35(s,2H,PhCH2),4.65(d,J=5.2 Hz,1H,OCH2),4.54(d,J= 5.2 Hz,1H,OCH2),4.32(d,J=8 Hz,1H,1-H),3.82(m,1H),3.58(m,2H),3.32(m,1H),3.18(m,1H),2.25(s,3H,OCH3);ESIMS m/z:335.16{[M+H]+}。
(1-N-对甲氧基苄基)-1,2,3-三氮唑-4-基-亚甲基-β-D-木糖苷(5d):淡黄色糖浆状物,收率95%;1H NMR δ:7.96(s,1H,ArH),6.95~7.21(m,5H,PhH),5.45(s,2H,PhCH2),4.82(d,J=5.2 Hz,1H,OCH2),4.76(d,J= 5.2 Hz,1H,OCH2),4.35(d,J=7.6 Hz,1H, 1-H),3.78(s,3H,OCH3),3.73(m,1H,2-H),3.45(m,2H),3.32(m,1H),3.18(m,1H);ESI-MS m/z:352.2{[M+H]+}。
2 结果与讨论
2.1 合成工艺优化
以1和3a的CuAAC反应为模板,考察溶剂、催化剂和助剂对4a收率的影响,结果见表1。由表1可见,以水为溶剂,在5 mol%CuSO4,1 mol% CuCl,3 mol%β-CD和10 mol%VcNa作用下4a收率最高(91%,No.10);另外,单一CuSO4(通过抗坏血酸钠还原得一价Cu,No.5)的催化效果不及CuSO4加入少量CuCl(1 mol%,No.8),说明一价Cu对催化反应起主要作用;β-CD用量稍大时4a收率却略有下降(No.11),这是因为β-CD的空穴状结构能包裹产品而被除去。
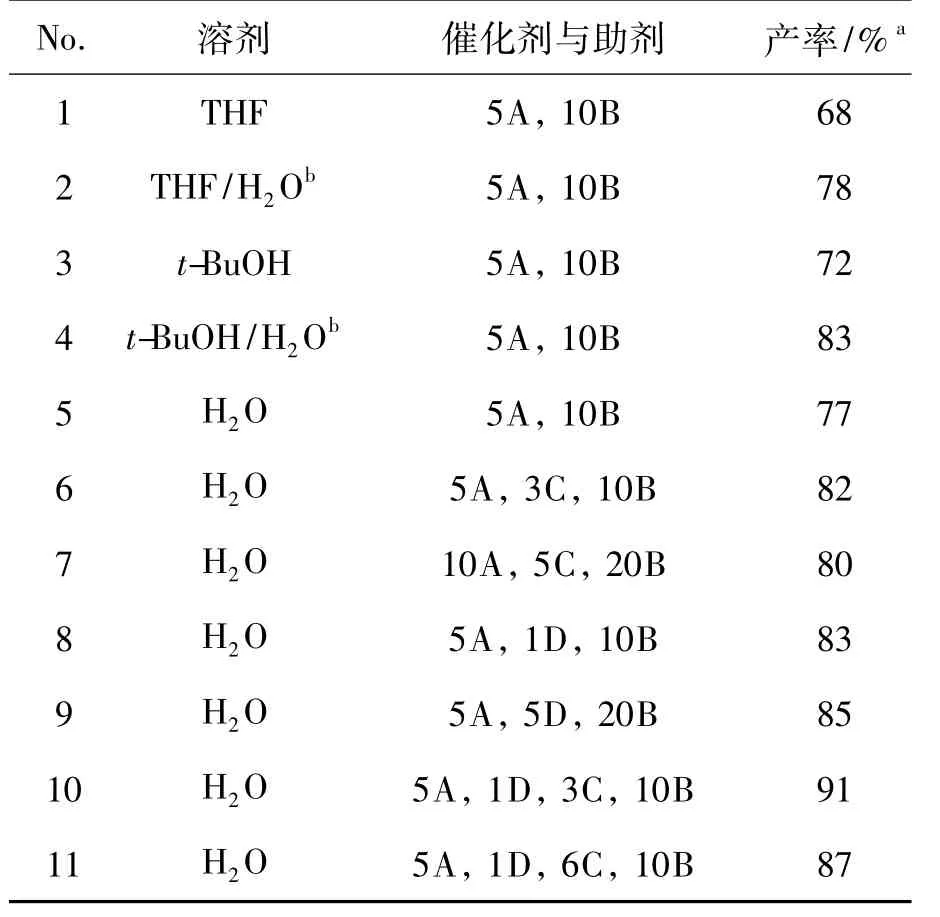
表1 CuAAC反应条件的优化*Table 1 Process optimization of CuAAC reaction
2.2 反应立体专一性和区域选择性考察
经1H NMR,13C NMR,2D NOESY和ESI-MS对4a中各H质子准确归属,从而考察反应的立体专一性和区域选择性。原料1中异头碳上的1-H(糖链上仅有的二重峰H信号)与2-H之间的偶合常数J1,2=8 Hz,而4a中4.43处的1-H信号也是偶合常数J1,2=8 Hz的二重峰。根据Karplus公式可得1-H与2-H之间的二面角接近180°,均为β-构型,进而证明了反应在立体化学上的专一性,最容易翻转的半缩醛H质子构型保持。接着,利用2D NOESY考察CuAAC反应在区域选择性上是生成1,4-取代而非1,5-取代三氮唑产物。5'-H(7.97)与7'-H(4.88和4.74)和6'-H(5.50)均有NOE信号,说明了5'-H与两个亚甲基的空间距离都很小,即1,4-取代的三氮唑骨架;而7'-H与6'-H之间没有NOE信号,说明不是1,5-取代的三氮唑骨架(Chart 1)。

Chart 1
2.3 底物拓展
选择β-D-葡萄糖炔丙苷和β-D-木糖炔丙苷为底物,因为只有葡萄糖和木糖可以简洁制备光学纯单糖炔丙苷(异头碳均为β-构型),而其它单糖以此简洁方法制得的都是α/β-混合型炔丙苷,进而不利于对产物光学纯度的表征。以光学纯炔丙苷为原料更易验证反应前后的立体专一性,同时NMR易于归属和解析,也能方便说明反应是1,4-取代三氮唑的区域选择性。
3 结论
优化了水相中β-环糊精催化的葡萄炔丙苷和苄基叠氮的CuAAC反应,并通过核磁分析证明了反应具有高度的立体专一性和区域选择性。为验证方法适用性继而拓展底物,选择2个炔丙苷即β-D-葡萄炔丙苷和β-D-木糖炔丙苷和4个叠氮化物合成了 8个糖基三氮唑衍生物,收率78%~95%。
该方法操作简便、高效绿色,为此类化合物的合成提供了新途径。
[1]Christian W T,Caspar C,Morten M.Peptidotriazoles on solid phase:[1,2,3]-Triazoles by regiospecific copper(Ⅰ)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides[J].J Org Chem,2002,67 (9):3057-3064.
[2]Vsevolod V R,Luke G G,Valery V F,et al.A stepwise Huisgen cycloaddition process:Copper(Ⅰ)-catalyzed regioselective ligation of azides and terminal alkynes[J].Angew Chem Int Ed,2002,41(14): 2596-2599.
[3]于金兰,武钦佩,张青山,等.1,4-二取代-1,2,3-三唑衍生物的合成[J].合成化学,2010,18(1): 56-60.
[4]魏学,郑玉国,薛伟,等.新型1,2,4-三唑并[3,4-b]-1,3,4-噻二唑类衍生物合成及其抗病毒活性[J].合成化学,2010,18(5):595-598.
[5]Mohammad N S,Somayeh B,Mohammad M D,et al.Copper-doped silica cuprous sulfate(CDSCS)as a highly efficient and new heterogeneous nano catalyst for[3+2]Huisgen cycloaddition[J].Tetrahedron,2012,68:7812-7821.
[6]Aure'lien A,Stefan C,Patrick P,et al.‘Click chemistry’in CuI-zeolites:A convenient access to glycoconjugates[J].Tetrahedron,2008,64:8922-8929.
[7]Henning S G,Valentin W.One-pot precedure for diazo transfer and azide-alkyne cycloaddition:Triazole linkages from amines[J].Org Lett,2007,9(1):1-4.
[8]Alessandra V,Angela C,Cinzia C,et al.Copper (Ⅰ)-catalyzed azide-alkyne cycloadditions in ionic liquids under amine-free conditions[J].Synthesis,2010,(12):2043-2048.
[9]Jung-Ah S,Yeong-Gweon L,Kyung-Hee L.Coppercatalyzed azide-alkyne cycloaddition reaction in water using cyclodextrin as a phase transfer catalyst[J].J Org Chem,2012,77:4117-4122.
[10]Liu M,Reiser O.A copper(Ⅰ)isonirtile complex as a heterogeneous catalyst for azide-alkyne cycloaddition in water[J].Org Lett,2011,13(5):1102-1105.
[11]Keiko T.Organic reactions mediated by cyclodextrins[J].Chem Rev,1998,98:2013-2033.
[12]Hari B M,Srinivas R G.A highly diastereoselective,practical synthesis of allyl,propargyl 2,3,4,6-tetra-O-acetyl-β-D-gluco,β-D-galactopyranosides and allyl,propargyl heptaactyl-β-D-lactosides[J].Carbohy Res,1998,307(2):351-354.
[13]McNulty J,Keskar K.Discovery of a robust and efficient homogeneous silver(Ⅰ)catalyst for the cycloaddition of azides onto terminal alkynes[J].Eur J Org Chem,2012:5462-5470.
环糊精相转移催化水相高效合成糖基三氮唑*
顾振龙1,程 杰2,柏 俊2,吕 凌2
Efficient Synthesis of Glycosylated Triazole in Water Using Cyclodextrin as Phase Transfer Catalyst
GU Zhen-long1, CHENG Jie2, BAI Jun2, LV Ling2
(1.School of Pharmacy,Anhui University of Chinese Medicine,Hefei 230031,China;2.Anhui Institute of Materia Medica,Hefei 230022,China)
A series of glycosyl triazole derivatives(4a~4d or 5a~5d)with the yield of 78% ~95% were synthesized by CuAAC reaction of glucose propargyl glycoside(or xylose propargyl glycoside) and azide catalyzed by copper(Ⅰ)using β-cyclodextrin as the phase transfer catalyst in water.The structures,stereospecificity and regioselectivity of the reaction were characterized by1H NMR,13C NMR,2D NOESY and ESI-MS.4b,4c and 5a~5d were new compounds.
cyclodextrin;propargyl glycoside;CuAAC reaction;1,2,3-triazole;synthesis
O614.3;O629.11;O626.26
A
1005-1511(2014)01-0053-04
2013-08-12;
2013-11-29
安徽省自然科学基金资助项目(1208085QB23)
顾振龙(1988-),男,汉族,安徽淮南人,硕士研究生,主要从事药物合成及糖化学的研究。E-mail:382276229@qq.com
程杰,博士研究生,助理研究员,E-mail:chengjie_234@163.com

