二甲双胍对人胰腺癌细胞株CFPAC-1增殖与凋亡的影响
贺志龙 夏伟 冯璜 许春芳
二甲双胍是一种传统的口服降糖药,一直用于2型糖尿病的治疗。然而,2005年Evans等[1]通过流行病学研究首次报道了二甲双胍能够明显地降低2型糖尿病患者的肿瘤发病率。后有多项实验研究证实了二甲双胍的抗肿瘤作用,包括胃癌、肺癌、乳腺癌等[2-4]。目前有临床研究证实,二甲双胍能显著降低糖尿病患者患胰腺癌的风险[5-6]。本研究应用二甲双胍干预人胰腺癌细胞株CFPAC-1,观察干预后细胞增殖及凋亡的变化,探讨二甲双胍抗胰腺癌的相关机制。
材料与方法
一、CCK-8法检测细胞增殖抑制率
人胰腺癌细胞株CFPAC-1由苏州大学附属第一医院血研所惠赠,常规培养、传代。取对数生长期细胞,并调整细胞密度为2.5×104/ml。96孔板的每孔中加入100 μl细胞悬液,培养24 h。弃培养液,分别加入含1、2.5、5、10、20、40、60 mmol/L二甲双胍(Sigma公司)的培养液继续培养24、48、72 h,每孔加入CCK-8溶液(日本同仁公司)10 μl,37℃孵育4 h。以未处理的细胞作为对照组,以培养液作为空白对照。每组设6个复孔。实验结束后上酶联免疫检测仪检测。以空白对照孔调零,测各孔450 nm波长处的吸光度值(A450值)。细胞增殖抑制率(inhibitory rate,IR)=(对照组A450值-处理组A450值)/对照组A450值×100%。实验重复3次,取均值。
二、流式细胞仪分析细胞周期
细胞贴壁生长达80%融合时弃培养液,加入含10、20、40 mmol/L二甲双胍培养液继续培养48 h,以未处理细胞作为对照组。用含EDTA的胰酶消化后收集各组细胞,PBS洗涤、离心3次,加入 70%乙醇,置4℃过夜。PBS洗涤2次后,加入碘化丙啶(PI)染色液(碧云天公司),置37℃避光温浴30 min,上BIOLISA流式细胞仪分析细胞周期。实验重复3次,取均值。
三、Annexin V/PI双染色法检测细胞凋亡
取10、20、40 mmol/L二甲双胍处理48 h及未处理的贴壁培养细胞,用不含EDTA的胰酶消化后收集各组细胞,PBS洗涤3次,加入1×Binding Buffer 500 μl、Annexin V-FITC(Molecular Probes公司)5 μl、PI 1 μl混匀,室温避光反应15 min,上流式细胞仪检测细胞凋亡。实验重复3次,取均值。
四、蛋白质印迹法检测蛋白表达
收集10、20、40 mmol/L二甲双胍处理48 h及未处理的贴壁培养细胞,用裂解液裂解细胞获取蛋白,用BCA比色法测定蛋白浓度。取50 μg蛋白行蛋白质印迹法检测磷酸化AMPK(p-AMPK)、脂肪合酶(FAS)、cyclin D1、Bcl-xl、Bax、caspase-3、survivin蛋白表达。兔抗人p-AMPK、FAS、Bcl-xl、Bax一抗均购自EPITMICE公司,鼠抗人caspase-3和cyclin D1抗体、兔抗人survivin抗体、鼠抗人β-actin单抗、羊抗兔及羊抗鼠二抗均购自碧云天生物技术有限公司。最后ECL发光,X胶片曝光、显影和定影。应用图像分析仪扫描,以目的条带与内参β-actin条带的灰度值比表示蛋白的相对表达量。
五、统计学分析
结 果
一、二甲双胍对CFPAC-1细胞增殖的影响
二甲双胍呈浓度及时间依赖性抑制人胰腺癌CFPAC-1细胞的生长(表1),差异具有统计学意义(P值均<0.05)。培养48 h时的IC50浓度约为20 mmol/L。
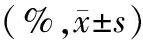
注:与对照组比较,aP<0.05;与24 h抑制率比较,bP<0.05;与48 h抑制率比较,cP<0.05
二、二甲双胍对CFPAC-1细胞周期的影响
10、20、40 mmol/L二甲双胍处理CFPAC-1细胞48 h后,G0/G1细胞比例显著增多(表2),G2/M期、S期细胞比例显著减少,差异均有统计学意义(P值均<0.05)。
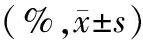
表2 二甲双胍对CFPAC-1细胞周期的影响
三、二甲双胍对CFPAC-1细胞凋亡的影响
10、20、40 mmol/L二甲双胍处理CFPAC-1细胞48 h后,细胞凋亡率分别为(13.77±1.31)%、(22.63±1.45)%、(32.97±3.19)%,较对照组的(3.01±0.49)%均有显著增加(F=136.903,P<0.05,图1)。
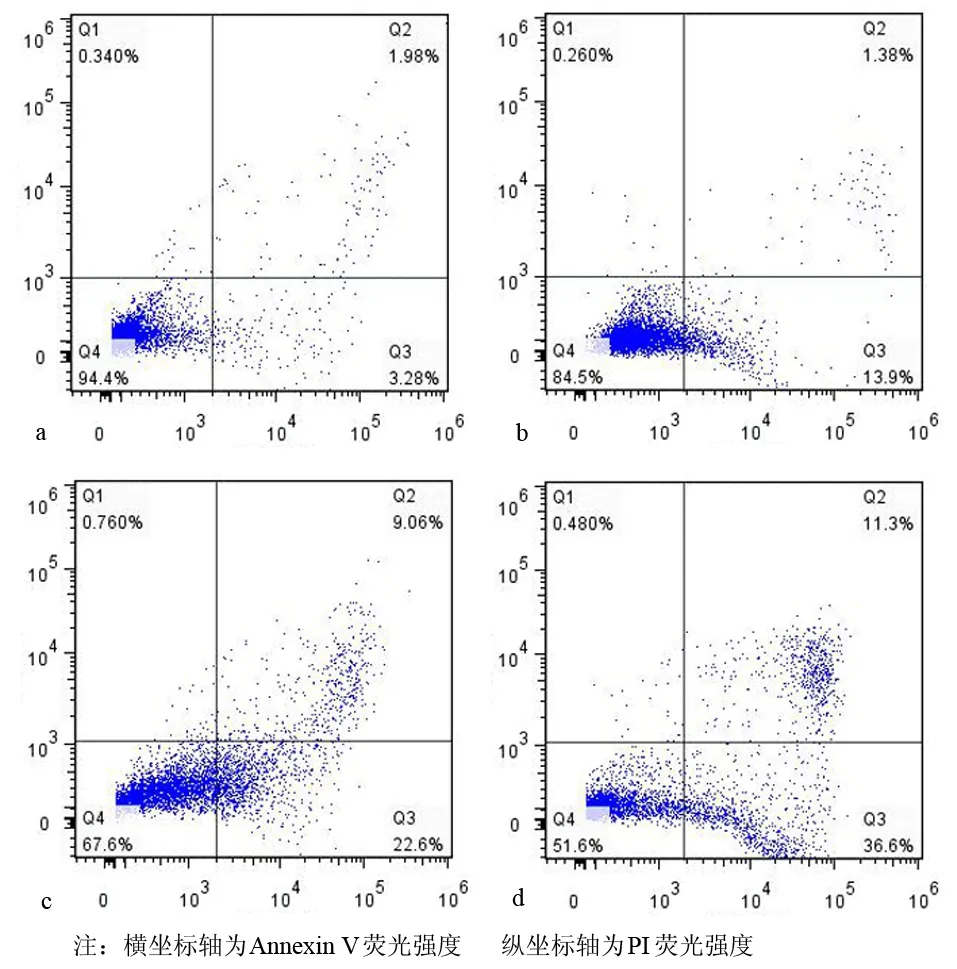
图1 对照组(a)及10、20、40 mmol/L二甲双胍(b、c、d)处理CFPAC-148 h后的凋亡细胞
四、二甲双胍对CFPAC-1细胞相关蛋白表达的影响
不同浓度二甲双胍处理CFPAC-1细胞48 h后,p-AMPK、Bax、caspase-3表达明显增强,FAS、cyclin D1,Bcl-xl、survivin表达减弱(图2,表3),差异均有统计学意义(P值均<0.05),提示二甲双胍处理后AMPK信号通路激活,细胞凋亡增加。

图2 对照组(1)及10、20、40 mmol/L二甲双胍处理组(2、3、4)CFPAC-1细胞相关蛋白的表达
讨 论
糖尿病与胰腺癌的关系复杂,一方面糖尿病是胰腺癌早期症状之一,另一方面糖尿病已经是仅次于吸烟、肥胖之后的胰腺癌发病的第三大危险因素[7-8]。作为治疗2型糖尿病一线药物的二甲双胍在抗胰腺癌方面的研究显得格外重要,并更具临床意义。
AMPK是一种丝氨酸/苏氨酸蛋白酶,其磷酸化后形成的p-AMPK是AMPK的活化形式。AMPK是调节细胞能量代谢最重要的“传感器”,激活的p-AMPK能够抑制细胞能量代谢,抑制细胞合成蛋白质、脂肪酸等物质[9],并可抑制AMPK信号通路下游多种因子的生成及活性,从而调节细胞周期、凋亡,最终影响肿瘤细胞的增殖[10]。在胃癌、乳腺癌、前列腺癌等研究中发现,二甲双胍抗肿瘤作用与激活AMPK信号通路有关[2,4]。本研究结果显示,二甲双胍处理CFPAC-1细胞48 h后能显著增加p-AMPK表达量,提示二甲双胍可激活AMPK信号通路。
FAS是脂肪酸生物合成过程中将小分子碳单位聚合成长链脂肪酸的关键酶。肿瘤细胞的脂肪酸代谢与正常组织细胞不同,其依赖于细胞内FAS来合成脂肪酸以满足癌细胞分裂、增殖的需要[11]。在胰腺癌组织中FAS水平也显著升高,并与胰腺癌的预后呈负相关[12]。本研究结果显示,二甲双胍处理CFPAC-2细胞后,FAS的蛋白下调,提示AMPK信号通路激活后可抑制FAS合成[13]。
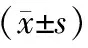
表3 二甲双胍处理CFPAC-1细胞48 h后相关蛋白的表达量
Cyclin D1在调控细胞增殖周期G1期到S期的转换中起着重要的作用。有研究表明,二甲双胍通过激活AMPK从而抑制mTOR,导致下游靶分子解磷酸化,进而下调cyclin D1的表达,将肿瘤细胞阻滞于G0/G1期[14-15]。本研究结果显示,二甲双胍处理CFPAC-1细胞后,G0/G1期细胞比例增多,S期及G2/M期细胞比例减少,证实二甲双胍通过激活AMPK信号通路而下调cyclin D1的表达,阻滞细胞于G0期/G1期,抑制细胞增殖。
肿瘤的发生不仅与细胞增殖异常有关,同时也与细胞凋亡异常有密切关系。Bcl-xl是一种经典的凋亡抑制基因,Bax为凋亡促进基因,caspase-3则是凋亡途径最终的效应因子。Bcl-xl/Bax比值下调可破坏线粒体外膜完整性,释放细胞色素C等进入胞质,激活caspase-3,进而引起染色体断裂、细胞凋亡[16]。survivin是一种凋亡抑制蛋白,可直接抑制caspase-3活性而有效阻断细胞凋亡[17]。本研究结果显示,二甲双胍处理CFPAC-1细胞后Bcl-xl表达下调,Bax表达上调,Bcl-xl/Bax比值降低,survivin表达下调,caspase-3表达上调,从而诱导CFPAC-1细胞凋亡。
参 考 文 献
[1] Evans JM, Donnelly LA, Emslie-Smith AM, et al. Metformin and reduced risk of cancer in diabetic patients[J]. BMJ, 2005,330(7503):1304-1305.
[2] Kato K,Gong J,Iwama H, et al. The antidiabetic drug metformin inhibits gastric cancer cell proliferation in vitro and in vivo[J]. Mol Cancer Ther, 2012, 11(3):549-560.
[3] Wu N, Gu C, Gu H, et al.Metformin induces apoptosis of lung cancer cells through activating JNK/p38 MAPK pathway and GADD153[J]. Neoplasma, 2011, 58(6):482-490.
[4] Zhuang Y, Miskimins WK. Cell cycle arrest in Metformin treated breast cancer cells involves activation of AMPK, downregulation of cyclin D1, and requires p27Kip1 or p21Cip1[J]. J Mol Signal, 2008,3:18.
[5] Li D, Yeung SC, Hassan MM, et al. Antidiabetic therapies affect risk of pancreatic cancer[J]. Gastroenterology, 2009,137(2):482-488.
[6] Zhang P, Li H, Tan X, et al. Association of metformin use with cancer incidence and mortality: meta-analysis[J]. Cancer Epidemiol, 2013, 37(3): 207-218.
[7] Gullo L, Pezzilli R. Diabetes and pancreatic cancer[J]. Pancreas, 2004, 28(4):451.
[8] Fisher WE. Diabetes: risk factor for the development of pancreatic cancer or manifestation of the disease[J]? World J Surg, 2001, 25(4):503-508.
[9] Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling[J]. Circ Res, 2007, 100(3): 328-341.
[10] Ben Sahra I, Le Marchand-Brustel Y, Bost F, et al. Metformin in cancer therapy: a new perspective for an old antidiabetic drug[J]? Mol Cancer Ther, 2010, 9(5):1092-1099.
[11] Alo PL, Visca P, Trombetta G, et al. Fatty acid synthase (FAS) predictive strength in poorly differentiated early breast carcinomas[J]. Tumori, 1999,85(1):35-40.
[12] Witkiewicz AK, Nguyen KH, Dasgupta A, et al. Co-expression of fatty acid synthase and caveolin-1 in pancreatic ductal adenocarcinoma: implications for tumor progression and clinical outcome[J]. Cell Cycle, 2008,7(19):3021-3025.
[13] Steinberg GR, Kemp BE. AMPK in Health and Disease[J]. Physiol Rev, 2009, 89(3):1025-1078.
[14] Zhao L, Wen ZH, Jia CH, et al. Metformin induces G1 cell cycle arrest and inhibits cell proliferation in nasopharyngeal carcinoma cells[J]. Anat Rec (Hoboken), 2011, 294(8): 1337-1343.
[15] Chen HP,Shieh JJ,Chang CC,et al.Metformin decreases hepatocellular carcinoma risk in a dose-dependent manner:population-based and in vitro studies[J].Gut,2013,62(4):606-615.
[16] Breckenridge DG, Xue D. Regulation of mitochondrial membrane permeabilization by BCL-2 family proteins and caspases[J]. Curr Opin Cell Biol, 2004, 16(6): 647-652.
[17] Shin S, Sung BJ, Cho YS, et al. An anti-apoptotie protein human survivin is a direct inhibitor of Caspase-3 and -7[J].Biochemistry,2001,40(4):1117-1123.

