玻璃体对视网膜色素上皮细胞收缩作用的研究△
黄雄高 魏雁涛 张少冲
玻璃体对视网膜色素上皮细胞收缩作用的研究△
黄雄高 魏雁涛 张少冲
玻璃体;视网膜色素上皮细胞;细胞收缩;细胞骨架蛋白
目的探讨人玻璃体体外培养对人视网膜色素上皮细胞收缩性的影响。方法低传代(3-5代)人视网膜色素上皮细胞分两组体外培养,一组用普通培养液(含体积分数10%胎牛血清的DMEM/F12)培养,一组用体积分数25%玻璃体培养,应用I型胶原凝胶收缩实验检测收缩力的变化,应用免疫荧光技术检测细胞骨架蛋白F-actin、α-SMA和vinculin的定位染色,应用免疫印迹技术检测α-SMA和vinculin蛋白的表达。结果与普通培养液培养相比,低传代的人视网膜色素上皮细胞玻璃体中培养48 h,胶原凝胶面积为(22 127±2072)像素,明显大于在普通培养液中的凝胶面积(16 084±1154)像素,细胞收缩能力显著下降,两组比较差异有统计学意义(t=4.412,P=0.012)。在普通培养液中,F-actin、vinculin主要分布于细胞周边,vinculin形成的粘连斑粗大;而在玻璃体中培养后,F-actin重组,在细胞的一端形成扁平伪足结构,vinculin主要分布于细胞扁平伪足端和细胞中央,形成的粘连斑明显变小。玻璃体培养后α-SMA蛋白表达显著下降,与普通培养液相比差异有统计学意义(t=2.845,P=0.047);vinculin蛋白表达无显著变化(t=0.198,P=0.852)。结论玻璃体培养可导致视网膜色素上皮细胞收缩性下降,这一作用可能与α-SMA蛋白表达下调及vinculin重新分布有关。
[眼科新进展,2014,34(7):624-627]
增生性玻璃体视网膜病变的特征是沿着玻璃体和视网膜形成增生膜,增生膜的牵引导致视网膜脱离和视力丧失[1]。视网膜色素上皮(retinal pigment epithelium,RPE)细胞被证实经历了上皮间质转分化过程,并在增生膜的发展和收缩中起主要作用[2]。我们前期实验已证实,玻璃体体外培养具有诱导RPE细胞间质转分化作用,并发现玻璃体培养引起的RPE细胞收缩性下降的现象与传统观点相悖[3]。鉴于此,我们进行了深入研究,以期进一步证实和探讨可能的机制,现将结果报告如下。
1 材料与方法
1.1细胞培养健康人捐献的眼球来源于中山大学中山眼科中心眼库,排除既往有眼病史者。分离视网膜获取玻璃体,剪碎玻璃体纤维,通过0.22 μm滤器(美国Millipore公司)过滤收集玻璃体,等量分装后-80 ℃冰箱保存。所用玻璃体体积分数为25%,通过应用3份体积的普通培养液[即含体积分数10%胎牛血清(杭州四季青公司)的DMEM/F12(美国Gibco公司)]与1份体积的玻璃体混合配制而成[4]。按照Zheng等[5]报道的方法,通过胰蛋白酶消化分离,用普通培养液培养RPE细胞。低传代细胞(3-5代)通过CK18免疫荧光染色鉴定[6-7]用于实验。RPE细胞分为两组,分别应用普通培养液(含体积分数10%胎牛血清的DMEM/F12培养液)和体积分数25%的玻璃体进行培养。
1.2凝胶收缩将I型鼠尾胶原(美国Invitrogen公司)配制成浓度为2 mg·mL-1的中和胶原混合液加入24孔板,每孔0.5 mL。放于37 ℃、含体积分数5%CO2细胞培养箱内孵育60 min后凝固成胶原凝胶。胰蛋白酶消化RPE细胞后用无血清DMEM/F12培养液重悬计数,将细胞密度为250×106L-1的RPE细胞接种于凝固的凝胶上(单层培养)。2~8 h后细胞贴壁伸展,分组分别换为普通培养液或体积分数25%玻璃体液,用无菌显微镊将凝胶与孔板壁分离使之悬浮,37 ℃、含体积分数5%CO2细胞培养箱中孵育48 h后拍照,应用Image-Pro Plus 6.0软件分析胶原凝胶面积(以像素为单位),取3次独立实验数据进行统计学分析。
1.3免疫荧光分析将浓度为25×106L的RPE细胞悬液滴于消毒的载玻片上,待细胞贴壁后加入培养液制成细胞爬片。48 h后,细胞爬片用40 g·L-1多聚甲醛和冰冷丙酮固定,应用兔抗α-SMA抗体(美国ABcam公司)和鼠抗人vinculin抗体(美国ABcam公司)作为一抗,用Dylight564羊抗兔IgG和Dylight488羊抗鼠IgG(杭州联科公司)作为二抗完成免疫荧光检测。用FITC-鬼笔环肽(美国Sigma公司)染色F-actin,用Dylight564羊抗鼠IgG作为二抗双重染色检测vinculin。用共聚焦显微镜(LSM 510 META,Zeiss公司)观察α-SMA和vinculin蛋白定位表达的变化。
1.4免疫印迹分析两组细胞去血清培养过夜后分别加入普通培养液或体积分数25%玻璃体培养48 h,用RIPA和磷酸酶抑制剂(上海博彩公司)提取蛋白,BCA蛋白定量试剂盒(美国Thermo公司)微孔板法行蛋白定量。SDS-PAGE电泳分离蛋白,转移至PVDF膜,50 g·L-1无脂牛奶封闭,孵育兔抗人α-SMA抗体(美国ABcam公司,150稀释)、鼠抗人vinculin抗体(美国ABcam公司,11000稀释)、兔抗人GAPDH抗体(杭州贤至生物科技有限公司,1500稀释)一抗过夜。洗膜后,孵育共价结合的辣根过氧化物酶标记的羊抗兔或鼠二抗(杭州联科公司,15000稀释),采用化学发光法检测蛋白的表达。
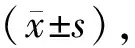
2 结果
2.1凝胶收缩胶原凝胶收缩实验结果显示,两种培养液培养48 h,体积分数25%玻璃体培养组凝胶面积为(22 127±2072)像素,普通培养液培养组凝胶面积为(16 084±1154)像素。体积分数25%玻璃体培养诱导凝胶收缩的程度显著低于普通培养液诱导的凝胶收缩,两组胶原凝胶面积比较差异具有统计学意义(t=4.412,P=0.012;见图1)。
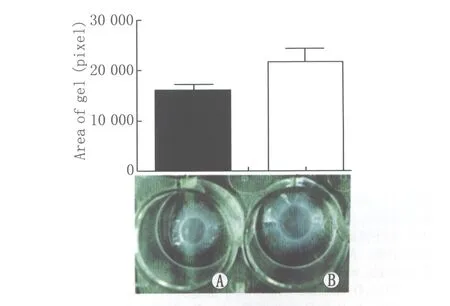
Figure 1 Images of collagen gel contraction.A:Gel contraction in normal medium after 48 hours;B:Gel contraction in volumn fraction 25% vitreous medium after 48 hours 胶原凝胶收缩像。A:普通培养液培养48 h凝胶收缩;B:体积分数25%玻璃体培养48 h凝胶收缩
2.2免疫荧光分析结果免疫荧光染色结果显示,RPE细胞在普通培养液中培养48 h后胞浆内α-SMA的染色较强,而细胞经体积分数25%玻璃体培养48 h后,胞浆内α-SMA的染色减弱,明显低于在普通培养液中的表达。F-actin骨架在普通培养液培养后主要分布于细胞的周边部,形如细胞周边的条带;当细胞在体积分数25%玻璃体中培养48 h后,F-actin纤维在细胞的一端重排,形成扇形的扁平伪足,而在细胞另一端形成锥形拖尾。经普通培养液培养48 h后,vinculin主要分布于细胞的边缘,少部分位于细胞中央,形成的粘连斑粗大;经体积分数25%玻璃体培养48 h后,vinculin大部分从周边向细胞F-actin富集的一端和细胞中央重新分布,vinculin形成的粘连斑也明显变小(图2)。
2.3免疫印迹分析结果免疫印迹结果显示,玻璃体培养48 h,α-SMA蛋白的表达显著下调,vinculin蛋白表达变化不明显(图3A);两组比较,α-SMA蛋白的表达差异具有统计学意义(t=2.845,P=0.047),vinculin蛋白表达差异无统计学意义(t=0.198,P=0.852,见图3B)。
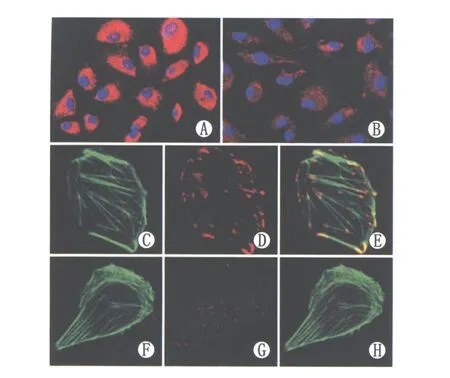
Figure 2 Immunofluorescence staining of α-SMA,F-actin and vinculin in two groups of culture medium after 48 hours.A,C,D,E in normal medium,B,F,G,H in 25% vitreous medium.A:α-SMA stained deeply in cytoplasm (×400);B:α-SMA stained weakly in cytoplasm (×400);C:F-actin was mainly distributed in circumferential bundles at the cell periphery (×1000);D:Vinculin was primarily distributed at the periphery of RPE cells,and formed large vinculin focal adhesions (×1000);E:Merged image of C and D,vinculin-formed focal adhesions were attached to the F-actin terminals (×1000);F:F-actin rearranged and formed lamellipodial projections at one edge of the cells and a cone-shaped tail at the other edge (×1000);G:Vinculin rearranged and smaller vinculin focal adhesions were primarily observed in the center of RPE cells and at the F-actin-accumulated edge (×1000);H:Merged image of F and G (×1000) 两组培养液培养48 h,免疫荧光染色检测α-SMA、F-actin及vinculin定位表达。A、C、D、E为在普通培养液中培养,B、F、G、H为在体积分数25%玻璃体中培养。A:α-SMA在胞浆染色较深(×400);B:α-SMA在胞浆染色较弱(×400);C:F-actin主要分布于细胞的周边,呈条带状(×1000);D:vinculin主要分布于细胞周边部,形成的粘连斑粗大(×1000);E:C和D合并图像,vinculin形成的粘连斑位于F-actin两端(×1000);F:F-actin重排,在细胞一端富集形成扁平伪足样结构,另一端形成锥形拖尾(×1000);G:vinculin 重新分布,主要位于扁平伪足端和细胞中央部,粘连斑明显变小(×1000);H:F和G合并图像(×1000)
3 讨论
本研究结果表明,玻璃体培养减弱了RPE细胞介导的凝胶收缩,诱导细胞骨架F-actin重新排布,vinculin形成的粘连斑重新分布并由较大变为较小。在这个过程中,α-SMA蛋白表达显著下调,但vinculin蛋白表达无显著变化。
传统观点认为,在增生性玻璃体视网膜病变过程中,RPE细胞经历了成肌纤维细胞样转分化[5,7- 8],转分化后RPE细胞的收缩性增强。我们的实验结果表明,玻璃体培养减弱了RPE细胞介导的凝胶收缩,这一结果与传统观点不一致。研究已证实,在增生性玻璃体视网膜病变模型中RPE细胞发生间质转分化,α-SMA表达显著增高[7],这一特征性的变化被认为是上皮细胞成肌样转分化的标志[7]。在视网膜前膜中,RPE细胞α-SMA的表达增加最终导致牵拉性视网膜脱离[5]。这些充分证明RPE细胞中α-SMA表达增高是细胞收缩的动力来源[5,7,9]。因此,我们分别应用免疫荧光和免疫印迹技术检测了两种培养状态下RPE细胞α-SMA的表达。结果证实玻璃体培养诱导RPE细胞α-SMA蛋白表达显著下降,与我们以前通过RT-PCR检测其mRNA表达结果一致[3]。有文献报道,玻璃体培养的RPE细胞降低了成纤维细胞生长因子(fibroblast growth factor,FGF)-2 mRNA和蛋白的表达[10],而FGF-2能诱导细胞α-SMA的表达[11]。是否玻璃体诱导的RPE细胞中FGF-2与α-SMA表达下降之间存在内在联系,尚需要进一步研究。

Figure 3 Effects of two groups of culture medium on protein expression of α-SMA and vinculin.A:Protein expression of α-SMA and vinculin in two culture media after 48 hours;B:Comparison of α-SMA and vinculin protein expression 两组培养液对α-SMA、vinculin蛋白表达的影响。A:两组培养液培养48 h α-SMA、vinculin蛋白的表达;B:α-SMA、vinculin蛋白表达的比较
本研究显示,RPE细胞在普通培养液中培养48 h后,大部分F-actin分布于细胞的周边,排列如带状,只有少部分跨过细胞浆。vinculin分布于细胞周边与F-actin纤维末端相连。这种分布有利于保持正常的细胞形态和生理张力,使细胞处于相对静止状态。细胞骨架是细胞转分化形态和可塑性的结构基础。我们以前的研究已证实,玻璃体诱导了RPE细胞间质转分化,主要表现为细胞形态改变,运动的可塑性增强[3]。这些表现是通过诱导细胞F-actin纤维丝的重组,在细胞的前进缘形成扁平伪足来实现的[12],同时通过Rac1 GTPase/LIMK1/cofilin分子信号途径来实现对细胞骨架重组和运动可塑性的调控[12-13]。文献报道,vinculin被认为是细胞机械动力的调节子,并且vinculin作为一个机械偶联子和F-actin黏附归因于vinculin在脂质膜形成大面积的粘连斑和定位分布于细胞与基质、细胞与细胞黏附以及与其他蛋白黏附的多个蛋白位点[14]。作为细胞骨架蛋白之一的vinculin在细胞运动调节上具有双重功能,具体的功能与所处的细胞外环境密切相关[15]。在二维平面基质,由vinculin所致的粘连斑和细胞骨架的稳定性阻碍了细胞迁移;但在三维细胞基质,vinculin有助于细胞收缩力的产生,帮助细胞克服立体阻碍以增强细胞的侵袭[15]。在玻璃体诱导的RPE细胞间质转分化过程中,vinculin调整其分布位点,从周边向细胞前进缘和中央移位。值得注意的是,由vinculin形成的粘连斑的面积较细胞在普通培养液中明显变小。这说明vinculin的再分布和粘连斑由大变小以及F-actin纤维丝的重排布构成了玻璃体诱导的RPE细胞运动可塑性增强的结构基础,导致细胞与细胞之间、细胞与基质间的黏附力下降,促使细胞处于相互分散的不稳定状态,从而降低了细胞的整体收缩力,可能也与细胞收缩力下降有关。另外vinculin蛋白的表达结果表明,vinculin呈组成性表达增强,两种培养液培养比较,其表达差异无统计学意义。
本研究的结果再次证明,玻璃体培养诱导的RPE细胞间质转分化属于一种非成肌样转分化类型,这一结果有利于我们深入理解玻璃体在增生性玻璃体视网膜病变中的作用。有关玻璃体诱导RPE细胞收缩力下降的分子信号机制尚需进一步研究。
1 Nagasaki H,Shinagawa K,Mochizuki M.Risk factors for proliferative vitreoretinopathy[J].ProgRetinEyeRes,1998,17(1):77-98.
2 Hiscott P,Sheridan C,Magee RM,Grierson I.Matrix and the retinal pigment epithelium in proliferative retinal disease[J].ProgRetinEyeRes,1999,18(2):167-190.
3 黄雄高,张少冲,魏雁涛,马海智,张钊填,张婷.玻璃体液诱导视网膜色素上皮细胞间质转分化作用[J].中华眼底病杂志,2013,29(2):166-170.
4 Ganti R,Hunt RC,Parapuram SK,Hunt DM.Vitreous modulation of gene expression in low-passage human retinal pigment epithelial cells[J].InvestOphthalmolVisSci,2007,48(4):1853-1863.
5 Zheng Y,Bando H,Ikuno Y,Oshima Y,Sawa M,Ohji M,etal.Involvement of rho-kinase pathway in contractile activity of rabbit RPE cellsinvivoandinvitro[J].InvestOphthalmolVisSci,2004,45(2):668-674.
6 Robey HL,Hiscott PS,Grierson I.Cytokeratins and retinal epithelial cell behaviour[J].JCellSci,1992,102(Pt 2):329-340.
7 Grisanti S,Guidry C.Transdifferentiation of retinal pigment epithelial cells from epithelial to mesenchymal phenotype[J].InvestOphthalmolVisSci,1995,36(2):391-405.
8 Lee J,Ko M,Joo CK.Rho plays a key role in TGF-beta1-induced cytoskeletal rearrangement in human retinal pigment epithelium[J].JCellPhysiol,2008,216(2):520-526.
9 Hinz B,Gabbiani G,Chaponnier C.The NH2-terminal peptide of alpha-smooth muscle actin inhibits force generation by the myofibroblastinvitroandinvivo[J].JCellBiol,2002,157(4):657-663.
10 Hunt DM,Chen WH,Hunt RC.Vitreous treatment of retinal pigment epithelial cells results in decreased expression of FGF-2[J].InvestOphthalmolVisSci,1998,39(11):2111-2120.
11 Strutz F,Zeisberg M,Ziyadeh FN,Yang CQ,Kalluri R,Müller GA,etal.Role of basic fibroblast growth factor-2 in epithelial-mesenchymal transformation[J].KidneyInt,2002,61(5):1714-1728.
12 Huang X,Wei Y,Ma H,Zhang S.Vitreous-induced cytoskeletal rearrangementsviathe Rac1 GTPase-dependent signaling pathway in human retinal pigment epithelial cells[J].BiochemBiophysResCommun,2012,419(2):395-400.
13 Huang XG,Chen YZ,Zhang ZT,Wei YT,Ma HZ,Zhang T,etal.Rac1 modulates the vitreous-induced plasticity of mesenchymal movement in retinal pigment epithelial cells[J].ClinExperimentOphthalmol,2013,41(8):779-787.
14 Mierke CT.The role of vinculin in the regulation of the mechanical properties of cells[J].CellBiochemBiophys,2009,53(3):115-126.
15 Mierke CT,Kollmannsberger P,Zitterbart DP,Diez G,Koch TM,Marg S,etal.Vinculin facilitates cell invasion into three-dimensional collagen matrices[J].JBiolChem,2010,285(17):13121-13130.
date:Jan 6,2014
Supported by National Natural Science Foundation of China(No:81170866);Hainan Natural Science Foundation(No:814367)From theZhongshanOphthalmicCenter,SunYat-senUniversity(HUANG Xiong-Gao,WEI Yan-Tao,ZHANG Shao-Chong),Guangzhou510060,GuangdongProvince,China;HainanEyeHosipitalofZhongshanOphthalmicCenter,SunYat-senUniversity(HUANG Xiong-Gao),Haikou570311,HainanProvince,China
Study on contractility of retinal pigment epithelial cells induced by vitreous in vitro
HUANG Xiong-Gao,WEI Yan-Tao,ZHANG Shao-Chong
vitreous;retinal pigment epithelial cells;contractility
ObjectiveTo investigate the effects of vitreous culturedinvitroon contractility of human retinal pigment epithelial (RPE) cells.MethodsThe low-passage cultured RPE cells divided into two groups of treatment by volumn fraction 10% serum-containing Dulbecco minimum essential medium (DMEM)/F12 medium (normal medium) or the same medium supplemented with volumn fraction 25% human vitreous (25% vitreous medium).Cell contractility was tested with collagen gel contraction analysis.Staining location of F-actin,α-smooth muscle actin (α-SMA) and vinculin were detected by immunofluorescence.The expression levels of α-SMA and vinculin were detected by Western blotting.ResultsCompared to cells cultured in normal medium,low-passage number RPE cells cultured in 25% vitreous medium for 48 hours,the collagen gel area of (22 127±2072) pixels in 25% vitreous medium was significantly greater than the gel area of (16 084±1154) pixels in normal medium,contractility of the cells decreased remarkably(t=4.412,P=0.012).In normal medium cultured RPE cells,filamentous actin (F-actin) and vinculin-forming focal adhesions mainly at margin of cell,the focal adhesions were bigger.But in 25% vitreous treated cells,F-actin reorganized and formed pseudopodia at one side of cells,vinculin-forming focal adhesions redistributed mainly from margin to center and the side of actin polymerization,and became small.The expression level of α-SMA was down-regulated significantly (t=2.845,P=0.047),the expression level of vinculin was not significantly different between the two media (t=0.198,P=0.852 5).ConclusionVitreous decrease the contractility of RPE cells,this effect may be related to the down-regulated expression of α-SMA and the redistribution of vinculin.
黄雄高,男,1975年1月出生,湖北仙桃人,博士,副主任医师,主要从事玻璃体视网膜疾病的基础与临床研究。联系电话:0898-68628561;E-mail:hxg_eye@163.com
AboutHUANGXiong-Gao:Male,born in January,1975.Medical doctor,associate chief physician.Tel:+86-898-68628561;E-mail:hxg_eye@163.com
2014-01-06
国家自然科学基金资助(编号:81170866);海南省自然科学基金资助(编号:814367)
510060 广东省广州市,中山大学中山眼科中心(黄雄高,魏雁涛,张少冲);570311 海南省海口市,中山眼科中心海南眼科医院(黄雄高)
张少冲,E-mail:zhshaochong@163.com
黄雄高,魏雁涛,张少冲.玻璃体对视网膜色素上皮细胞收缩作用的研究[J].眼科新进展,2014,34(7):624⁃627.
10.13389/j.cnki.rao.2014.0171
【实验研究】
修回日期:2014-03-05
本文编辑:盛丽娜
Accepteddate:Mar 5,2014
Responsibleauthor:ZHANG Shao-Chong,E-mail:zhshaochong@163.com
[RecAdvOphthalmol,2014,34(7):624-627]

